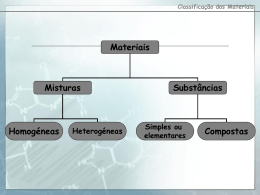
Símbolo do elemento químico número atómico Cada elemento químico tem um número atómico característico. Todos os átomos do mesmo elemento têm o mesmo número atómico. Os átomos de um elemento podem apresentar diferente nº de neutrões. Isótopos de um elemento –átomos do mesmo elemento químico (com o mesmo número atómico) e com diferente número de massa. número de massa número atómico Número atómico (Z) = número de protões Como o átomo é uma partícula globalmente neutra então: o número de protões é igual ao número de electrões. Número de massa (A) = número de protões + número de neutrões A = Z + N Carbono 12 Carbono 13 Carbono 14 6 protões 6 protões 6 protões 6 neutrões 7 neutrões 8 neutrões 6 electrões 6 electrões 6 electrões Será possível determinar a massa de um só átomo com uma balança? Porquê? A massa de um átomo depende do seu numero de protões, neutrões e electrões. Como os átomos são muito pequenos (um grão de pó contém cerca de 1016 átomos!), não é possível pesar um só átomo por mais sensível e rigorosa que seja a balança. A massa - padrão usada actualmente é 1/12 da massa do átomo de carbono-12. A massa atómica relativa de um elemento químico X, Ar(X), indica o número de vezes que a massa média dos átomos desse elemento (tendo em conta as abundâncias dos seus isótopos naturais) é superior à massa do padrão escolhido. Como determinar a massa atómica relativa de um elemento químico? Consideremos como exemplo o elemento cloro. Este elemento tem dois isótopos: Cerca de 75% é do isótopo Cerca de 25 % é do isótopo 35Cl 37Cl Assim, a massa atómica relativa do cloro, Ar(Cl), será (75 x 34,97) + (25 x 36,97) Ar = = 35,45 100
Baixar