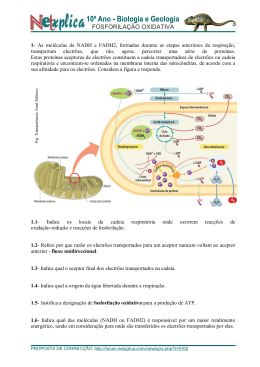
AS LIGAÇÕES QUÍMICAS O QUE SÃO AS LIGAÇÕES QUÍMICAS? São as ligações que se estabelecem entre a união de dois átomos. Existem três tipos de ligações químicas: A ligação covalente (partilha de electrões) A ligação metálica (mar de electrões livres) A ligação iónica (cedência/captação de electrões) O que é a ligação covalente? É a ligação que se estabelece entre dois átomos numa molécula por partilha de electrões. Electrões partilhados Cada átomo “disponibiliza” um ou mais electrões de valência para ser partilhado com outro átomo. O antes, enquanto eram átomos isolados… H H + E o depois de se estabelecer a ligação covalente… H : H Como se representa a ligação covalente? Por cada par de electrões de valência desenha-se um traço e se forem partilhados desenha-se um traço entre os átomos (fórmula de estrutura) Ou, representa-se os electrões de valência por pontos ou cruzes (representação de Lewis) Quantos pares de electrões poderão dois átomos partilhar? Entre dois átomos poderá haver até três pares de electrões partilhados. Se houver: Um par de electrões partilhado, diz-se que é uma ligação covalente simples Dois pares de electrões partilhados, diz-se que é uma ligação covalente dupla Três pares de electrões partilhados diz-se que é uma ligação covalente tripla Exemplos de ligações covalentes em diversas moléculas O2 Cl2 H2 H2O CO2 N2 O que são ligações covalentes polares e apolares? Nas ligações covalentes os electrões poderão ser partilhados de forma igual ou de forma diferente, dependendo da capacidade de atrair os electrões de cada átomo Ligação covalente apolar – os átomos atraem os electrões da mesma forma e a nuvem electrónica é simétrica (ex: H2, O2, F2) Ligação covalente polar – um dos átomos da ligação atrai os electrões mais intensamente do que o outro átomo o que provoca uma nuvem electrónica assimétrica , com um pólo positivo (+) e um pólo negativo (-). (ex: HF, CO, H2O) + O que é a ligação metálica? É a ligação química que se estabelece entre os átomos de diversos metais (ex: Ferro, Zinco, Alumínio, etc) Caracteriza-se pela existência de iões positivos (átomos que cederem electrões) dispostos de forma ordenada Entre os iões positivos circulam, com grande liberdade de movimento, os electrões que foram cedidos pelos átomos (é devido a este factor que os metais conduzem bem a electricidade), por isso se chama a esse conjunto “mar de electrões”. O que é a ligação iónica? É a ligação química que se estabelece entre dois átomos, em que um deles captou um ou mais electrões ao outro, formando-se um catião e um anião. (ex: NaCl, CaF2) Conclusão Na ligação covalente os átomos mantêm-se ligados por partilha de electrões Na ligação metálica os corpúsculos mantém-se ligados por atracção entre os iões e o mar de electrões Na ligação iónica os corpúsculos mantêm-se ligados devido à atracção entre o catião e o anião formados.
Baixar