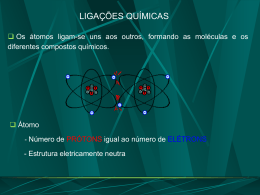
Tabela Periódica Prof. Jair Alberto O início... O que os Químicos queriam? Organizar os elementos químicos de maneira que suas semelhanças, diferenças e tendências se tornassem mais evidentes. Um dos recursos mais usados em Química para atingir essa finalidade é a tabela periódica. As primeiras tabelas foram propostas no início do século XIX; porém apresentavam mais erros do que acertos. Johann W. Dobereiner (1829) (O Primeiro Modelo de Tabela Periódica) Cálcio Estrôncio 40 88 >>> (40 + 137)/2 = 88,5 1817 - Lei das tríades de Döbereiner Bário 137 A massa atômica do elemento central da tríade era a média das massas atômicas do primeiro e terceiro membro. Muitos dos metais não podiam ser agrupados em tríades. Os elementos cloro, bromo e iodo eram uma tríade, lítio, sódio e potássio formavam outra. Germain Henry Ivanovitch Hess (1849) (O Segundo Modelo de Tabela Periódica) Iodo Bromo Cloro Flúor Telúrio Carbono Nitrogênio Selênio Boro Fósforo Enxofre Silício Arsênio Oxigênio O cientista sueco publicou no seu manual Fundamentos da Química Pura uma classificação de quatro grupos de elementos (não-metais) com propriedades químicas semelhantes (tabela ao lado). Alexander Beguyer de Chancourtoir (1862) (O Terceiro Modelo de Tabela Periódica) O químico e geólogo francês propôs um sistema denominado “parafuso telúrico.” colocou 16 elementos em ordem crescente de massa atômica, de modo a posicionar os elementos com propriedades semelhantes um por baixo do outro na geratriz do cilindro. John A.R. Newlands (1864) (O Quarto Modelo de Tabela Periódica) Sugeriu que os elementos, poderiam ser arranjados num modelo periódico de oitavas, na ordem crescente de suas massas atômicas. Colocou o elemento lítio, sódio e potássio juntos. A idéia de Newlands foi ridicularizada pela analogia com os sete intervalos da escala musical. Dimitri Ivanovich Mendeleyev (1869) Em 1869, enquanto escrevia seu livro de química inorgânica, organizou os elementos na forma da tabela periódica atual. Foi proposta por Dmitri Ivanovitch Mendeleev (1834-1907) que organizada os elementos em linhas verticais, os grupos ou famílias. O PRINCÍPIO..... Dos atuais 122 elementos químicos conhecidos,cerca de 60 já haviam sido isolados e estudados em 1869,quando o químico russo Dmitri Mendeleyev se destacou na organização metódica desses elementos. A tabela periódica de Mendeleyev.: Os espaços marcados representam elementos que Mendeleyev deduziu existirem mas que ainda não haviam sido descobertos àquela época. Mendeleev criou uma carta para cada um dos 63 elementos conhecidos. Cada carta continha o símbolo do elemento, a massa atômica e suas propriedades químicas e físicas. A solução foi encontrada quando ele dispôs os cartões em ordem crescente da massa atômica. A tabela periódica de Mendeleyev exibia semelhanças numa rede de relações vertical, horizontal e diagonal. Em 1906, Mendeleev recebeu o Prêmio Nobel por este trabalho. PERÍODOS São as LINHAS HORIZONTAIS da tabela periódica 1º Período 2º Período 3º Período 4º Período 5º Período 6º Período 7º Período 6º Período Série dos Lantanídios 7º Período Série dos Actinídios Na tabela atual, os elementos químicos estão dispostos em ordem crescente de número atômico, originando na horizontal os períodos, e na vertical (em coluna), as famílias ou grupos. Família (ou grupo) 1º período (ou série) 2º período (ou série) 3º período (ou série) 4º período (ou série) 5º período (ou série) 6º período (ou série) 7º período (ou série) Série dos Lantanídeos Série dos Actinídeos Organização da Tabela Periódica Famílias ou grupos •A tabela atual é constituída por 18 famílias. Cada uma delas agrupa elementos com propriedades químicas semelhantes, devido ao fato de apresentarem a mesma configuração eletrônica na camada de valência. 2 1 3 Li 1s 2s Na - 1s 2s 2 p 3s 2 11 2 6 1 Família IA = todos os elementos apresentam 1 elétron na camada de valência. •Existem, atualmente, duas maneiras de identificar as famílias ou grupos. A mais comum é indicar cada família por um algarismo romano, seguido de letras A e B, por exemplo, IA, IIA, VB. Essas letras A e B indicam a posição do elétron mais energético nos subníveis. •No final da década passada, a IUPAC propôs outra maneira: as famílias seriam indicadas por algarismos arábicos de 1 a 18, eliminando-se as letras A e B. Os elementos que constituem essas famílias são denominados elementos representativos, e seus elétrons mais energéticos estão situados em subníveis s ou p. Nas famílias A, o número da família indica a quantidade de elétrons na camada de valência . Elas recebem ainda nomes característicos. Família ou grupo Nº de elétrons na camada de valência IA 1 Distribuição eletrônica da camada de valência ns¹ Nome Metais alcalinos ns² Metais alcalinos terrosos IIA 2 IIIA 3 ns² np¹ Família do boro IVA 4 ns² np² Família do carbono VA 5 ns² np³ Família do nitrogênio VIA 6 ns² np4 Calcogênios VIIA 7 ns² np5 Halogênios ns² np6 Gases nobres VIIIA ou O 8 Localização dos elementos nas Famílias B Os elementos dessas famílias são denominados genericamente elementos de transição. Uma parte deles ocupa o bloco central da tabela periódica, de IIIB até IIB (10 colunas), e apresenta seu elétron mais energético em subníveis d. IIIB d 1 IVB d 2 VB d VIB 3 d 4 VIIB d 5 VIIIB d 6 d 7 d Exemplo: Ferro (Fe) / Z = 26 1s²2s²2p63s²3p64s²3d6 Período: 4º Família: 8B 8 IB IIB 9 10 d d Localização dos elementos nas Famílias A A distribuição eletrônica do átomo de um dado elemento químico permite que determinemos sua localização na tabela. Exemplo: Sódio(Na) – Z = 11 1s²2s²2p63s¹ Período: 3º Família: 1A – Metais Alcalinos O esquema abaixo mostra o subnível ocupado pelo elétron mais energético dos elementos da tabela periódica. Metais, (semi-metais), ametais e gases nobres Apresentam brilho quando polidos; Sob temperatura ambiente, apresentam-se no estado sólido, a única exceção é o mercúrio, um metal líquido; São bons condutores de calor e eletricidade; São resistentes maleáveis e dúcteis Existem nos estados sólidos (iodo, enxofre, fósforo, carbono) e gasoso (nitrogênio, oxigênio, flúor); a exceção é o bromo, um não-metal líquido; não apresentam brilho, são exceções o iodo e o carbono sob a forma de diamante; não conduzem bem o calor a eletricidade, com exceção do carbono sob a forma de grafite; Geralmente possuem mais de 4 elétrons na última camada eletrônica, o que lhes dá tendência a ganhar elétrons, transformando-se em íons negativos (ânions) Semimetais são elementos com propriedades intermediárias entre os metais e os não-metais, estes também chamados de ametais ou metalóides. Em geral, o semimetal, é sólido, quebradiço e brilhante. Funciona como isolante elétrico à temperatura ambiente, mas torna-se igual aos metais como condutor elétrico, se aquecido, ou quando se inserem certos elementos nos interstícios de sua estrutura cristalina. Elementos químicos que dificilmente se combinam com outros elementos – hélio, neônio, argônio, criptônio, xenônio e radônio. Possuem a última camada eletrônica completa, ou seja, 8 elétrons. A única exceção é o hélio, que possui uma única camada, a camada K, que está completa com 2 elétrons. Apresenta propriedades muito particulares e muito diferentes em relação aos outros elementos. Por exemplo, tem apenas 1 elétron na camada K (sua única camada) quando todos os outros elementos têm 2. Teoria do Octeto A Teoria do Octeto determina que os átomos dos elementos ligam-se uns aos outros na tentativa de completar a sua camada de valência com oito elétrons, ou 2, se for a primeira. Sendo assim, o átomo é considerado estável quando apresentar 8 elétrons em sua última camada da eletrosfera. Na tentativa de atingir a estabilidade sugerida pela Regra do Octeto, cada elemento precisa ganhar ou perder (compartilhar) elétrons nas ligações químicas, como no exemplo a seguir: Ligação de Sódio (Na) e Cloro (Cl): o átomo de sódio doa um elétron para o átomo de Cloro. Em uma visão mais dinâmica, este compartilhamento de elétrons ficaria assim: Vamos observar o seguinte: • O átomo de Sódio doa um elétron para o átomo de Cloro; • Forma-se o íon Na+ com oito elétrons na camada de valência (última camada da eletrosfera); • O íon de cloro aparece com uma carga negativa (Cl-), indicando que recebeu um elétron e atingiu a estabilidade. • Segundo a Teoria do Octeto, as moléculas ou íons tendem a ser mais estáveis quando a camada de elétrons externa de cada um dos seus átomos está preenchida com a configuração de um gás nobre (oito elétrons). Essa teoria explica porque os elementos sempre formam ligações: para atingirem a estabilidade Um átomo que satisfaz A TEORIA DO OCTETO é estável e é aplicada principalmente para os elementos do subgrupo A (representativos) da tabela periódica H (Z = 1) 1s1 INSTÁVEL He (Z = 2) 1s2 ESTÁVEL F (Z = 9) 1s2 2s2 2p5 INSTÁVEL Ne (Z = 10) 1s2 2s2 2p6 ESTÁVEL Na (Z = 11) 1s2 2s2 2p6 3s1 INSTÁVEL Questão 01 Para cada uma das afirmativas abaixo, julgue verdadeiro ou falso justificando todos os itens: I - O elemento químico de número atômico 30 tem 3 elétrons de valência. II - Na configuração eletrônica do elemento químico com número atômico 26 há 6 elétrons no subnível 3d. III – 3s2 3p3 corresponde a configuração eletrônica dos elétrons de valência do elemento químico de número atômico 35. IV - Na configuração eletrônica do elemento químico de número atômico 21 há 4 níveis energéticos. Então... •Os átomos dos elementos do primeiro grupo (grupo dos metais alcalinos) têm um elétron de valência (isto é, um elétron no último nível de energia preenchido). Por isso, têm tendência a formar íons monopositivos. •Os átomos dos elementos do segundo grupo possuem dois elétrons de valência, pelo que, originam íons dipositivos. •Os átomos dos elementos do grupo 16, apresentam seis elétrons de valência, pelo que dão origem a íons dinegativos (íons com duas cargas negativas). •Os átomos que pertencem ao grupo 17 (família dos halogéneos) têm sete elétrons de valência, pelo que originam íons mononegativos. •Os átomos que pertencem ao grupo 18, denominados gases raros, são átomos estáveis, apresentam os seus níveis de energia completamente preenchidos, e por isso não originam íons. Aparecem na natureza sob a forma de átomos isolados. RAIO ATÔMICO Números de prótons ( número atômico Z ): o átomo que apresentar o maior número de prótons exerce uma maior atração sobre os seus elétrons, o que ocasiona uma diminuição do seu tamanho (atração núcleoelétron). Raio iônico para íons isoeletrônicos (iguais números de elétrons), o de menor número atômico será o maior, pois apresenta menor atração entre o núcleo e os elétrons. 8O 2- > 19F > 1+ 11Na > 2+ 12Mg RAIO ATÔMICO Energia ou Potencial de Ionização •É a energia necessária para remover um ou mais elétrons de um átomo isolado no estado gasoso. •A remoção do primeiro elétron, que é o mais afastado do núcleo, requer uma quantidade de energia denominada primeira energia de ionização (1ª E.I.) e assim sucessivamente. •De maneira geral podemos relacionar a energia de ionização com o tamanho do átomo, pois quanto maior for o raio atômico, mais fácil será remover o elétron mais afastado (ou externo), visto que a força de atração núcleo-elétron será menor. Generalizando: QUANTO MAIOR O TAMANHO DO ÁTOMO, MENOR SERÁ A PRIMEIRA ENERGIA DE IONIZAÇÃO. Afinidade eletrônica ou eletroafinidade •É a energia liberada quando um átomo isolado, no estado gasoso, "captura" um elétron. •Quanto menor o tamanho do átomo, maior será sua afinidade eletrônica. •Essa propriedade não é definida para os gases nobres. Eletronegatividade •É a forca de atração exercida sobre os elétrons de uma ligação. •A eletronegatividade dos elementos não é uma grandeza absoluta, mas, sim, relativa. Ao estudá-la, na verdade estamos comparando a força de atração exercida pelos átomos sobre os elétrons de uma ligação. Essa força de atração tem uma relação com o RAIO ATÔMICO. •Quanto menor o tamanho de um átomo, maior será a força de atração, pois a distância núcleo-elétron da ligação é menor. Também não é definida para os gases nobres. Eletronegatividade Eletropositividade ou caráter metálico Eletropositividade é a capacidade de um átomo perder elétrons, originando cátions. Os metais apresentam elevadas eletropositividades, pois uma de suas características é a grande capacidade de perder elétrons. Entre o tamanho do átomo e sua eletropositividade, há uma relação genérica, uma vez que quanto maior o tamanho do átomo, menor a atração núcleo-elétron e, portanto, maior a sua facilidade em perder elétrons. Também não está definida para os gases nobres. Eletropositividade Reatividade •A reatividade de um elemento químico está associada à sua maior ou menor facilidade em ganhar ou perder elétrons. •Assim, os elementos mais reativos serão tantos os metais que perdem elétrons com maior facilidade, quanto os ametais que ganham elétrons com maior facilidade. Reatividade Pela figura podemos observar que: a) entre os metais, o mais reativo é o frâncio (Fr) b) entre os ametais, o mais reativo é o flúor (F). Densidade Num período: A densidade cresce das extremidades para o centro Numa família: A densidade cresce de cima para baixo. Assim, os elementos de maior densidade estão situados na parte central e inferior da tabela. Densidade Esquematicamente, podemos representar por: Ponto de fusão (PF) e Ponto de ebulição (PE) •PONTO DE FUSÃO - É temperatura na qual uma substância passa do estado sólido para o estado líquido. •PONTO DE EBULIÇÃO - É temperatura na qual uma substância passa do estado líquido para o estado gasoso. •Na família IA (alcalinos) e na família IIA (alcalinos terrosos), IIB, 3A, 4A, os elementos de maior ponto de fusão (PF) e ponto de ebulição (PE) estão situados na parte superior da tabela. De modo inverso, nas demais famílias, os elementos com maiores PF e PE estão situados na parte inferior. Ponto de fusão (PF) e Ponto de ebulição (PE) Nos períodos, de maneira geral, os PF e PE crescem da extremidades para o centro da tabela. Esquematicamente podemos representar por: Volume atômica Varia com o aumento do número atômico;
Download