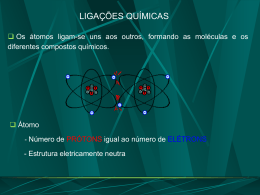
ÁTOMOS, MOLÉCULAS E ÍONS 1 – A TEORIA ATÔMICA DA MATÉRIA Aristóteles – Afirmava que a matéria era infinitamente divisível (continuidade da matéria) Demócrito (460-370 a.C.) – Ao contrário de Aristóteles, sugeriu que a matéria era descontínua, ou seja, era composta por minúsculas partículas que não se dividiam, denominadas ´átomos´ (do grego, indivisível). Embora a proposta de Demócrito fosse conhecida, prevaleceu até o início do século XIX a idéia da continuidade da matéria. Dalton (1766-1844) – Com base em observações experimentais, o cientista inglês publicou sua teoria atômica. Suas concepções eram tão fundamentais que permaneceram intactas, em sua essência, até os dias atuais. Alguns postulados de sua teoria atômica: a) Cada elemento é composto por pequenas partículas denominadas átomos. b) Átomos de mesmo elemento são idênticos entre si, átomos de elementos diferentes são diferentes entre si (massas diferentes). c) Átomos, em uma reação química, não se transformam em outros tipos de átomos e nem há criação ou destruição deles. d) Os compostos se formam quando átomos de dois ou mais elementos se combinam. Lei da composição constante: baseada no postulado (d) de Dalton, afirma que, num dado composto, são constantes as espécies e os números relativos de átomos. Lei da conservação da matéria: baseada no postulado (c) de Dalton, afirma que a massa dos produtos de uma reação química é igual à massa dos reagentes iniciais. Lei das proporções múltiplas: quando dois elementos A e B se combinam, isso ocorre com uma relação constante de massas, com números inteiros e pequenos. 2 – A DESCOBERTA DA ESTRUTURA ATÔMICA 2.1 – RAIOS CATÓDICOS E ELÉTRONS Envolve descarga elétrica em gases rarefeitos, com aplicação de elevada voltagem, o que provoca radiação nos tubos, chamados de tubos de raios catódicos. Na ausência de campo magnético ou elétrico, os raios catódicos avançam em linha reta. Na presença de campo elétrico, os raios sofrem um desvio, como se fossem constituídos por partículas com carga elétrica negativa, denominadas elétrons. Na presença de campo magnético, os raios sofrem um desvio, como se fossem constituídos por partículas com carga elétrica negativa, denominadas elétrons. São sempre os mesmos, levando à conclusão de que o elétron era um componente fundamental da matéria. 2.2 – RADIOATIVIDADE Henri Bequerel – Estudou um minério de urânio, a pechblenda, e descobriu que havia emissão de radiação de alta energia. O fenômeno dessa radiação espontânea foi chamado de radioatividade. Marie e Pierre Currie – Conseguiram isolar os componentes radioativos – urânio – da pechblenda. Raios α – Possuem 5% da velocidade da luz, têm carga positiva +2 e são considerados núcleos de átomos de hélio. Raios β – Possuem 95% da velocidade da luz, têm carga negativa -1 e são equivalentes radioativos dos raios catódicos. Raios γ – Possuem 100% da velocidade da luz, não têm carga elétrica e é uma radiação de alta energia, como os raios-X. 2.3 – O ÁTOMO NUCLEADO Thomson – Sugeriu que o átomo era uma esfera maciça, de carga +, com elétrons nela incrustados, de carga -, assim como um ´´pudim de passas´´. Rutherford – Bombardeou partículas uma folha de ouro com partículas α. Observou que de cada 10000 partículas bombardeadas, aproximadamente uma era refletida na direção original. Com isso, concluiu-se que a massa do átomo estava concentrada numa região muito pequena, de carga +, denominada núcleo. A outra parte do átomo seria um grande ´´vazio´´ , denominada eletrosfera, e por onde os elétrons orbitavam. 3 – CONCEPÇÃO MODERNA DA ESTRUTURA ATÔMICA O átomo é constituído basicamente por três partículas fundamentais: prótons, elétrons e nêutrons, divididos em núcleo e eletrosfera. Núcleo – Formado por prótons + nêutrons. É a menor parte do átomo, mas é onde está concentrada quase toda a totalidade de sua massa. Eletrosfera – Constituída por elétrons que orbitam. É a maior parte em volume do átomo, mas sua massa é quase insignificante. MEDIDAS DOS ÁTOMOS Massa – É muito pequena. O átomo mais pesado tem massa da ordem de 4 x 10-22 g. Para facilitar a medida da massa do átomo, adota-se a u.m.a. (unidade de massa atômica), que equivale a aproximadamente 1,66 x 10-24 g. Tamanho – Muito pequeno com diâmetro entre 1 x 10-10 m e 5 x 10-10 m. Adota-se para medir seu tamanho o nm (nanometro), que equivale a 1 x 10-9 m. Tabela Periódica À medida que as observações químicas se acumulava e que a lista dos elementos conhecidos se expandia, fizeram-se muitas tentativas de descobrir regularidades no comportamento químico. E essas tentativas culminaram, em 1869, com a criação da Classificação Periódica dos Elementos. Grupo Semelhanças e Disposição A disposição dos elementos na ordem dos números atômicos crescentes é feita de modo que os elementos com propriedades semelhantes fiquem em colunas verticais. Metais Não-Metais Molécula e Compostos Moleculares • Uma molécula é um grupo de dois ou mais átomos ligados. • Estes átomos comportam-se como se fossem um corpo único, bem caracterizado, sendo mantidos unidos através das ligações químicas. Moléculas e Fórmulas Químicas Muitos elementos são encontrados na natureza sob a forma molecular (na forma de dois ou mais átomos ligados entre si) Os elementos que ocorrem normalmente como moléculas diatômicas são o hidrogênio, oxigênio, nitrogênio e os halogênios. Os compostos constituídos por moléculas são os compostos moleculares e contêm mais de um tipo de átomo. A maioria das substâncias moleculares que encontramos é constituída exclusivamente por não-metais. Fórmulas Molecular e Empírica As fórmulas químicas que indicam os números e tipos de átomos reais numa molécula são as fórmulas moleculares. As fórmulas que dão somente os números relativos de átomos de cada tipo numa molécula são as fórmulas empíricas. Os índices numa fórmula empíricas são sempre os menores números inteiros que representam a razão entre os átomos. As fórmulas moleculares fornecem mais informações sobre as moléculas do que as fórmulas empíricas. Sempre que a fórmula molecular de um composto for conhecida, é possível determinar a respectiva fórmula empírica. O inverso não é verdade, se fornecermos a fórmula empírica de uma substância não podemos determinar, sem outras informações, a sua fórmula molecular. Representação das Moléculas • A fórmula molecular de uma substância resume a sua composição, mas não mostra como é a molécula. Um outro tipo de fórmula mostra como os átomos se unem. • As fórmulas estruturais de uma substância mostram como se unem os átomos no interior da molécula. • Usualmente, uma fórmula estrutural não mostra a geometria real da molécula (os ângulos reais das ligações entre átomos). Pode-se, porém, desenhar uma fórmula estrutural em perspectiva a fim de se propiciar uma visão tridimensional da molécula. Os químicos utilizam vários modelos para visualizar as moléculas, e dentre eles estão: Modelos de bolas e varetas: representam átomos como esferas e as ligações como varetas. Modelos moleculares maciços: mostram a aparência que teriam as moléculas numa grande ampliação de escala. Esses modelos mostram os tamanhos relativos dos átomos, mas os ângulos entre as ligações são difíceis de perceber. Íons e Compostos Iônicos • O núcleo de um átomo fica inalterado num processo químico comum, mas os átomos podem ganhar ou perder elétrons com facilidade. • Se houver remoção ou adição de elétrons, um átomo neutro se transforma numa partícula carregada e há formação de um íon. Um íon com carga positiva é um cátion, enquanto um outro com carga negativa é um ânion. • Além dos íons simples como Na+ e Cl- existem íons poliatômicos, como NO3- (íon nitrato) e SO42- (íon sulfato). Esses íons são constituídos por átomos unidos como uma molécula, mas têm carga líquida positiva ou negativa. • As propriedades dos íons são muito diferentes das dos átomos de onde provêm. Previsão das Cargas Iônicas • Muitos átomos ganham ou perdem elétrons de modo a ficarem com o mesmo número de elétrons que o gás nobre que estiver mais próximo na Classificação Periódica. • Os membros da família dos gases nobres são quimicamente pouco reativos e formam poucos compostos, devido às suas configurações eletrônicas serem muito estáveis. Compostos Iônicos • Boa parte da atividade química é fruto da transferência de elétrons entre as substâncias. Os íons se formam quando um ou mais elétrons se transferem de um átomo neutro para outro. • Um composto iônico é um composto que tem íons como carga negativa e íons com carga positiva. • Em geral, os cátions são íons de metais e os ânions são íons de não-metais. Por isso, os compostos iônicos são, em geral, combinações de metais e não-metais, como no NaCl. • Em contraste com isso, os compostos moleculares são, em geral, constituídos exclusivamente por não-metais, com na H2O. • Os compostos químicos são sempre eletricamente neutros. Assim, os íons num composto iônico combinam-se numa razão tal que a carga positiva total é exatamente igual à carga negativa total.
Baixar