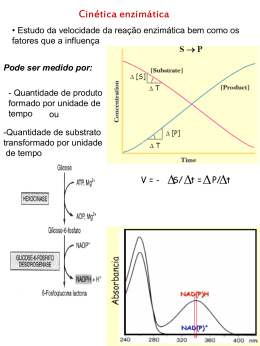
Cinética Enzimática
Prof. Dr. Henning Ulrich
Influência do Substrato
Concentração de substrato [S]: afeta a
velocidade da reação;
Efeito de [S]: varia durante o curso de uma
reação S P;
Velocidade inicial (V0): [S] >> [E] tempo
muito curto [S] = constante.
Influência do Substrato
[E] = cte
[S] = V0 linear
[S] = V0
V0 = Vmáx
Influência do Substrato
Alguns casos a V0 não pode ser medida
• Não existe técnica experimental;
• Equação química não representa
transformação;
a
Velocidade da reação:
• Velocidade
média de consumo ou
produção;
• Variação de uma propriedade no sistema.
Influência do Substrato
Vitor Henri (1903): E liga-se ao S para
formar ES passo obrigatório;
Leonor Michaelis e Maud Menten (1913)
• E combina-se reversivelmente com S ES
E+S
• ES se rompe E e P
ES
k2
k1
k-1
ES
E+P
Influência do Substrato
Qualquer instante da reação: E e ES;
[S] = velocidade da reação [S];
Vmáx = todas as moléculas de E estiverem
na forma ES enzima “saturada”;
[S]: estado pré-estacionário ES;
• Estado estacionário [ES] = cte;
• V0 estado estacionário.
Equação Michaelis-Menten
Curva:
possui
a
mesma forma para a
maioria das enzimas;
Expressa
pela
Equação
de
Michaelis e Menten;
Hipótese: limitante quebra de ES E + P.
Equação Michaelis-Menten
Equação da velocidade para uma reação
catalisada enzimaticamente e com um único
substrato;
Relação quantitativa entre a V0, a Vmáx e a
[S] inicial relacionadas através de Km.
Vmáx S
V0
K m S
Equação Michaelis-Menten
Relação numérica:
V0 é metade de
Vmáx;
1
V0 Vmáx
2
km = “afinidade”
pelo substrato;
Km afinidade
Vmáx é proporcional à [E].
Significado de Km e Vmáx
Equação
Michaelis
e
dependência hiperbólica;
Menten
=
Mecanismos de reação diferentes
catalisam reações com 6 ou 8 passos;
Significado e magnitude de Vmáx e Km varia;
Km: depende de aspectos específicos do
mecanismo de reação.
Significado de Km e Vmáx
k 2 k 1
Km
k1
K2 << K-1 afinidade da enzima;
K2 >> K-1;
K2 e K-1 são comparáveis a Km função
complexa;
Vmáx: número de passos da reação e
identidade dos passos limitantes.
Significado de Km e Vmáx
E+S
K1
K-1
ES
K2
K-2
EP
K3
E+P
Enzima na saturação: EP e Vmáx = k3.[Et];
Kcat = velocidade limitante de qualquer
reação enzimas saturadas;
Kcat e Km = ambiente celular, concentração
do substrato e química da reação.
Complexo enzima-substrato: ES
v (formação) = k1 [S] [E] { v (“degradação”) = k-1[ES] + k2 [ES] = (k-1 + k2) [ES]
Estado estacionário (“steady state”): [ES] = constante
v de formação = v de “degradação” ou: k1 [S] [E] = (k-1 + k2) [ES]
[S] [E] / [ES] = (k-1 + k2) / k1
{ (k-1 + k2) / k1 = Km
Constante de Michaelis
[ES] = [S] [E] / Km { [E] = [ET] – [ES] { [ES] = ([ET] – [ES]) [S] / Km
[ES] = [ET] [S] / Km – [ES] [S] / Km {[ES] + [ES] [S] / Km = [ET] [S] / Km
([ES] Km + [ES] [S]) / Km = [ET] [S] / Km
{
[ES] = [ET] [S] / Km + [S]
[ES] (Km + [S]) / Km = [ET] [S] /
Km
[ES]
=
[ES] = v / k2
[ET] ( [S] / Km + [S] )
[ET] = Vmax / k2
v / k2 = Vmax / k2 ( [S] / Km + [S] )
Variável dependente:
velocidade de reação,
função de [S].
Constante*:
velocidade
máxima
Variável independente:
concentração do substrato.
Constante de Michaelis:
KD aparente de ES.
* “Constante”: Vmax é função de [E]total
Parâmetros Cinéticos
Exemplo:
Vo (g/L.h)
0,78
1,25
1,66
2,19
2,35
2,57
3,0
Vo (g/L.h)
[S] (g/L)
0,25
0,51
1,03
2,52
4,33
7,25
2,0
1,0
0,0
0
2
4
[S] (g/L)
6
8
Parâmetros Cinéticos
Exemplo: Lineweaver-Burk
1
K
1
1
m
V0 Vmáx S Vmáx
1/Vo (L.h/g)
1,6
1,2
1
1
0,228
0,3668
S
V0
0,8
P ort ant o,
1
g
0,3668 Vmáx 2,73
Vmáx
Lh
y = 0,228x + 0,3668
0,4
R2 = 0,9991
0,0
0
1
2
3
1/[S] (L/g)
4
5
Km
g
0,228 K m 0,622
Vmáx
L
Inibidores Competitivos
Forma
estrutural
competição;
=
substrato
Porcentual de inibição concentrações
e afinidade pela enzima.
Inibidores Competitivos
[S] Vmáx =
Km
Experimento
• 1º [E], [S] = cte
• 2º [E], [I] = cte
1/V0 x 1/[S]
Inibidores Competitivos
Equação de
Michaelis e Menten
V Vmáx
Km
S
1 I
S
K I
Lineweaver-Burk
K m 1 I
KI 1
1
1
S
V Vmáx
Vmáx
Inibidores Competitivos
Relação entre as velocidades com e
sem inibidor
V0
Km
1
I
VI
K I K m S
[S] = influência
do [I] desprezível.
Inibidores Não-Competitivos
Ocupa outro sítio
ES, EI e EIS;
[S] = não leva
todas as E
produtiva;
Vmáx e Km normal.
Inibidores Não-Competitivos
Equação da
velocidade:
V Vmáx
S
I S 1 I
K m 1
K
I
KI
Lineweaver-Burk
1 Km
V Vmáx
I 1 1
1
K I S Vmáx
I
1
KI
Inibidores Incompetitivos
Bloqueio de ES;
2 sítios ativos I
se fixa no complexo
ES;
ESI = não forma P;
Vmáx e Km
Inibidores Incompetitivos
Equação da velocidade:
Vmáx
S
1 I
KI
V
Km
S
I
1
KI
1 Km 1
1
Lineweaver-Burke:
V Vmáx S Vmáx
I
1
KI
Inibidores Incompetitivos
Inibidores Irreversíveis
Combinam-se com um grupo funcional
destruição;
União covalente inibidor e enzima.
Vmáx e Km =
Inibidores Irreversíveis
Equação de
Michaelis e Menten:
VI Vmáx k 3 [ EI ]
S
K m S
Inibidores Irreversíveis
Lineweaver-Burk:
Km
1
1
1
VI Vmáx K 3 EI Vmáx K 3 EI S
Influência do pH
Valor de pH ótimo = atividade máxima;
Velocidade da reação: pH afasta do
ótimo;
Influência do pH: análise dos grupos
dissociáveis;
Ácidos (Brönsted): compostos capazes de
dissociar-se, liberando H+.
Influência do pH
HA A + H+
pH HA A
Aminoácidos:
CH 2 COOH CH 2 COO
CH 2 CH 2 CH 2 CH 2 NH 3
H
a
CH 2 CH 2 CH 2 CH 2 NH 2
H
pH -COO- captam prótons = -COOH;
pH -NH3+ são dissociados = NH2;
Ligação eletrostática = -COO- -- NH3+.
b
Influência do pH
pH ótimo depende do número e tipo de grupos
ionizáveis estrutura primária;
Variações do pH afeta substrato com grupos
ionizáveis;
Estabilidade da enzima: temperatura, força
iônica, concentração de substratos ou cofatores
da enzima e concentração da enzima, entre
outros.
Influência do pH
pH 5 e 8 = não afeta a
atividade;
Declínio entre pH 6,8-8
e 6,8-5 = forma iônica não
adequada;
5 > pH > 8 = inativação
irreversível.
Influência da Temperatura
T velocidade de reação = energia
cinética;
T muito elevadas = desnaturação da
enzima
• Rompidas as pontes de hidrogênio
alterações estruturas = nova conformação;
• T desnaturação pouco acima da T
ótima.
Influência da Temperatura
Enzimas PM 1 cadeia polipeptídica e
pontes dissulfeto = estáveis ao calor;
Efeito da T = pH, força iônica e a presença
ou ausência de ligantes;
Substratos
protegem
desnaturação.
a
enzima
da
Influência da Temperatura
K é função da T Lei de Arrhenius
k k0 e
RT
Influência da Temperatura
Enzimas são termolábeis
enzimática = inativação términa
k k e
'
'
0
reação
RT
Efeito da T na velocidade das reações
coeficiente de temperatura
• Velocidade quando a T 10ºC.
2,3 R T2 T1 log Q10
Ea
10
Regulação da Atividade
Sistema enzimático: produto da reação da 1ª
enzima substrato da enzima subseqüente;
Enzimas reguladoras determina
velocidade da seqüência;
• Atividade catalítica ou sinais;
Moléculas sinalizadoras
metabólitos ou cofatores.
a
pequenos
Enzimas Alostéricas
Ligação não-covalente
modulador;
e
reversível
Inibição por retroalimentação
• Enzima reguladora inibida pelo P final da
via reequilibra as necessidades celulares;
Moduladores: inibidores ou estimuladores.
Enzimas Alostéricas
Modulador = substrato homotrópicas;
Modulador substrato heterotrópicas;
Sítio alostérico
modulador;
específico
Curva
de
saturação
subunidades múltiplas.
para
sigmóide
o
Enzimas Alostéricas
curvas de variação de atividade
moduladores inibidores, ativadores ou os
dois tipos.
Modificação Covalente
Ligação covalente de um grupo químico à
sua estrutura;
Metabolismo alterado
inativas e inibem vias ativas.
aciona
vias
Baixar