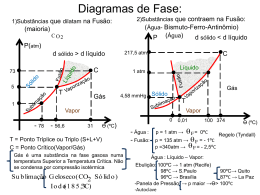
Transformações gasosas Denominamos de pressão de um gás a colisão de suas moléculas com as paredes do recipiente em que ele se encontra A pressão de um gás pode ser medida em: atmosfera (atm) centímetros de mercúrio (cmHg) milímetros de mercúrio (mmHg) 1 atm = 76 cmHg = 760 mmHg É o espaço ocupado pelo gás 1 L = 1000 mL = 1000 cm 3 Nos trabalhos científicos a unidade usada é a escala absoluta ou Kelvin (K) TK = TC + 273 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V = 5L T = 300 K P = 1 atm Os valores da pressão, do volume e da temperatura não são constantes, então, dizemos que PRESSÃO (P), VOLUME (V) e TEMPERATURA (T) São VARIÁVEIS DE ESTADO DE UM GÁS Mantemos constante a TEMPERATURA e modificamos a pressão e o volume de uma massa fixa de um gás. ESTADO 1 P1 = 1 atm ESTADO 2 P2 = 2 atm V1 = 6 L V2 = 3 L T1 = 300 K T2 = 300 K P1 = 1 atm V1 = 6 L T1 = 300 K P2 = 2 atm V2 = 3 L T2 = 300 K P1.V1 = 6 7 p2.V2 = 6 P3 = 6 atm V3 = 1 L T3 = 300 K p3.V3 = 6 P (atm) Pressão e Volume São inversamente proporcionais 6 5 4 3 PxV= constante 2 1 1 2 3 4 5 6 7 8 V (litros) Na matemática, quando duas grandezas são inversamente proporcionais, o produto entre elas é constante P1 X V1 = P2 X V2 Quando a pressão não sofre mudanças, modifica-se o volume e a temperatura ESTADO 2 P1 = 1 atm P2 = 1 atm V1 = 6 L V2 = 3 L T1 = 300 K T2 = 150 K ESTADO 1 P1 = 2 atm V1 = 1 L T1 = 100 K V1/t1= 1/100 7 P2 = 2 atm V2 = 2L T2 = 200 K P2/T2 = 2/200 V (L) 6 5 P3 = 2 atm V3 = 3 L T3 = 300 K P3/T3 =3/300 Volume e Temperatura Absoluta São diretamente proporcionais V = constante T 4 3 2 LEI DE CHARLES E GAYLUSSAC 1 100 200 300 400 500 600 700 800 T (Kelvin) Na matemática, quando duas grandezas são diretamente proporcionais, o quociente entre elas é constante V1 T1 = V2 T2 Quando o volume não muda, mas a pressão e a temperatura sim P1 = 4 atm V1 = 6 L T1 = 300 K P2 = 2 atm V2 = 6 L T2 = 150 K ESTADO 1 ESTADO 2 P1 = 1 atm V1 = 2 L T1 = 100 K P1/T1 = 1/100 7 P2 = 2 atm V2 = 2 L T2 = 200 K p2/T2 = 2/200 P (atm) 6 5 P3 = 3 atm V3 = 2 L T3 = 300 K p3/t3 = 3/300 Pressão e Temperatura Absoluta São diretamente proporcionais P = constante T 4 3 2 1 100 200 300 400 500 600 700 800 T (Kelvin) Na matemática, quando duas grandezas são diretamente proporcionais, o quociente entre elas é constante P1 T1 = P2 T2 Existem transformações em que todas as grandezas (T, P e V) sofrem mudanças nos seus valores simultaneamente Combinando-se as três equações vistas encontraremos uma expressão que relaciona as variáveis de estado neste tipo de transformação P 1 x V1 T1 = P 2 xV 2 T2 Uma determinada quantidade de oxigênio está contida num balão de 5L, exercendo pressão de 0,8 amt. Se todo este gás for transferido para um balão de 1,6 L, qual será sua pressão, medida isotermicamente? Inicial Final Pi = 0,8 atm Pi = ? Vi = 5 L Vi = 1,6 L Ti = ? Ti = ? p i.Vi p f .Vf Ti Tf 0,8.5 pf .0,6 pf 6,7 atm Um gás em um recipiente fechado, munido de um embolo móvel, de volume 5 cm3, 27ºC e 1 atm, sofre uma transformação onde a temperatura permanece constante. Fazendo o volume ser 1/4 do inicial qual será a) temperatura do sistema? b) a pressão final do sistema? Inicial Final Pi = 1,0 atm Pi = ? Vi = 5 cm3 Vi = 1,25 cm3 Ti = 27°C Ti = ? p i.Vi p f .Vf Ti Tf 1,0.5 pf .1,25 pf 4atm Uma amostra de nitrogênio gasoso ocupa um volume de 20 ml a 27ºC e à pressão de 800 mm Hg. Que volume ocuparia a amostra a -173 ºC e 800 mm Hg ? Inicial Pi = 800 mmHg Vi = 20 ml Ti = 27°C =300 K p i.Vi Ti Final Pf = 800mmHg Vf = ? Tf = -173°C =100 K p f .Vf Tf 20 Vf 300 100 Vf 3,3L Dentro de um recipiente de volume variável estão inicialmente 20 litros de gás perfeito à temperatura de 200 K e pressão de 2 atm. Qual será a nova pressão, se a temperatura aumentar para 250 K e o volume for reduzido para 10 litros? Inicial Pi = 2 atm Vi = 20 L Ti = 200K Final Pf = ? Vf = 10 L Tf = 250 K p i.Vi p f .Vf Ti Tf 2.20 pf .10 200 250 Vf 5L Um recipiente contém certa massa de gás ideal, à temperatura de 27 ºC, ocupa um volume de 15 litros. Ao sofrer uma transformação isobárica, o volume ocupado pela massa gasosa passa a ser de 20 litros. Nessas condições, qual foi a variação de temperatura sofrida pelo gás? Inicial Final Pi = ? Pf = ? Vi = 15 L Vf = 20L Ti = 27°C Tf = ? T Tf Ti =300 K p i.Vi p f .Vf Ti Tf T 400 300 15 20 T 100 K 300 Tf Tf 400K Ou Equação de Clapeyron GAS LÍQUIDO SÓLIDO Lei de Avogadro “Volumes iguais de gases quaisquer, à mesma temperatura e pressão, encerram o mesmo número de moléculas.“ Sendo n a quantidade em mols de cada gás, podemos concluir: Observações • Um mol de gás • p . V = 0,082 • T • Três mols de gás • p . V = 3 x 0,082 • T • Dois mols de um gás • p . V = 0,082 x 2 • T • n mols de um gás • p . V = n x 0,082 • T Chegando à equação de Clapeyron • • • • • • p . V =n. 0,082 T n = número de mols R = 0,082 p . V =n. R T p.V=n.R.T Porém: Um recipiente rígido contém 0,5 mol de gás perfeito à temperatura de 27 0C e pressão de 1,2 atm. Calcule o volume desse recipiente. n = 0,5 mol T = 27°C = 300 K p = 1,2 atm V=? p.V=n.R.T 1,2 . V = 0,5.0,082.300 1,2 V = 12,5 V = 12,5 1,2 V 10 L • • • • • • • • • Unidades p.V=n.R.T p.V=R n.T R=p.V n.T R = [atm].[L] [mol].[K] R = 0,082 atm.L/mol.K E: Um recipiente rígido contém 0,5 mol de gás perfeito à temperatura de 27 0C e pressão de 1,2.105 Pa. Calcule o volume desse recipiente. n = 0,5 mol • Unidades • p.V=n.R.T T = 27°C = 300 K • p.V=R p = 105 Pa • n.T V=? • R=p.V p.V=n.R.T • n.T 5 1,2.10 . V = 0,5.8,31.300 • R = [Pa].[m3] 1,2.105 V = 1246,5 • [mol].[K] V 0,01 m3 • R =8,31 J/mol.K Duas situações 01) 15 litros de determinada massa gasosa encontram-se a uma pressão de 8 atmosferas e à temperatura de 30 0C. Ao sofrer uma expansão isotérmica, seu volume passa a 20 litros. Qual será a nova pressão? P1 x V1 P2 xV2 = T2 T1 02) Um recipiente rígido contém 0,5 mol de gás perfeito à temperatura de 27 0C e pressão de 1,2 atm. Calcule o volume desse recipiente. P x V = n x R xT Em um experimento de aquecimento de gases, observa-se que um determinado recipiente totalmente fechado resiste a uma pressão interna máxima de 2,4.104 N/ m2. No seu interior, há um gás perfeito com temperatura de 230 K e pressão de 1,5.104N/ m2. Desprezando a dilatação térmica do recipiente, podemos afirmar que a máxima temperatura que o gás pode atingir, sem romper o recipiente, é de a)243 K b) 288 K c) 296 K d) 340 K e) 368 K pi.Vi pf .Vf 2 valores de p, V e T Início p = 1,5.104 N/m2 V=? T = 230 K Ti Final p = 1,5.104 N/m2 = 1,5.104 V=? 230 T=? Tf 4 2,4.10 Tf Tf 368K
Download