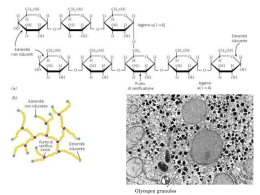
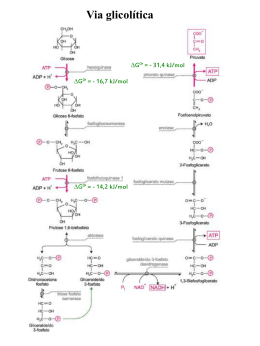
REVISAO BLOCO II Regulação da atividade enzimática • Enz. alostéricas analogia com protéina alostérica (ex: Hb) • Moduladores alostéricos (≠ de inibidores não-competitivos ou mistos!!) • Mudanças conformacionais entre forma ativa e inativa e parámetros cinéticos diferentes (≠ do Michaelis-Menten) • Dois tipos: enzimas homotrópicas (reguladas pelo substrato) e heterotrópicas Enzimas alostéricas... O que é isso? Sistema multienzimático sequencial Enzimas alostéricas... O que é isso? Ex: Aspartato Transcarbamilase (AtCase) -síntese de pirimidinas Aspartato + carbamil-fosfato AtCase N-carbamil aspartato Citidina trifosfato Uridina trifosfato Michaellis-Menten Enzimas Alostéricas Enzima Homotrópica Efeito moduladores Efeito moduladores Exemplos de enzimas regulatórias Fosfofrutokinase –1 (PFK-1): ALOSTERIA Glicogênio Fosforilase ALOSTERIA MODIFICAÇÃO COVALENTE Modificação covalente reversível Ativação Proteolítica Fatores que afetam a velocidade enzimática pH Temperatura Concentração de substratos Concentração de cofatores Presença de Inibidores e/ou ativadores Modificações químicas: fosforilações, adenilações, etc Concentração de enzima Fontes de energia Como esses alimentos viram energia? Fontes de energia O Que é um carboidrato? Carbono Hidrato • Poli-hidroxi-cetonas ou Poli-hidroxi-aldeídos • Poli-hidroxi-cetonas ou Poli-hidroxi-aldeídos Centros assimétricos: CLASSIFICAÇÃO: de acordo com a hidrólise • Monossacarídeos • Oligossacarídeos • Polissacarídeos Estruturas cíclicas • Em solução, carbonos com 4 ou mais carbonos formam estruturas cíclicas Oligossacarídeos • Formados pela ligação de dois ou mais monossacarídeos. • Os mais comuns são os dissacarídeos. • São a principal forma de transporte dos carboidratos. Açúcar de mesa (cana de açúcar) Leite Grãos em germinação Polissacarídeos • • • • Reserva energética Formados pela ligação de mais de 20 monossacarídeos. Podem formar cadeias lineares ou ramificadas. Homopolissacarídeos: amido, glicogênio, celulose, quitina Heteropolissacarídeos: peptidoglicanas (parede de bactérias) Fontes de energia Como a glicose gera energia? Energia de ativação (ΔG‡) ΔG`° (Comoexergonica) a célula armazena essa energia? O H H Como a energia é armazenada na célula? Resp.: Nas ligações fosfato da molécula de ATP. Como a célula usa a energia armazenada no ATP? Destinos da glicose Bloco III Quebra da glicose: Fases: 1. Anaeróbica (glicólise): não necessita de oxigênio para ocorrer e é realizada no citoplasma. 2. Aeróbica (ciclo de Krebs e cadeira transportadora de elétrons): requer e presença de oxigênio e ocorre dentro das mitocôndrias C6H12O6 + 6O2 6CO2 + 6H2O + 38 ATP Glicólise – origem do nome Glycolysis tem a sua origem no Grego em que glyk = Doce + Lysis = Dissolução Na atualidade podemos definir a Glicólise como a seqüência de reações que converte a Glicose em Piruvato, havendo a produção de Energia sob a forma de ATP Glicólise • Início do processo de oxidação de carboidratos • Ocorre em todos os tecidos (exceto fígado em jejum) • Principal substrato = GLICOSE • Substratos secundários = Frutose e Galactose • Possui 2 Fases: • Investimento de Energia (-2 ATPs) • Pagamento de Energia (+ 4ATPs + 2NADH) Glicólise – visão geral 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas Saldo 2 moléculas de ATP 2 moléculas de Piruvato (3C) 2 moléculas de NADH Etapas da glicólise A Glicólise divide-se em duas etapas principais: 1- Ativação ou Fosforilação da Glicose 2- Transformação do Gliceraldeído em Piruvato 1º passo: fosforilação da glicose • Glicose + ATP Glicose -6-Fosfato + ADP ΔG`° = -16,7 kJ/mol • Enzima: HEXOQUINASE • Importância da fosforilação: – Mantêm o açúcar dentro da célula – Conserva energia – Diminui a energia de ativação e aumenta a especificidade das reações enzimáticas subseqüentes 2º: glicose 6-P para frutose 6-P Glicose 6- Fosfato Frutose -6-Fosfato ΔG`° = +1,7 kJ/mol • Enzima: FOSFOHEXOSE ISOMERASE 3º: fosforilação da frutose 6P Frutose -6-Fosfato + ATP Frutose 1,6-Bifosfato + ADP ΔG`° = -14,2 kJ/mol • Enzima: FOSFOFRUTOQUINASE-1 4º: quebra da frutose 1,6P Frutose 1,6-Bifosfato Gliceraldeído 3-P + Dihidrocetona Fosfato ΔG`° = +23,8 kJ/mol • Enzima: ALDOLASE 5º: interconversão das trioses-P Gliceraldeído 3-P Dihidrocetona Fosfato • Enzima: TRIOSE FOSFATO ISOMERASE 6º: oxidação do gliceraldeido 3-P Gliceraldeído 3-P + ATP 1,3 Bifosfoglicerato ΔG`° = +6,3 kJ/mol • Enzima: GLICERALDEIDO 3-FOFATO DESIDROGENASE • Início da fase de pagamento 7º: transferência do P para ATP 1-3 Bisfosfoglicerato + ADP 3-Fosfoglicerato + ATP ΔG`° = -18,5 kJ/mol • Enzima: FOSFOGLICERATO QUINASE 8º: conversão do 3-P glicerato a 2-P gli • 3-Fosfoglicerato 2-Fosfoglicerato • Enzima: FOSFOGLICERATO MUTASE 9º: desidratação do 2-P glicerato 2-Fosfoglicerato Fosfoenolpiruvato + H2O ΔG`° = 7,5 kJ/mol • Enzima: ENOLASE 10º: transferência do P para ATP Fosfoenolpiruvato + ADP • Enzima: PIRUVATO QUINASE • Última reação da glicólise Piruvato + ATP Balanço geral da glicólise Como os açúcares que ingerimos na alimentação entram na via glicolítica? Destinos do piruvato: GLICOSE PIRUVATO Glicólise - Importância da regulação < 2,5 mmol/L → coma hipoglicêmico > 7 mmol/L → diabetes e riscos de doenças renais, vasculares e oculares. Insulina X Glucagon Estoca glicose na forma de glicogênio e secreta quando necessário. Formas de regulação da atividade enzimática: Ativação/desativação por Fosforilação/defosforilação HEXOQUINASE (I e II – músculo) Glicose Glicose 6-P • Inibida pelo produto da reação: glicose 6-fosfato desta maneira a taxa de formação de glicose 6-P está em balanço com a taxa de seu consumo. Enzimas que fosforilam a glicose: • Hexoquinase I • Hexoquinase II • Hexoquinase I e II • Hexoquinase III • Hexoquinase IV ou Glicoquinase Cérebro e Rins Músculo esquelético Fígado Diversos Tecidos Fígado e células -pâncreas HEXOQUINASE x GLICOQUINASE • Glicoquinase (Hexoquinase IV) não é inibida por glicose 6-fosfato e tem maior Km pela glicose. • É importante no fígado para garantir que glicose não seja desperdiçada quando estiver abundante, sendo encaminhada para síntese de glicogênio e ácidos graxos. • Além disso, quando a glicose está escassa, garante que tecidos como cérebro e músculo tenham prioridade no uso Músculo – consome glicose para a produção de energia Fígado – mantém o equilíbrio de glicose no sangue. GLICOQUINASE - fígado Hexoquinase IV é regulada pelo nível de glicose no sangue: regulação por seqüestro no núcleo celular Após refeição Durante jejum Vinda da gliconeogênese Fígado não compete com demais órgãos pela glicose escassa. PFK-1 • Fru 6-P Fru 1,6-bP a partir desse ponto o açúcar está comprometido com a via glicolítica • Reação altamente exergônica e irreversível. G0°= -13,8 kJ/mol • Além do sítio ativo essa enzima possui diversos sítios onde inibidores e ativadores alostéricos se ligam. PFK-1 regulação alostérica PFK-2 PFK-1 / PFK-2 insulina Glicose PFK-2 Fru 6-P Fru 2,6-biP FBPase-2 PFK-1 Fru 1,6-biP Gli 3-P glucagon PFK-1 Por que a PFK é o ponto de regulação mais importante e não a hexoquinase? PFK inibida = [frutose 6-fosfato] = [glicose 6-fosfato] = HXK inibida logo, inibição da fosfofrutoquinase vai resultar na inibição da hexoquinase! PIRUVATO QUINASE • • • • • Último passo da via glicolítica. Fluxo de saída. Produz ATP e Piruvato. Também é um tetrâmero apresentando diferentes isoformas em diferentes tecidos. Isoforma L (fígado) e isoforma M (músculo). Muitas propriedades em comum: - Frutose 1,6-bisfosfato: ativa - ATP: inibe alostericamente - Alanina: produzida a partir de piruvato, inibe a PYK. PIRUVATO QUINASE • No entanto, as isoformas L (fígado) e M (músculo) diferem na regulação por modificação covalente: fosforilação. • A isoforma L é inativada ao ser fosforilada quando o nível de glicose no sangue cai (estímulo disparado pelo glucagon) Aspectos clínicos - glicólise 1) Isquemia (Infarto do miocárdio): Isquemia: falta de suprimento sangüíneo para um tecido orgânico necrose do tecido por isquemia 2) Células tumorais: Otto Warburg – 1920 Células tumorais Ascites convertem glicose equivalente a 30% do peso seco em lactato/h. (Músculo esquelético humano = 6% do peso seco em lactato/h) 55 56 57 Diabetes Mellitus: comum no Brasil (prevalência 7,6 % da população brasileira entre 30 e 69 anos) Apresentam hiperglicemia Tipo I: insulino-dependente ou juvenil. É uma doença auto-imune que provoca a destruição de células das ilhotas do pâncreas. Tipo II: não insulino-dependente (resistente a insulina, e por secreção deficiente de insulina). 80% estão acima do peso adequado Síndrome Metabólica No diabetes o organismo comporta-se como no jejum prolongado. Um dos métodos de monitoramento da hiperglicemia é o exame que mede a Hemoglobina glicosilada (HbA1c): em diabetes essa taxa pode ser até 3 X maior. GLICOGÊNIO • Glicogênio vai aumentar a disponibilidade de glicose entre as refeições. • Estoque energético de glicogênio: 600 Kcal (homem 70 Kg) • Estocado principalmente nos músculos e fígado. Glicogênio: forma polimérica da glicose • Necessidade de uma reserva energética de Glicose + ATP Glicose 6-fosfato + ADP + H+ fácil mobilização hexoquinase Glicose 6-fosfato Glicose 1-fosfato fosfoglicomutase Glicose 1-fosfato + UTP UDP-G + PPi UDP-glicose pirofosforilase Estrutura • Polímero ramificado de radicais de glicose • Presente em grânulos no citoplasma • Ligações α polímeros helicoidais abertos Estrutura • Glicídios Redutores e Não-Redutores: – Os açúcares redutores possuem grupos aldeídos e cetonas livres na cadeia e são chamados redutores por atuarem como agentes redutores, isto é, que sofrem oxidação (doam elétrons). Açúcares não redutores (como a sacarose) possuem esses grupamentos interligados e tornam-se redutores a partir do momento em que sofrem hidrólise (quebra). Glicogenólise • Glicogênio Fosforilase – Catalisa a remoção sequencial de radicais glicose da extremidade não redutora da molécula de glicogênio – A clivagem fosforolítica do glicogênio é energeticamente vantajosa Glicogenólise Degradação do Glicogênio Grupo prostético: piridoxal fosfato (derivado da vit B6) Glicogenólise • Glicogênio Fosforilase – Mecanismo de ação: PLP = Piridoxal Fosfato Glicogenólise • Enzima desramificadora: 2 tipos de atividades Glicogenólise • Fosfoglicomutase No músculo a glicose 6-fosfato entra na via glicolítica, porém no fígado ele tem outro destino. Glicogenólise • Glicose-6-fosfatase: – Presente principalmente no fígado – Está localizada no lado lumial da membrana do Retículo Endoplasmático Rugoso Glicogenólise Glicogênese Glicose 6-fosfato + ADP + H+ Glicose + ATP hexoquinase Glicose 6-fosfato Glicose 1-fosfato fosfoglicomutase Glicose 1-fosfato + UTP UDP-G + PPi UDP-glicose pirofosforilase Glicogênese • UDP-Glicose pirofosforilase: Pirofosfatas e inorgânica 2 Pi Glicogênese • Glicogênio Sintase UDP-G + (Glicogênio)n resíduos de glicose (Glicogênio)n+1 resíduos de glicose + UDP glicogênio sintase α-1,4 UDP + ATP UTP + ADP Nucleosídeo difosfato quinase Glicogênese • Glicogênio Sintase Glicogênese • Glicogenina – Possui um oligossacarídeo de unidades de glicose α-1,4 ligadas ao átomo de oxigênio de um radical tirosina UDP-Glicose UDP UDP-Glicose UDP Glicogênese • Enzima ramificadora UDP-Glicose UDP UDP-Glicose UDP Glicogênese Ramificação: transferência de uma pequena cadeia de 6 ou 7 resíduos de glicose. Glicogênese • Enzima ramificadora Cadeia com pelo menos 11 oses 7 resíduos glicosil 4 resíduos glicosil Glicogênese Síntese do glicogênio REGULAÇÃO • Manter nível de glicose no sangue. • Fornecer energia para trabalho muscular. • Envolve mecanismos hormonais que ocorrem também em outras vias metabolicas. • Mostra isoenzimas desempenhando seus papéis tecido-específicos. GLICOGÊNIO FOSFORILASE Fosfoproteina fosfatase (PP1) Fosforilase b quinase Quebra de glicogênio Regulação da Glicogenólise GLICOGÊNIO FOSFORILASE Cálcio: Disparado na contração muscular ativa a fosforilase b kinase (isoforma muscular) que apresenta um domínio calmodulina AMP resultante da quebra de ATP quando a musculatura está sob contração vigorosa ativa alostericamente a glicogênio fosforilase Amplificação do sinal GLICOGÊNIO FOSFORILASE • A glicogênio fosforilase do fígado não é ativada por AMP. GLICOGÊNIO FOSFORILASE fígado Glicogênio fosforilase = sensor da [glicose] no fígado A glicogênio sintase mantem-se inativa por meio de fosforilação de serinas: Glicogênio sintase quinase 3 (GSK3) GLICOGÊNIO SINTASE glicose 6-P liga-se a um sítio alostérico na glicogênio sintase aumentando o acesso da fosfoproteína fosfatase HORMÔNIOS • Substâncias sinalizadoras sintetizadas pelo sistema endócrino. • Circulam em pequenas concentrações. • Especificidade + Amplificação de sinal. • Insulina, Glucagon e Epinefrina CASCATA DE SINALIZAÇÃO Regulação da síntese do glicogênio Regulação da internalização da glicose por seqüestro de transportadores transportador GLUT-4: tecidos muscular e adiposo X transportador GLUT-2: Tecido hepático- constitutivamente exposto GLUT-4 permanece sequestrado em vesículas no citoplasma até que a Insulina sinalize para sua exposição. A regulação da insulina também ocorre a nível transcricional Músculo Fígado Fígado Músculo A respiração celular : fase aeróbica do catabolismo de açucares, lipideos, protéinas Ao nível macroscópico, a respiração se refere as trocas gasosas entre um organismo multicelular e seus meio ambiente (O2 consumido e CO2 produzido) 2 ADP 2 ATP 1glicose HQ 2 piruvato mitocôndria citosol As Reações do Ciclo de Krebs Piruvato NAD+ Mitocôndria NADH CO2 CoA-SH O complexo Piruvato Desidrogenase Três tipos de enzimas em cópias múltiplas: E1, E2, E3 Ex: piruvato desidrogenase de E. coli contém 60 s-u proteícas Descarboxilação oxidativa Complexo piruvato desidrogenase: E1= piruvato desidrogenase (24 s-u) E2= dihidrolipoil transacetilase (24 s-u) E3= dihidrolipoil desidrogenase (12 s-u) Regulação do complexo PDC • Inibida quando [ATP/ADP], [NADH/NAD+] e [acetilCoA/CoA] • Inibida por ácido graxos de cadeia longa (mod. alostérica) • Por modificação covalente (mamíferos): - piruvato desidrogenase cinase fosforila E1 inativa o PDC (ATP é um ativador alost. desta cinase) - piruvato desidrogenase fosfatase : reativa o PDC 1° Reação: 2° Reação: 3° Reação: Ocorre a primeira descarboxilação oxidativa com liberação com conservação de energia na forma de NADH 4° Reação: 5° Reação: 6° Reação: Ocorre conservação de energia na forma de FAD reduzido. A succinato desidrogenase é a única enzima do TCA que está ligada à matriz mitocondrial 7° Reação: 8° Reação: Saldo final – Cada molécula de Acetil-CoA que entra no ciclo gera: •3 NADH •1 FADH2 •1 GTP ou ATP Componentes do TCA são importantes intermediários anabólicos Reações anapleróticas repõem os intermediários A Regulação do Ciclo de Krebs Piruvato carboxilase Diabetes e formação dos corpos cetónicos... A mitocôndria é capaz de oxidar os NADH’s do ciclo de Krebs e que isso rendia ainda mais ATP que na via glicolítica Rendimento de ATP pela oxidação completa da Glicose A mitocôndria... Membrana interna Impermeável a maioria das pequenas moléculas e íons, incluindo H+. Componentes: Cadeia respiratória ADP-ATP trocador ATP sintase Outros transportadores Membrana externa Complexo piruvato desidrogenase Enzimas do ciclo de krebs Oxidação de ácidos graxos e aminoacidos ATP, ADP, Mg++, Ca++, K+ Permeável a íons e pequenas moléculas LANCADEIRA MALATO-ASPARTATO • Como a membrana interna da mitocôndria é impermeável a NADH e NAD+, a oxidação destes compostos produzidos pela via glicolítica não pode ser feita diretamente pela cadeia de transporte de elétrons. Os elétrons são transferidos para um composto citossólico, que transporta os elétrons na matriz mitocondrial, onde é oxidado. O composto oxidado retorna ao cistossol, permitindo a continuidade do processo. = Sistema de Lançadeira. Existe diferente tipos de lançadeira. Existe assim um “pool” mitocondrial de NADH e um “pool” cistossólico de NADH diferentes isoformas mito/citossólica ISOFORMA= proteínas similares de mesmo função que possuem uma localização diferente na célula. A lançadeira malato-aspartato existe nas células hepáticas e cardíacas. O NADH citossólico reduz o OAA no citossol, em malato (catalisada pela malato DH). O malato produzido penetra na mitocôndria, onde é oxidado também por uma outra isoforma de malato DH, mitocondrial, que utiliza o NAD+ como coenzima. O OAA produz pela mito não atravessa a membrana interna, mas pode receber o grupo amino do glutamato aspartato. Esse sai da mito, e no cistossol está regenerada em OAA (por uma Asp aminotransferase) . A passagem do malato e aspartao através da mb interna é efetuada via os translocadores (glutamato-Asp e de ácidos dicarboxílicos). Saldo: o NADH produz no citossol é novamente formado na matriz mitocondrial. O resto da lançadeira é responsável pela devolução do OAA do outro lado da mb. ATP sintetase é formada por várias sub-unidades Composto por dois componentes maiores: Fo (sensibilidade à oligomicina inibidor da FO ) e F1. PARTE dentro da mb: Fo passagem dos prótons (rotor) Parte dentro da matriz: F1 síntese do ATP (stator) F1: proteína contem 9 su (33) e vários sítio de ligação do ADP e ATP+ sítio catalítico de síntese do ATP. Interage com Fo: 10-15 polipeptídeos (c1) formando um canal TM para onde passam os prótons. Como essa enzima transforma o potencial de oxido-redução em ATP? Como é possível que a síntese de ATP (reação endergônica) é rapidamente reversível na superfície da enzima? ADP + Pi = ATP + H20
Baixar