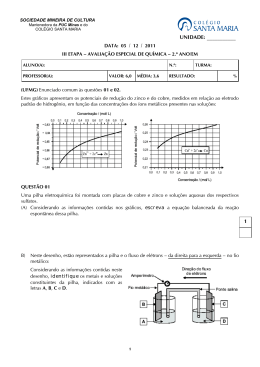
Trabalho de Química (2ª série EM) – Prof. Diogo Entrega: 22/10/15 Valor: 2,0 01. Alguns extintores de incêndio de espuma contêm bicarbonato de sódio (NaHCO 3) e ácido sulfúrico em compartimentos separados. Quando o extintor é acionado, estas substâncias entram em contato, produzindo gás carbônico, que sai misturado com uma solução e forma uma espuma que atua apagando o fogo. a) Explique como a espuma atua para apagar o fogo. b) Escreva a equação da reação do ácido sulfúrico com o bicarbonato de sódio. c) o bicarbonato de sódio também é utilizado como antiácido. Explique por que a solução aquosa deste sal apresenta um pH acima de 7. 02. Como consequência da poluição industrial, verificou-se em alguns lugares um aumento de até 1000 vezes na concentração hidrogeniônica da água da chuva. Sabendo-se que o pH normal da água da chuva é de 5,6, qual seria o valor do pH no caso da chuva ácida mencionada anteriormente? 03. Admita que café tem pH = 5,0 e leite tem pH = 6. Calcule: a) A concentração de OH- no café. b) A concentração de H+, em mol/L, em uma “média” de café com leite que contém 100 mL de cada bebida. 04. Calcule o pH de uma solução de HY, cujo grau de ionização é 2% e sua concentração é de 0,05 mol/L. 05. Dadas três soluções aquosas a 25 ºC: NaCl (solução I), NaF (solução II) e NH4Cl (solução III). a) Apresente a ordem crescente de acidez para estas três soluções. b) Justifique sua resposta do item anterior através do uso de equações químicas. 06. O Hipoclorito de sódio, NaOCl, é o principal constituinte da água sanitária. Soluções diluídas de água sanitária são recomendadas para lavagem de frutas e verduras. A equação a seguir representa o equilíbrio químico do íon hipoclorito em solução aquosa a 25 ºC. OCl-(aq) + H2O(l) HOCl(aq) + OH-(aq) Kh = 1,0 x 10-6 Considerando as informações fornecidas, qual o pH de uma solução aquosa de NaOCl de concentração 0,01 mol/L, a 25 oC? 07. 0,1% do cloreto de amônio se hidrolisou em água a 25 oC. Sabendo que a solução inicial do sal tinha concentração 10-2 mol/L, calcule: a) a equação iônica de hidrólise salina; b) a constante de hidrólise (Kh) c) o pH da solução; d) o valor da constante de dissociação do hidróxido de amônio (Kb). 08. Dadas as semirreações de uma pilha: Ag+ + e- Ago Eo = +0,80 V Mg2+ + 2e- Mgo Eo = - 2,37 V a) escreva as semirreações de cada eletrodo; b) Identifique: cátodo, ânodo, polo positivo e polo negativo; c) calcule o valor da ddp da pilha; d) quem é o agente redutor? 09. Considere a seguinte pilha representada a seguir e responda o que se pede. Alo / Al3+ // Fe2+ / Feo a) Quem é o cátodo e o ânodo? b) Quantos elétrons estão envolvidos na reação global desta pilha? c) Por que é necessário utilizar ponte de salina? 10. Quando se coloca um pedaço de zinco metálico numa solução de aquosa diluída de cloreto de cobre (II), de cor azul, observa-se que a intensidade da solução vai diminuindo até se tornar incolor. Ao mesmo tempo, observa-se uma deposição de cobre metálico sobre o zinco metálico. Ao término da reação, constata-se que uma parte do zinco foi consumida. a) Explique o fenômeno observado. Escreva a equação química correspondente. b) O que acontecerá quando um pedaço de cobre metálico for colocado em uma solução aquosa de cloreto de zinco? Justifique a resposta. OBS: para todas as respostas numéricas é necessário demonstrar o raciocínio utilizado através de contas ou esquemas. Respostas apenas com os valores serão desconsideradas!
Baixar