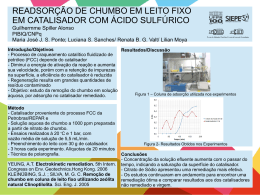
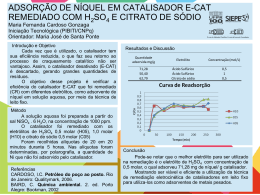
Catálise Catálise Homogênea – Catalisador solúvel no meio reacional. Catálise Heterogênea – Catalisador constitui uma fase distinta da fase reacional. “Catálise de contato”. Catálise Enzimática – Reações catalisadas por enzimas independentes se homogêneas ou heterogêneas. Mais importante: Catálise heterogênea:pelo menos 20% dos produtos manufaturados nos EUA são obtidos por reações catalíticas heterogêneas. Catalisadores • Maioria de catalisadores heterogêneos consistem de partículas de tamanho manométrico dispersas num suporte de alta área superficial. • Relação entre as propriedades das partículas nanométricas e o desempenho do catalisador Catalisadores • Exemplo: catalisador automotivo Pt, Rh, Ce, zircônia e lantânia, Ba Alumina Oxidação de HC e CO Redução NOx Trap SO3 Estocagem de O2 Exemplos • Nano partículas de V suportado em óxidos – desidrogenação de alcanos a olefinas • Nano partículas de Fe ou Co suportadas em alumina – síntese de Fischer Tropsch • Nano partículas de Mo suportadas em alumina – remoção de enxofre de frações de petróleo. • Ir depositado em nanotubos de carbono – decomposicão da hidrazina IMPORTANTES REAÇÕES CATALÍTICAS INDUSTRIAIS Na química mineral • Síntese de NH3 sobre cat. de Fe • Síntese de SO3 por oxidação de SO2 sobre cat. de Pt ou de V2O5 • Síntese de NO por oxidação de NH3 sobre cat de Pt-Rh Processo de fabricação de gás de síntese e de hidrogênio • Reforma com vapor de HCs com cat de Ni CO + H2 ; conversão de CO: CO + H2O H2 sobre cat. de óxido de Fe ou cat. misto de óxido de Zn, Cu, Cr. Processos de refino e obtenção de petroquímicos básicos Craqueamento catalítico gasóleos, gasolina, aromáticos e olefinas Reforma catalítica gasolina e aromáticos Hidroisomerização catalítica gasolina leve, isoparafinas leves Hidrocraqueamento catalítico gasolina, gasóleos e óleos combustíveis Hidrodesalquilação catalítica de alquil-aromáticos benzeno e naftaleno Hidrodessulfurização e hidrotratamentos Hidrogenação seletiva de gasolina de craqueamento Alquilação cumeno, etilbenzeno, gasolina Polimerização oligômeros diversos (gasolina, olefinas para detergentes e plastificantes) Síntese de HCs (Fischer-Tropsch) a partir de CO + H2 sobre cat. de Co, Ni ou Fe PETROQUÍMICA Hidrogenações Benzeno Ciclohexano Nitrilas (ou dinitrilas) Aminas (ou diaminas) (nylon) Fenol Ciclohexanol (ácido adípico e nylon) Nitrobenzeno Anilina Hidrogenações de ácidos graxos insaturados Hidrogenações seletivas diversas PETROQUÍMICA Desidrogenações • Parafinas Olefinas Diolefinas • (butano) (buteno) (butadieno) • Álcoois Cetonas • (álcool isopropílico) (acetona) Hidratações • Etileno Álcool Etílico PETROQUÍMICA Oxidações parciais • Etileno Óxido Etileno Ag • Metanol Formol Fe2O3 ou MoO3 • Etanol Acetaldeído V2O5 ou • Benzeno Anidrido Maleico MoO3 PETROQUÍMICA Naftaleno ou o-xileno Anidrido Ftálico V2O5 V2O5 ou • Buteno Anidrido Maleico P2O5 Molibdatos de Bi • Propeno Acroleína Fosfomolibdatos de Bi ou tungstatos de Bi Petroquímica e outros Oxiclorações e Clorações • Etileno + HCl • Síntese de metanol a partir do gás de síntese sobre ZnO, Cr2O3 e CuO Dicloroetano ( cloreto de vinila) Em polimerização: polietileno sobre Cr2O3 ou Ni suportados. Para produção de energia: pilhas combustíveis – eletrocatálise Controle de poluição: • Eliminação de SO2 e H2S (Claus) • Limpeza de gases industriais diversos Como age um Catalisador Heterogêneo? O ciclo é feito em 5 etapas: 1-Difusão dos sobre o catalisador 2-Adsorção dos reagentes sobre o catalisador (*) 3-Interação dos reagentes adsorvidos na superfície do catalisador (*) 4-Dessorção dos produtos da superfície do catalisador (*) 5-Difusão dos produtos da superfície do catalisador, restaurando o catalisador. CICLO CATALÍTICO A Aa B + Ba C + D Ca + Da DEFINIÇÕES • Sítio Ativo Espécie que participa como reagente de uma transformação química e que é recuperado. Pode ser uma enzima, um complexo e a superfície de um sólido. EXEMPLOS REAÇÃO CATALISADOR Craqueamento Zeólita (cristalino) SiO2 ou Ácido Bronstede ou acidos de Al2O3 (amorfo) Lewis Hidrogenação SÍTIO W / WS2 – NiO Estado de oxidação incomum de W (3+) devido à presença de Ni Ni / Al2O3 Átomos metálicos (Ni) 3+ Hidrogenação DEFINIÇÕES • Sítio Ácido Bronsted – sítios capazes de doar um próton para hidrocarboneto insaturado. • Sítio Ácido Lewis – atua como aceptor de elétron, removendo um íon H de um hidrocarboneto. C Se A B rB - taxa de formação de B m – massa de catalisador S – área específica do catalisador • Atividade específica: rB m • Atividade “por área”(real): rB S DEFINIÇÕES • Freqüência de reação (freqüência da formação de B) • N = no de moléculas de B formado/seg/ número de sítios ativos 10-2 < N < 102 N= “turnover number” DEFINIÇÕES • Seletividade Um mesmo catalisador pode gerar reações em paralelo B rB A rC C • Parcial = nO moles de A transformado em B / seg nO moles total de A transformado por / seg • Relativa = nO moles A transformado em B / seg nO moles de A transformado em C / seg EXEMPLO C2H5OH Al2O3 C = C NiO (C2H5)2 O MgO, ThO2 C=C -C=C Cu / Al2O3 CH3CHO (ZSM – 5) Ni / Al2O3 Al2O3 hidrocarbonetos CH4, CO, H2 - C – C – C – C – OH • Velocidade Espacial Volume ou massa alimentada de carga (a) / volume ou massa de catalisador ou área do catalisador. • Conversão Fração de reagente consumida na passagem pelo leito catalítico. • Catalisador Mássico Todo volume é a fase ativa. Não há diferença entre a natureza química da superfície e do interior do sólido. • Catalisador Suportado A fase ativa dispersa sobre um material usualmente inerte e poroso. DEFINIÇÕES • Fase Ativa Fase que atua na transformação química, isto é, apresenta atividade catalítica. • Promotor Uma espécie que, adicionada à fase ativa, pode melhorar a sua atividade catalítica: 1) pelo rearranjo da estrutura do catalisador, isto é, aumentando ou mantendo a área específica – estrutural. 2) aumenta atividade mas não afeta a área específica – químico. • Estrutura do Catalisador Arranjo dos átomos no espaço do catalisador – cristalinidade. , e = Al2O3 DEFINIÇÕES • Textura do Catalisador Arranjo do espaço do catalisador – volume de poros, área superficial. • Envelhecimento (desativação) Perda de atividade ou seletividade. • Venenos Impurezas presentes na carga ou no catalisador (durante sua preparação) que tem efeito negativo no desempenho do catalisador. Reversíveis: fracamente adsorvidos – facilmente removidos. Irreversíveis: fortemente adsorvidos – não é removido sem destruir o catalisador. Nanozeólitas • A eficiência das zeólitas como catalisadores é relacionada às suas propriedades morfológicas e particulares - estrutura cristalina bem definida, altas áreas específicas internas, poros uniformes, boa estabilidade térmica, etc.- gerando uma seletividade de forma para reações ocorrendo em um sistema microporoso. •As zeólitas são aluminossilicatos cristalinos microporosos com unidades tetraédricas produzindo estruturas de redes abertas que geram um sistema de poros e cavidades com dimensões moleculares. Nanozeólitas • O mecanismo do processo de cristalização, assim como as propriedades morfológicas e singulares (tamanho de cristal e distribuição) das zeólitas são influenciados pelas diferentes variáveis, tais como a fonte de alumínio e silício, a quantidade de silício, a razão direcionador/silício, a basicidade, a temperatura de cristalização, a presença de sementes, a quantidade de água, etc. Nanozeólitas O transporte lento nos microporos da zeólita leva a taxas de reação lentas ou reações secundárias paralelas indesejáveis como resultado de tempos de residência altos. Com a finalidade de se beneficiar completamente dos efeitos de adsorção/dessorção e seletividade de forma nos microporos sem sofrer de limitações difusionais, o caminho de difusão nos microporos deve ser encurtado. • Os catalisadores baseados em zeólitas podem ser mais efetivos quando os cristais são menores ou quando uma rede de microporos secundária é gerada com uma matriz primária de poros mais largos. Nanozeólitas • A mordenita é uma zeólita com poros grandes, rica em sílica que possui diversos canais elípticos com anéis de doze membros com dimensões 0,67x0,70 nm paralelos ao eixo c assim como anéis de 8 membros com dimensões de 0,29x0,57nm. Sendo os últimos canais pequenos demais para permitirem a difusão de moléculas através deles, a estrutura resultante é considerada unidirecional [2]. 2.4µm 7x5 micronmetros 400nm 110 nm Co/zeólitaKL
Download