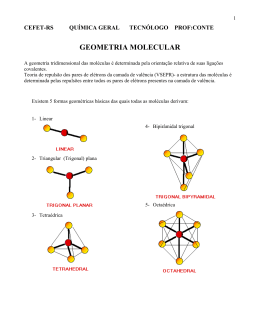
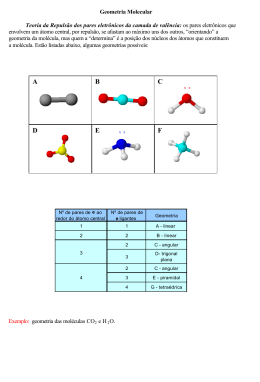
Geometria Molecular Estuda a geometria de moléculas simples Átomos se arranjam ao redor de um átomo central Átomo central Geometria Molecular Número de Pares de elétrons Ligantes Geometria Presença de Elétrons Livres na Camada de valência LINEAR 1 Indiferente O2, HF LINEAR não CO2; BeH2 2 ANGULAR H2O sim Geometria Molecular Número de Pares de elétrons Ligantes Geometria Presença de Elétrons Livres na Camada de valência TRIGONAL PLANA NÃO BF3 3 PIRAMIDAL SIM NH3 Geometria Molecular Número de Pares de elétrons Ligantes Geometria TETRAÉDRICA 4 CH4 BIPIRAMIDAL 5 PCl5 Presença de Elétrons Livres na Camada de valência Geometria Molecular Número de Pares de elétrons Ligantes Geometria OCTAÉDRICA 6 SF6 Presença de Elétrons Livres na Camada de valência Resumo 1 1 1 1 Hibridações sp3 109º 28’ 107,3º 104,5º Hibridaçao sp3 (ângulo de 104,5º) Hibridação sp3 (PUC-MG-2002) Um elemento X (Z = 1) combina com Y (Z = 7). O composto formado tem, respectivamente, fórmula molecular e forma geométrica: a) XY3: trigonal b) X3Y: angular c) YX3: piramidal d) YX: linear (PUC - RJ-2008) De acordo com a Teoria da repulsão dos pares eletrônicos da camada de valência, os pares de elétrons em torno de um átomo central se repelem e se orientam para o maior afastamento angular possível. Considere que os pares de elétrons em torno do átomo central podem ser uma ligação covalente (simples, dupla ou tripla) ou simplesmente um par de elétrons livres (sem ligação). Com base nessa teoria, é correto afirmar que a geometria molecular do dióxido de carbono é: a) trigonal plana. b) piramidal. c) angular. d) linear. e) tetraédrica (UFBA-2006) Os desenhos são representações de moléculas em que se procura manter proporções corretas entre raios atômicos e distâncias internucleares. Os desenhos podem representar, respectivamente, moléculas de a) oxigênio, água e metano. b) cloreto de hidrogênio, amônia e água. c) monóxido de carbono, dióxido de carbono e ozônio. d) cloreto de hidrogênio, dióxido de carbono e amônia. e) monóxido de carbono, oxigênio e ozônio.
Baixar