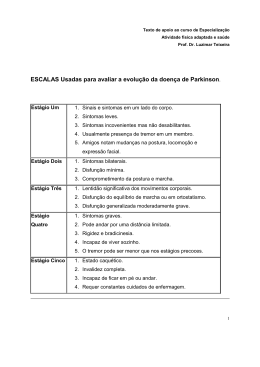
EFEITOS DO EXERCÍCIO FÍSICO NA DOENÇA DE PARKINSON Paulo Renato Bif da Silva*; Jucélia Jeremias Fortunato** * Acadêmico do Curso de Fisioterapia da UNISUL ** Docente do Curso de Fisioterapia da UNISUL RESUMO A Doença de Parkinson é uma afecção neurológica que afeta os neurônios dopaminérgicos dos gânglios da base do cérebro. A síndrome caracteriza-se por afetar a população idosa e por deixar seqüelas como bradicinesia, déficits cognitivos, instabilidade de tronco e alterações da marcha. O exercício físico em intensidades adequadas vem se tornando um método importante de prevenção e tratamento da DP. Em vários estudos são descritos os efeitos neuroprotetores e aumento da neuroplasticidade com a intervenção do exercício. O seguinte trabalho teve como objetivo principal avaliar os efeitos do exercício voluntário em ratos submetidos a um modelo de parkinsonismo por MPTP. O estudo contou com 4 grupos de 4 animais, sendo que um grupo recebeu salina e não treinou, outro grupo recebeu salina e treinou, outro grupo recebeu MPTP e não treinou, e o último grupo recebeu MPTP e treinou. Os testes utilizados avaliaram memória e atividade motora. Os dados foram analisados através do método estatístico ANOVA two-way com p<0,05. A análise dos dados mostrou que o grupo que recebeu MPTP e não praticou exercício obteve um resultado significativamente inferior ao grupo que recebeu MPTP e treinou no teste da memória. No teste de atividade motora, não houve diferença significativa entre os grupos. Em conclusão, o exercício conseguiu prevenir danos cognitivos aos animais submetidos ao parkinsonismo. Novos estudos poderiam ser desenvolvidos com objetivo de avaliar o exercício como prevenção a danos da atividade motora causados pela Doença de Parkinson. Palavras-Chave: Doença de Parkinson; exercício físico; memória. ABSTRACT The Parkinson's disease is a neurological disorder that affects the dopaminergic neurons of the basal ganglia of the brain. The syndrome is characterized by affecting the elderly population and to cease sequels as bradykinesia, cognitive injurys, instability of trunk and changes in gait. The exercise at adequate intensities comes becoming an important method of prevention and treatment of PD. In several studies are described the neuroprotective effects and increased neuroplasticity with the intervention of exercise. The following work aimed to evaluate the effects of voluntary exercise in rats subjected to a model of parkinsonism by MPTP. The research involved 4 groups of 4 animals, with one group received saline and not trained, another group received saline and trained, another group received MPTP, not trained, and the last group received MPTP and trained. The tests evaluated memory and motor activity. The data were analyzed using the statistical method ANOVA two-way with p<0.05. Data analysis showed that the group that received MPTP and don’t engage in exercise obtained a result significantly lower than the group that received MPTP and trained on test of the memory. The testing of motor activity there was no significant difference between groups. In conclusion, the exercise warned cognitive damages to the animals underwent to parkinsonism. Further studies could be developed to evaluate the exercise to prevent damage to the motor activity caused by Parkinson's disease. Keywords: Parkinson’s disease; physical exercise; memory. INTRODUÇÃO A Doença de Parkinson (DP) é a síndrome extrapiramidal mais encontrada na população idosa, representando até 2/3 dos pacientes que visitam os grandes centros de distúrbio do movimento1, 2. A incapacidade gerada pela Doença de Parkinson é comparável à causada pelos acidentes vasculares encefálicos. A prevalência da DP tem sido estimada entre 85 e 187 casos por 100.000 pessoas ou 1% da população com mais de 55 anos. O início do quadro clínico ocorre geralmente entre os 50 e 70 anos de idade3. São vários os prejuízos cognitivos e motores causados pela DP. Dentre eles podemos citar, respectivamente, a perda de memória e a bradicinesia como os mais comuns e alguns dos mais incapacitantes1. A partir do alto índice de indivíduos portadores da DP, tornou-se necessário um modelo animal para estudo mais aprofundado dos tecidos cerebrais afetados. Foi onde o MPTP, substância que consegue uma neurodegeneração específica de neurônios dopaminérgicos4, evoluiu os modelos de parkinsonismo, levando a várias descobertas importantes1. Dentro da neurociência, mais precisamente em estudos com animais, contamos com alguns testes que avaliam atividade motora e cognição, podendo ajudar na elucidação de afecções como a DP. Os testes usados para avaliar memória e atividade motora nesse estudo foram o Labirinto Aquático de Morris e o teste de reconhecimento em campo aberto, respectivamente. A prática regular do exercício físico vem mostrando muitos resultados positivos no Sistema Nervoso Central (SNC) ao longo do tempo. Várias patologias, como Parkinson4,5,6,7,8,9,10,11 e Alzheimer12 têm relacionado em seu tratamento a atividade física regular. Atualmente, muitos estudos vêm apresentando o exercício como prevenção e tratamento da Doença de Parkinson, e a maioria desses trabalhos trazem resultados positivos, tanto em humanos quanto em animais13,14. Levando em conta a alta prevalência1 da enfermidade, torna-se necessário um estudo detalhando os comprometimentos motores e cognitivos e também os benefícios que uma atividade simples e de fácil aplicação, como o exercício, pode trazer para os pacientes com DP. A partir dos dados levantados anteriormente, formulamos o seguinte objetivo principal: Avaliar os efeitos preventivos do exercício nos prejuízos cognitivos e motores de ratos induzidos ao parkinsonismo por MPTP. E os seguintes objetivos específicos: Verificar se existe diferença entre animais que praticaram exercício e receberam salina e animais que também receberam salina, mas que não praticaram exercício. Avaliar se o exercício, mesmo voluntário, seria capaz de induzir uma neuroproteção. MATERIAIS E MÉTODOS A presente pesquisa se classifica quanto ao nível como explicativa, quanto a abordagem como quantitativa e quanto ao procedimento utilizado na coleta de dados como experimental fatorial. O estudo foi realizado no Laboratório de Farmacologia da Universidade Federal de Santa Catarina (UFSC) e contou com 16 ratos machos, raça Wistar, linhagem C57BL6 com 5 a 7 meses de vida provenientes do biotério da (UFSC). Os animais foram dispostos em 4 grupos de 4 ratos cada um, ocupando uma gaiola por grupo. Todas as gaiolas dispunham de água e comida ad libitum e foram mantidos à temperatura de 23˚C± 2 num ciclo claro-escuro de 12 horas. Cada grupo recebeu um nome que corresponde aos procedimentos aplicados aos animais daquela gaiola. Os animais do grupo 1 (salina) recebeu apenas salina pela técnica de injeção intracerebroventricular22 (i.c.v.); os ratos do grupo 2 (salina exercício) receberam salina i.c.v. e praticaram exercício na roda de correr fixada na parede da gaiola; os animais do grupo 3 (MPTP) receberam apenas MPTP i.c.v.; e os animais do grupo 4 (MPTP exercício) receberam MPTP i.c.v. e praticaram exercício na roda de correr. Os animais dos grupos 2 e 4 ficaram com as rodas de correr em suas gaiolas durante 4 semanas, podendo praticar exercício voluntário a qualquer momento. Nessas gaiolas, as rodas possuíam um conta-giros para controle da velocidade atingida e distância percorrida pelos ratos. Para o tratamento com MPTP, os ratos foram submetidos a quatro injeções de 100ug de MPTP diluídos em 4ul de solução salina com intervalo de 2 horas a cada injeção através do método i.c.v. Para o tratamento com salina, as injeções foram realizadas com os mesmo parâmetros, mas sem nenhuma substância diluída. As administrações foram feitas 7 dias antes dos testes comportamentais, para os efeitos do parkinsonismo se manifestarem; e 1 dia após o término dos treinos nas gaiolas. Após as injeções, as rodas de correr foram retiradas das gaiolas. Para avaliação da memória foi utilizado o labirinto aquático de Morris. O teste foi realizado em uma piscina circular de 80cm de diâmetro com 30cm de profundidade, e uma plataforma de 5cm de largura com 1cm de profundidade foi afixada no canto superior da piscina. Durante o teste, cada animal foi solto no canto oposto à plataforma e foi cronometrado o tempo que cada um levou para chegar até a plataforma. Esse procedimento foi realizado uma vez por dia durante quatro dias com todos os ratos. Para avaliação da atividade motora foi realizado o teste de reconhecimento em campo aberto. O teste foi realizado em uma caixa retangular com três paredes de madeira e uma de vidro para observação. O assoalho da caixa foi dividido em 12 quadrados de 15cm de lado, na disposição de 3x4. Cada animal foi solto no centro da caixa e foi contabilizada a distância que cada um percorreu no tempo de 5 minutos. Após os experimentos, os animais foram anestesiados e sacrificados por deslocamento cervical. As análises estatísticas entre os grupos foram realizadas por meio de análise de variância (ANOVA two-way) com post-hoc Tukey e p<0,05. O programa utilizado para realizar a análise estatística e a confecção dos gráficos foi o STATISTIC 7.0 (StatSoft Inc., Tulsa, EUA). RESULTADOS Os resultados obtidos estão descritos nas figuras abaixo. Figura 1: Relação entre as médias de distância percorrida e tempo de exercício pelo tempo total de coleta. (ANOVA two-way, p<0,05). Figura 2: Relação entre as velocidades média e máxima pelo tempo. (ANOVA two-way, p<0,05). A Figura 1 mostra a relação das médias de distância percorrida pelos animais, descrita em metros, e o tempo total de exercício, descrito em minutos, pelo tempo total de coleta dos resultados dos conta-giros, descrito em dias. A figura 2 mostra a relação entre as velocidades média e máxima, descritas em metros por minuto (m/min), pelo tempo total de coleta dos resultados dos contagiros, descrito em dias. Os valores apresentados nas figuras 1 e 2 foram coletados nos conta-giros instalados nas gaiolas dos animais que praticaram exercício. Figura 3: Relação entre tempo de latência e treinos no labirinto aquático. (ANOVA two-way, p<0,05). A figura 3 mostra a relação entre o tempo de latência, descrito em segundos, e os treinos realizados no labirinto aquático, sendo que cada grupo está representado por um marcador. Figura 4: Média de crossings por grupo. Figura 5: Média de rearings por grupo. As figuras 4 e 5 mostram as médias de crossings e rearings, respectivamente, obtidos no teste de campo aberto por cada grupo de animais. DISCUSSÃO A Doença de Parkinson caracteriza-se por apresentar um quadro clínico com bradicinesia, rigidez articular, tremores involuntários, instabilidade postural, sialorréia, déficit cognitivo, marcha em festinação. O diagnóstico é realizado clinicamente, sendo que para confirmação, o indivíduo precisa apresentar bradicinesia e mais outros dois sinais característicos1,2,3. Os sinais de déficit cognitivo geralmente envolvem perda de memória de curto ou longo prazo2,23, depressão, estado confusional agudo, falta de atenção e concentração. Desse modo, a DP pode levar à demência em alguns casos, assim como Doença de Alzheimer e doença de corpos de Lewy1. As estruturas cerebrais afetadas pela DP incluem os núcleos da base e suas conexões, onde se localizam o núcleo subtalâmico, os núcleos ventrais anterior e lateral do tálamo e a substância negra. Essas regiões são responsáveis, principalmente, pela resposta motora e planejamento de ações, tanto motoras quanto mentais, além de fazer parte do processamento da memória1. A DP leva a uma perda progressiva de células da substância negra, essa degeneração resulta numa diminuição da produção de dopamina, ocasionando uma disfunção da via nigroestriatal e, conseqüentemente, perda da dopamina estriatal. Atualmente acredita-se que essa perda dopaminérgica em regiões específicas, como as relacionadas com o sistema límbico e principalmente hipocampo, é que leva à sintomatologia mnemônica24,11,23. O hipocampo é uma estrutura muito importante em relação ao aprendizado e armazenamento de informações de longo e curto prazo. Apesar de não fazer parte dos núcleos da base do cérebro, a DP pode afetá-lo através da degeneração dopaminérgica, já que o hipocampo também é estimulado por esse neurotransmissor 24,25. Analisando o gráfico da figura 6, podemos observar o tempo de latência de cada grupo no teste do Labirinto Aquático de Morris. No primeiro treino, os animais de todos os grupos levaram praticamente o mesmo tempo para chegar à plataforma, em torno de 50 segundos. A mesma situação pôde ser observada no segundo treino, onde os animais de todos os grupos levaram cerca de 40 segundos para realizar o trajeto na piscina. Já no terceiro treino, os animais do grupo MPTP levaram significativamente mais tempo para realizar o teste do que os animais que receberam MPTP e praticaram exercício, levando à conclusão de que o exercício exerceu uma atividade neuroprotetora nos animais do grupo MPTP exercício. Já é sabido que o exercício aeróbico melhora a saúde do SNC aumentando o fluxo sangüíneo e os níveis de fatores de crescimento no cérebro, o que promove a função ideal dos neurônios. Muitos dos efeitos positivos do exercício sobre o cérebro ocorrem no hipocampo, o que confirma a prevenção para disfunções cognitivas26,27. O exercício físico tem potencial ação antidepressiva e é também um forte estabilizador humoral, isso se deve à capacidade do corpo responder ao exercício aumentando a produção de neurônios no hipocampo e sistema de recompensa. Uma maior quantidade de neurônios no hipocampo antes de ocorrerem situações estressantes também confere a grande vantagem ao cérebro de responder de forma mais adequada e saudável em situações de stress crônico. O aumento de células neurais a cada dia pode até dobrar se acrescentarmos o exercício físico à rotina25. Vários estudos28,29,30 já demonstraram que a atividade física regular contribui para a melhora das funções cognitivas. Esses trabalhos relatam uma forte correlação entre o aumento da capacidade aeróbia e ganho em funções cognitivas. O exercício contribui para a integridade cerebrovascular, aumenta o transporte de oxigênio para o cérebro, auxilia a síntese e degradação de neurotransmissores, bem como a diminuição da pressão arterial, dos níveis de Low Density Lipoproteins (LDL) e triglicérides, inibe a agregação plaquetária, o aumento da capacidade funcional e, conseqüentemente, a melhora da qualidade de vida24. Além desses fatores, podem ocorrer alterações hormonais, como o aumento da produção e liberação da β-endorfina24, considerada um modulador fisiológico da memória. Essas alterações poderiam, a longo prazo, alterar a biossíntese, secreção e/ou metabolismo de sistemas centrais, atuando principalmente em regiões como hipocampo28,30, amígdalas e septo medial (regiões importantes relacionadas com processos mnemônicos, informações) como consolidação, armazenamento e evocação de 14,24 . Nas figuras 7 e 8, podemos observar os resultados do teste de Campo Aberto, que avaliou atividade motora. No gráfico da figura 7, descrevemos os crossings, que não foram significativamente maiores no grupo MPTP exercício do que no grupo MPTP. A mesma situação ocorreu no gráfico da figura 8, onde os rearings também não foram significativamente maiores no grupo MPTP exercício do que no grupo MPTP. A DP também se caracteriza por apresentar várias alterações motoras, como bradicinesia, tremores em repouso, alterações da marcha, entre outras. A bradicinesia, a perturbação neurológica que mais diferencia o parkinsonismo de outros distúrbios motores, pode ser traduzida por um alentecimento dos movimentos, especialmente dos movimentos automáticos associados, conferindo 1,3 movimentação . CONCLUSÃO O trabalho descreveu as seguintes conclusões: uma pobreza geral da - Os efeitos neuroprotetores provocados pelo exercício foram confirmados através dos resultados do teste de memória. - A atividade motora não foi alterada, tanto pelo parkinsonismo, quanto pelo exercício. - A atividade física em intensidade moderada foi capaz de prevenir os danos ao SNC causados pelo MPTP. - Novos estudos devem ser desenvolvidos avaliando a atividade motora em animais com danos ao SNC e usando o exercício moderado como forma de prevenção ou tratamento. REFERÊNCIAS 1 Meneses MS, Teive HAG. Doença de Parkinson. Rio de Janeiro: Guanabara Koogan; 2003. 2 Jankovic J, Tolosa E. Parkinson's disease and movement disorders. Philadelphia: Lippincott Williams & Wilkins, 2007. 3 Ferraz HB. Doença de Parkinson: Prática clínica e terapêutica. São Paulo: Editora Atheneu; 2005. 4 Bezard E, Dovero S, Bioulac B, Groos C. Effects of different schedules of MPTP administration on dopaminergic neurodegeneration in mice. Experimental Neurol. 1997 Apr; 148: 288-292. 5 Crizzle AM, Newhouse IJ. Is physical exercise beneficial for persons with Parkinson’s disease? Clin J Sport Med. 2006 Jul; 16: 422-425. 6 Fisher BE, Petzinger GM, Nixon K, Hogg E, Bremmer S, Meshul CK, Jakowec MW. Exercise-induced behavioral recovery and neuroplasticity in the 1-Methyl-4-Phenyl1,2,3,6-Tetrahydropyridine-lesioned mouse basal ganglia. Journal of Neuroscience Research. 2004 May; 77: 378-390. 7 Al-Jarrah M, Pothakos K, Novikova L, Smirnova IV, Kurz MJ, Stehno-Bittel L, Lau YS. Endurance exercise promotes cardiorespiratory rehabilitation without neurorestoration in the crhonic mouse model of parkinsonism with severe neurodegeneration. Neuroscience. 2007; 149: 28-37. 8 Liebetanz D, Baier PC, Paulus W, Meuer k, Bähr M, Weishaupt JH. A highly sensitive automated complex running wheel test to detect latent motor deficits in the mouse MPTP model of Parkinson’s disease. Experimental Neurology. 2007 Feb; 205: 207-213. 9 Petzinger GM et al. Effects of treadmill exercise on dopaminergic transmission in the 1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridine-lesioned mouse model of basal ganglia injury. Journal of Neuroscience. 2007 May; 27(20): 5291-5300. 10 Tillerson JL, Caudle WM, Reverón ME, Miller GW. Exercise induce behavioral recovery and attenuates neurochemical deficits in rodent models of Parkinson’s disease. Neuroscience. 2003 Jan; 119: 899-911. 11 Hirsch MA, Hammond FM. Cueing training in persons with Parkinson's disease. J Neurol Neurosurg Psychiatry. 2007 Feb;78(2):111. 12 Rolland Y et al. Exercise program for nursing home residents with Alzheimer's disease: a 1-year randomized, controlled trial. J Am Geriatr Soc. 2007 Feb; 55(2): 158 65. 13 Leng A, Mura A, Hengerer B, Feldon J, Ferger B. Effects of blocking the dopamine biosynthesis and of neurothoxic dopamine depletion with 1-Methyl-4-Phenyl-1,2,3,6Tetrahydropyridine (MPTP) on voluntary wheel running in mice. Behavioural Brain Research. 2004 Apr; 154: 375-383. 14 Aguiar AS, Pinho RA. Efeitos do exercício físico sobre o estado redox cerebral. Criciúma: Universidade do Extremo Sul Catarinense; 2005. 15 Faherty CJ, Shepherd KR, Herasimtshuck A, Smeyne RJ. Environmental enrichment in adulthood eliminates neuronal death in experimental parkinsonism. Molecular Brain Research. 2005 Aug; 135: 170-179. 16 Dauer W, Przedborski S. Parkinson’s disease: Mechanisms and models. Neuron. 2003 Sep; 39: 889-909. 17 Nieman DC. Exercício e saúde. São Paulo: Manole; 1999. 18 Dietrich MO, Mantese CE, Porciuncula LO, Ghisleni G, Vinade L, Souza DO, et al. Exercise affects glutamate receptors in postsynaptic densities from cortical mice brain. Brain Res. 2005; (1065): 20-25. 19 Ferro MM, Angelucci MEM, Anselmo-Franci JA, Canteras NS, Da Cunha C. Neuroprotective effect of ketamine/xylazine on two rat models os Parkinson’s disease. Brazilian Journal Medical and Biological research. 2006 Oct; 40: 89-96. 20 Cohen E. Neurociência para fisioterapeutas: incluindo correlações clínicas. São Paulo: Manole; 2001. 21 Vieira S, Hossne WS. Metodologia científica para a área da saúde. Rio de Janeiro: Campus; 2002. 22 Haley TJ, McCormick WG. Pharmacological effects produced by intra-cerebral injection of drugs in conscious mouse. Brit. J. Pharmacol. Jul; 12: 12-17. 23 Maurice T, Lockhart BP, Privat A. Amnesia induced in mice by centrally administered β-amyloid peptides involves cholinergic dysfuncion. Brain Research. 1996 Aug; 706: 181-193. 24 Mello MT, Tufik S. Atividade física, exercício físico e aspectos psicobiológicos. Rio de Janeiro: Guanabara Koogan; 2004. 25 Herculano-Houzel S. De bem com seu cérebro. In: Mente e Cérebro. São Paulo: Duetto. 2008, ano XVI, 188: 28-35. 26 Mcardle WD, Katch FI, Katch VL. Fisiologia do exercício: energia, nutrição e desempenho humano. 4 ed. Rio de Janeiro: Guanabara Koogan; 1998. 27 Powers SK, Howley ET. Fisiologia do exercício: Teoria e aplicação ao condicionamento e ao desempenho. São Paulo: Manole; 2005. 28 Garret Junior WE, Kinkerdall DT. A ciência do exercício e dos esportes. São Paulo: Artmed; 2003. 29 Perrig-Chielo P, Perrig WJ, Ehrsam R, Stahhelin HB, Krings F. The effects of resistence training on well-being and memory in elderly volunteers. Age and Ageing, 1998; 27: 469-75. 30 Chodzko-Zajko WJ, Physical fitness, cognitive performance, and aging. Med Sci Sports Exerc, 1991; 23(7): 868-72.
Download