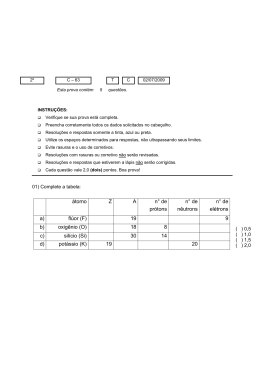
Universidade de Brasília Faculdade de Ceilândia – FCE - Disciplina: Do Átomo à Vida I Profa. Maria H. Conceição -2/2015 1ª. Lista de exercícios: Atomística 1. Qual era a hipótese atômica de Dalton? 2. Qual foi o modelo atômico sugerido por Thomson? 3. Quem derrubou o modelo de Thomson? E como fez isso? 4. Numere a segunda coluna de acordo com a primeira, relacionando os nomes dos cientistas com os modelos atômicos. 1.Dalton 2.Rutherford 3.Niels Bohr 4.Thomson ( ( ( ( ) Descoberta do átomo e de seu tamanho relativo. ) Átomos esféricos, maciços, indivisíveis. ) Modelo semelhante a um “pudim de passas” com cargas positivas e negativas em igual número. ) Os elétrons giram em torno do núcleo em determinadas órbitas. 5. Quantos prótons, elétrons e nêutrons existem num átomo de número atômico 44, e cuja massa é de 101? 6. São dados três átomos genéricos, A, B e C. O átomo A tem número atômico 70 e número de massa 160. O átomo C tem 94 nêutrons, sendo isótopo de A. O átomo B é isóbaro de C e isótono de A. O número de elétrons do átomo B é: a) 160 b) 70 c) 74 d)78 e)164 7. O átomo de telúrio (Te) possui 52 elétrons e 75 nêutrons. O seu número atômico, número de massa e número de elétrons da camada de valência são, respectivamente: a) b) c) d) e) 52, 127 e 5. 52, 127 e 6. 127, 52 e 6. 52, 75 e 5. 52, 127 e 4. 8. No esquema abaixo encontramos duas distribuições eletrônicas de um mesmo átomo neutro: 1s2 2s2 1s2 2s1 2p1 A B a) A é a configuração ativada. b) B é a configuração normal. c) A passagem de A para B libera energia na forma de ondas eletromagnéticas. d) A é um gás nobre. e) A passagem de A para B absorve energia. 9. No esquema abaixo, um elétron saltando de K para L deve: a) Absorver uma energia E1; b) Absorver uma energia E2; c) Absorver uma energia (E1 + E2); d) Absorver uma energia (E2 – E1); e) Devolver uma energia (E2 – E1). 10. Descreva quais são os 4 números quânticos e o que eles representam. 11. Qual é o número de elétrons de valência de cada um dos seguintes átomos: a) N b) Ag c) Nb d) W 12. Desenhe as fórmulas moleculares para dois sais iõnicos e dois compostos com ligações covalentes.
Baixar