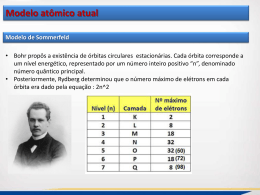
Resumo Modelos atômicos – Parte 02 SÉRIE: 1º ANO Química Professor: Hugo Cesário DATA: 03/ 08 / 2015 MODELOS ATÔMICOS (Foto: Ernest Rutherford; Niels Bohr ; Arnold Sommerfeld) Modelo atômico de Niels Bohr – Modelo do átomo de hidrogênio • • Bohr propôs um modelo atômico para o átomo de hidrogênio, baseado em postulados, procurando explicar a instabilidade do modelo de Rutherford. O modelo atômico de Böhr conseguia explicar os espectros descontínuos e a estabilidade dos elétrons ao descreverem órbitas circulares ao redor do núcleo. Para a construção de seu modelo, Böhr utilizou a Teoria dos Quanta de Max Planck. Segundo Planck, a energia não é liberada ou absorvida por átomos de forma contínua, mas na forma de pacotes de energia. A menor quantidade de energia liberada ou absorvida na forma de radiação eletromagnética foi denominada quantum de energia. Postulados: 1º O elétrons gira ao redor do núcleo em órbitas (Níveis de energia) circulares de raios definidos denominados órbitas estacionárias. 2º Cada órbita estacionária possui um valor determinado de energia. Nessas órbitas, o elétron pode se mover sem perder ou ganhar energia. 3º O elétron pode passar de uma órbita estacionária para outra, mediante absorção ou emissão de uma quantidade de energia. Max Planck Modelo de Sommerfeld. • • • • • Bohr propôs a existência de órbitas circulares estacionárias. Cada órbita corresponde a um nível energético, representado por um número inteiro positivo “n”, denominado número quântico principal. A explicação para o espectro fino foi dada pelo físico alemão Arnold Sommerfeld, em 1916. Sommerfeld postulou que os níveis de energia de Bohr eram divididos em subníveis de energia. Para caracterizar essa subdivisão dos níveis de energia, foi criado um segundo número quântico “l”, denominado azimutal ou secundário Novos conceitos de física quântica indicavam que a proposta de Sommerfeld não estava inteiramente correta. (Novos conceitos: dualidade onda-partícula e o princípio da incerteza) Caráter dual da matéria – Louis De Broglie • • “ Se algo tão parecido com ondas, como a luz, pode ser considerado como um fluxo de partículas, talvez algo tão parecido com partícula, como um elétron, possa ser considerado como onda” “ Todo corpo em movimento está associado a um comportamento ondulatório”. Portanto existe um grande erro nos modelos anteriores. Todos consideravam que o elétron era simplesmente uma partícula. Difração de um feixe de elétrons em 1925( Comprovando assim a dualidade) • Princípio da incerteza de Werner Heisenberg • • • De acordo com a física clássica, podemos calcular com exatidão a posição e a velocidade de um objeto Podemos fazer o mesmo com o elétron que é uma partícula-onda? Uma onda não possui localização definida no espaço, assim Heisenberg concluiu que é impossível determinar, de modo exato e simultâneo, a energia de uma partícula e a sua posição. • De acordo com o Princípio da incerteza, quanto maior for a precisão da posição, maior será o erro no momento linear, e vice-versa. Qualquer modelo físico para o átomo não pode, simultaneamente, localizar o elétron e descrever o seu movimento. Sendo assim, a ideia de orbitas com trajetórias e energia bem definidas, existente nos modelos de Bohr e Sommerfeld, está errada, pois viola o Princípio da incerteza. O que podemos fazer é determinar a probabilidade de encontrar o elétron em uma dada região ao redor do núcleo (Orbitais) A equação de onda de Erwin Schrondinger • • • • • • • • • Shrondinger criou uma equação de onda para descrever partículas subatômicas em sistemas quânticos. Levou em conta a natureza ondulatória das partículas (De Broglie) e seu comportamento probabilístico ( Heisenberg). Max Born descobriu que a função de onda elevado ao quadrado fornece a probabilidade de que o elétron se encontre em uma dada região ao redor do núcleo. (psi^2) Pode ser interpretado como a densidade de probabilidade eletrônica. (Desse modo surgiu o conceito de orbital) (psi^2) • Orbital – Região de máxima probabilidade de se encontrar o elétron 2 Max Born
Baixar