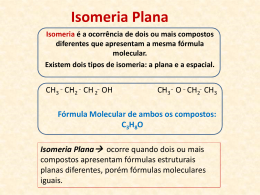
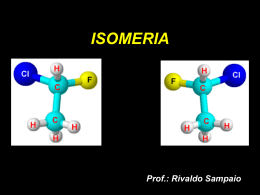
ISOMERIA QUIMICA ELECTIVA Profesor : Ricardo Abarca ISOMERIA Isomeria es un fenomeno en que compuestos organicos tienen una misma fórmula molecular, siendo compuestos diferentes. ISOMERIA Etimologicamente, significa partes iguales. ISO, igual MEROS, partes 1. 2. ISOMERIA Los compuestos (modelos al lado) son diferentes. Sus propiedades físicas no son iguales. ISOMERIA Pero sustancias tienen la misma fórmula molecular ( C4H10O ) . Ellos son por lo tanto los isómeros ISOMERIA ISOMERIA ( Compuestos diferentes PERO CON FÓRMULA MOLECULAR MISMO ) PLANA De cadena De posicion de funcion ESPACIAL metameris mo GEOMÉTRICA ÓPTICA ISOMERIA PLANA Es la que se produce cuando la diferencia entre los isómeros puede explicarse por la observación de sólo las fórmulas estructurales planas . ISOMERIA PLANA DE cadena DE Posicion De funcion metamerismo DE CADENA También se llama núcleo isomería es uno en el que los isómeros tienen diferentes núcleos o hebras . DE POSICION Eso es lo que ocurre cuando los isómeros tienen la misma cadena de carbono , pero difieren en la posición de las carpetas o enlaces dobles o triples DE FUNCION También isomería funcional es la que se produce cuando los isómeros pertenecientes a diferentes funciones químicas . DE FUNCION OTROS Ejemplos DE FUNCION Hay un caso particular de la isomería función en la que dos isómeros están en equilibrio dinámico. En particular, se llama tautomería TAUTOMERIA Los casos más comunes se producen entre tautomería : Aldehído y fenol; Cetona y fenol . TAUTOMERIA Ejemplo participación aldehído y enol tautomerismo. TAUTOMERIA Ejemplo cetona y enol tautomería en cuestión. METAMERIA También se llama la mano isomería , es uno en el que los isómeros difieren por la posición de un heteroátomo en la cadena METAMERIA OTROS EJEMPLOS ISOMERIA ESPACIAL Es eso lo que se explica por las estructuras ( fórmulas ) espacio. También se le llama ESTERIOISOMERIA . ISOMERIA ESPACIAL GEOMÉTRICA ÓPTICA ISOMERIA GEOMÉTRICA También se llama isomería cis-trans . Los compuestos tienen la misma fórmula plana , pero hay que tener en cuenta espacialmente átomos ligantes . Véanse los ejemplos que siguen ISOMERIA GEOMÉTRICA Modelos para o composto ClCH=CHCl carbono hidrogênio cloro ISOMERIA GEOMÉTRICA Sobre la base de los modelos presentados , observe que: En el primer caso , los dos átomos de cloro están en el mismo lado del plano que divide la molécula. Esta figura se llama forma cis . ( Cis = mismo lado ) ISOMERIA GEOMÉTRICA En el segundo caso, los dos átomos de cloro están en lados opuestos del plano que divide la molécula. Esta figura se llama trans . ( Vía trans = ) ISOMERIA GEOMÉTRICA Si son diferentes , como son los nombres de los compuestos , respectivamente ? Cis -1,2 -dicloro- eteno trans- 1,2-dicloro - eteno ISOMERIA GEOMÉTRICA Existe una condición para la isomería cis-trans , la existencia de doble enlace y tienen la estructura : R1 R3 C = C R2 R4 Diferente R1 y R2 diferente de R3 y R4 pueden R1 (o R2) es igual o diferente de R3 y R4. ISOMERIA GEOMÉTRICA También hay isomería en compuestos cíclicos . Ramificaciones como " arriba " o " abajo " el plano que divide la molécula , que isomería cis o trans . ISOMERIA GEOMÉTRICA Modelos para o composto 1,2-cloro-ciclopropano Carbono hidrogênio cloro ISOMERIA GEOMÉTRICA En el primer modelo , los átomos de cloro están en el mismo lado del plano del anillo : la forma cis . En el segundo modelo , un átomo de cloro está por encima y uno debajo del plano del anillo , es la forma trans. ISOMERIA GEOMÉTRICA ¿Cómo son los nombres de los compuestos , respectivamente ? Cis -1,2 -dicloro- ciclopropano Trans -1,2 -dicloro- ciclopropano ISOMERIA GEOMÉTRICA La isomería cis-trans se encuentra presente en los aceites vegetales , el poliinsaturados llamados debido a los dobles enlaces presentes en las moléculas . ISOMERIA GEOMÉTRICA ISOMERIA GEOMÉTRICA Cuando se producen las margarinas , a fin de obtener consistencia sólida , añadiendo hidrógenos ( hidrogenación ) satura moléculas que favorecen el aumento de colesterol y triglicéridos en la sangre. ISOMERIA ÓPTICA Para tratar de entender por qué se produce la isomería óptica , hagamos algunas comparaciones iniciales de asimetría visible , ya que es un concepto tan fundamental en este caso . ISOMERIA ÓPTICA La asimetría de las manos . Observe la imagen en el espejo ISOMERIA ÓPTICA No se puede superponer su mano derecha sobre la izquierda . Ellos son diferentes, o más bien asimétrico. ISOMERIA ÓPTICA Este tipo de asimetría quiral se dice , viene de la palabra griega cheir , que significa mano . ISOMERIA ÓPTICA Tenga en cuenta que el intento de solapar las moléculas de ácido láctico a fin de obtener los mismos compuestos se siente frustrado . Aquí, como en las manos, existe una asimetría o " quiralidad ". ISOMERIA ÓPTICA Es decir que hay dos tipos de ácido láctico ? ISOMERIA ÓPTICA La respuesta es sí . Por ejemplo, hay un tipo de ácido láctico que se produce en la leche y otros, los músculos cuando nos calambres. ISOMERIA ÓPTICA Os ácidos láticos apresentados têm isomeria óptica. Por que isomeria ”óptica”? ISOMERIA ÓPTICA Tudo começou com Louis Pasteur estudando propriedades ópticas relacionadas às formas de cristais de sais de amônio de tártaro presentes no vinho. ISOMERIA ÓPTICA Munido de uma pinça, uma lupa e muita paciência, Pasteur separou os cristais do sal de amônio, submetendo-os a um feixe de luz polarizada, num aparelho chamado polarímetro. ISOMERIA ÓPTICA Perceba que os cristais tem formas assimétricas. Pasteur observou o comportamento das soluções de ambos ao polarímetro. ISOMERIA ÓPTICA Esquema de um polarímetro. A luz, ao passar pela amostra, é desviada para direita ou para a esquerda. ISOMERIA ÓPTICA Diz-se que as amostras de sais de tártaro testadas por Pasteur são opticamente ativas, pois desviam a luz polarizada, para a direita ou para a esquerda. ISOMERIA ÓPTICA Lembrando que Pasteur separou os sais em dois grupos, qual o comportamento frente à luz polarizada? ISOMERIA ÓPTICA A amostra que desviou a luz para a direita chama-se dextrógira (+) e para a esquerda, levógira (-). ISOMERIA ÓPTICA A mistura de ambas não desvia a luz e Pasteur chamou-as mistura racêmica. ISOMERIA ÓPTICA Em 1815, Biot descobriu que muitas outras substâncias (açúcar, cânfora,...) tinham esse comportamento: atividade óptica. ISOMERIA ÓPTICA Hoje se sabe que tal comportamento é devido a carbono ligado a quatro grupos diferentes entre si: carbono assimétrico ou quiral. ISOMERIA ÓPTICA Voltando ao ácido lático. H C CH3 C* COOH OH Exemplo de quiralidade e conseqüente ATIVIDADE ÓPTICA. Repare que o carbono central é assimétrico. Está ligado a quatro grupos diferentes. ISOMERIA ÓPTICA Atenção! Uma mesma molécula pode apresentar mais de um carbono assimétrico, o que multiplica a quantidade de isômeros ópticos para uma mesma fórmula molecular. ISOMERIA ÓPTICA ISOMERIA ÓPTICA Como ficam os nomes dos isômeros do ácido lático? 1. 2. Com desvio para a direita: ácido-2-hidróxipropanóico (+) Com desvio para a esquerda: ácido-2-hidroxipropanóico (-) ISOMERIA ÓPTICA Concluindo Para conhecer o comportamento químico de uma substância, muitas vezes, bastam suas fórmulas moleculares ou estruturais planas. ISOMERIA ÓPTICA Concluindo Há, porém, moléculas especiais que originam isômeros. Esses podem apresentar, além de comportamentos químicos diferentes, comportamentos fisiológicos inesperados. ISOMERIA ÓPTICA Concluindo É o caso, por exemplo, do medicamento “talidomida” usado para enjôos na gravidez. ISOMERIA ÓPTICA ISOMERIA ÓPTICA ISOMERIA ÓPTICA ISOMERIA ÓPTICA ISOMERIA ÓPTICA Porque não foram realizados testes suficientes em relação a um dos isômeros, muitas crianças cujas as mães utilizaram-no nasceram sem dedos das mãos ou pés. ISOMERIA ÓPTICA Hoje em dia são exigidos testes mais rigorosos antes de um medicamento novo ser lançado no mercado. ISOMERIA FIM!
Download