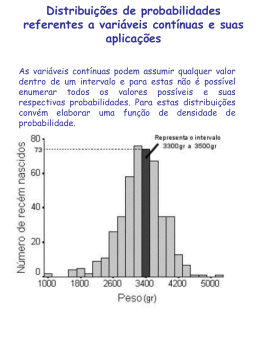
Monografia apresentada ao Supervisor do Programa de Residência Médica da Secretaria de Estado de Saúde do Distrito Federal, como requisito parcial para obtenção do título de especialista em Pediatria www.paulomargotto.com.br 3/11/2009 Hospital Regional da Asa Sul/SES/DF Causas da Baixa Estatura Alterações primárias do crescimento Osteocondrodisplasias Alterações cromossômicas Restrição do crescimento intra-uterino (RCIU) Alterações secundárias do crescimento Desnutrição Psicossocial Doenças crônicas Gastrointestinais Renais Cardíacas Respiratórias Hematológicas Metabólicas Endócrinas Baixa Estatura Idiopática Williams, 11th Edition Baixa Estatura Idiopática Definição Epidemiologia 60 - 80 % das crianças com BE Mais encontrada em meninos que em meninas Procura por auxílio médico depende da classe social • Wit, J.M., GH & IGF Res, 2008 •Savage MO, Nature Clin Pract 2009:5(3):148-9 Baixa Estatura Idiopática Subclassificação Baixa Estatura Familiar Baixa Estatura Não-Familiar Retardo Constitucional do Crescimento e Puberdade Wit, J.M., GH & IGF Res, 2008 Longui CA, Arq Bras Endocrinol Metab 2008: 52(5):750-6 Baixa Estatura Idiopática Subclassificação Hormônio de crescimento (GH): secreção, sensibilidade, combinações de fatores genéticos que alteram diretamente a biologia da placa de crescimento Fator de Crescimento (IGF-1): deficiências primária, secundária, resistência Wit, J.M., GH & IGF Res, 2008 Longui CA, Arq Bras Endocrinol Metab 2008: 52(5):750-6 Base Molecular Deficiência primária do IGF-1 Doenças moleculares Doenças adquiridas Deficiência secundária do IGF-1 Disfunções hipotalâmicas, hipofisárias, deleção do gene do GH ou mutações inativadoras do gene do GH 25 % dos pacientes com BEI apresentam deficiência primária de IGF-1 • Rosenfeld, JCEM, 2004 GH & IGF Res, 2005 Diagnóstico História clínica Dados sobre gestação Início da puberdade Doenças, traumas, operações Uso de medicações Alimentação História familiar Estatura do pais, puberdade dos pais Wit, J.M., GH & IGF Res, 2008 Diagnóstico Exame físico Antropometria Estadiamento puberal Dismorfismos Reflexos Pressão Arterial Gordura abdominal Distensão abdominal Sinais de negligência Wit, J.M., GH & IGF Res, 2008 Diagnóstico Laboratório Doença celíaca Síndrome de Turner Hipotireoidismo Síndrome de Cushing Deficiência/resistência ao GH Anemia Doença inflamatória crônica Wit, J.M., GH & IGF Res, 2008 Diagnóstico Laboratório Hemograma VHS Função hepática e renal Metabolismo ósseo Urina TSH, T4 livre IGF-1 IGFBP3 (menores de 3 anos) Wit, J.M., GH & IGF Res, 2008 Diagnóstico Laboratório GH Testes: insulina, clonidina, arginina, L-dopa e propanolol, de exercício Não há consenso na utilização de “priming” Wit, J.M., GH & IGF Res, 2008 Diagnóstico Testes genéticos Cariótipo SHOX 2,5% das crianças com BEI apresenta mutação ou deleção heterozigótica do SHOX Alteração do SHOX é recente indicação de terapia com GH Wit, J.M., GH & IGF Res, 2008 Cohen P., J Clin Endocrinol Metab, 2008 Avaliação por Imagem Idade óssea Ressonância Nuclear Magnética Wit, J.M., GH & IGF Res, 2008 Consequências Psicossociais BE pode ser fator de risco para imaturidade social, infantilização e baixa auto-estima Difícil avaliação e variabilidade de achados nos estudos Recomenda-se avaliar os 3 níveis Exposição a estressores Adaptação aos estressores Desenvolvimento de patologia Wit J. M. Hormone and IGF Research 18(2008) 111-135 Cohen P., J Clin Endocrinol Metab, 2008 Tratamento Análago de GnRH Inibidores da aromatase Esteróides anabolizantes IGF-1 Aconselhamento psicológico Wit, J.M., GH & IGF Res, 2008 Tratamento GH IRC, Síndromes de Turner e Prader-Willi, PIG, deficiência de GH BEI Dose: 0,05-0,066mg/kg/dia, 7 dias por semana Wit, J.M., GH & IGF Res, 2008 Hintz R. L., GH & IGF Res, 2005 Tratamento GH Resposta no 1 ano de tratamento Velocidade absoluta (cm/ano): 1DP Velocidade expressa pela média do DP Delta SDS: 0.3 a 0.5 SD Bakker B. J Clin Endocrinol Metab. 2008; 93 (2):352-357 Wit, J.M., GH & IGF Res, 2008 Resposta do crescimento após 1 ano de tratamento com GH, em doses diárias, expressa em velocidade de crescimento (ordenada) e idade ao início do tratamento (abscissa) em meninas (E) e meninos (F) pré-púberes. Height velocity Targets from the National Cooperative Growth Study for the First-Year Growth Hormone Responses in Short Children.pag.355.22 Tratamento GH Resultados Idade, estágio puberal, grau de BE Ganho de 3,5 a 7,5 cm com tratamento por 4 a 7 anos Respostas variáveis Melhor resposta: mais jovens mais pesadas maiores doses menor estatura em relação à estatura alvo no início do tratamento Wit, J.M., GH & IGF Res, 2008 Acompanhamento Exame Idade físico óssea IGF-1 T4 livre e TSH Glicemia e insulina séricas Wit, J.M., GH & IGF Res, 2008 GH Possíveis efeitos colaterais Deslizamento de cabeça de fêmur 0,04% Alteração do metabolismo da glicose 0,07% Cefaléia Alterações visuais Náusea, vômito Edema Artralgia, mialgia Parestesia Produção de anticorpos Hipotireoidismo Reações locais Wit J. M. Hormone and IGF Research, 2008 Bryant J., The Cochrane Library, 2009 GH Custo U$ 40/ mg de GH U$ 27,200 a U$ 54,400 por cm de estatura ganho No Brasil, R$ 1.100,00/kg/ano de tratamento Freemark M. EditorialJ Clin. Endocrinol. Metab. 2004 GH Aspectos éticos Interesse Riscos, da criança benefícios, custo, terapias alternativas Objetivos do tratamento: alcançar estatura adulta normal e estatura normal durante a infância Wit, J.M., GH & IGF Res, 2008 Cohen P., J Clin Endocrinol Metab, 2008 Objetivos Definir e classificar BE Avaliar uso de GH em pacientes com BEI Revisão da literatura sobre BEI Avaliar: velocidade de crescimento no primeiro ano de tratamento com GH, estatura inicial e após 1 ano de tratamento, IMC no início do tratamento, peso ao nascer, estatura-alvo familiar dos pacientes Pacientes e Métodos www.pubmed.com Pacientes são de clínica privada, fazem parte de estudo mulitcêntrico internacional, que reúne 13 pesquisadores brasileiros. O estudo e investigadores foram aprovados pelo Comitê de Ética da Santa Casa de Misericódia de São Paulo. Todos os pacientes assinaram o termo de consentimento livre e esclarecido Termo de Consentimento Livre e Esclarecido Prezados Pais ( ou representantes legais), Com o objetivo de aumentar o conhecimento médico sobre o tratamento da deficiência de crescimento em crianças, vários bancos de dados foram desenvovidos para armazenar e analisar essa informalções. O KIGS é um banco de dados internacionalmente existe há 18 anos e á aberto a crianças com deficiência de crescimento que receberam prescrição com Genotropin®, o hormônio de crescimento produzido por laboratórios Pfizer. Os pacientes são acompanhados, sempre que possível, até a altura final na idade adulta. Esse banco de dados é mantido pela Pfizer, na Suécia, e mais de 2000 médicos em mais de 40 países estão envolvidos na construção deste banco de dados. Não há nenhum custo para o paciente e nenhuma indenização é dada aos pacientes durante a coleta desses dados. Dados do prontuário médico sobre o crescimento da criança, doenças e outros tratamentos durante o período de tratamento com Genotropin® são passados para formulários especiais, pelo próprio médico da criança ou por seu auxiliar. Esses formulários são enviados à central do KIGS. Cada formulário contém um código, ao invés do nome da criança, e os dados colhidos estão vinculados apenas a esse código. Assim, o nome da criança nunca é mencionado nesses formulários, garantindo desta forma, a total confidencialidade das informações relativas à criança. Caso necessário, os dados também podem ser avaliados por representantes das Autoridades de Saúde, Conselho de Revisão Intitucional, Comitês de Ética e Pesquisa ou pela Pfizer em conjunto com os monitores e o próprio médico. Os principais dados coletados são sobre a eficiência e a segurança do tratamento com o Genotropin® e os resultados das análises realizadas com esses dados são publicados uma ou mais vezes por ano. Os resultados nunca estarão ligados à identidade do paciente. Relatórios a respeito da evolução do crescimento de cada criança participante do KIGS são enviados ao médico da criança toda vez que novos dados do paciente são registrados na base de dados. Em pacientes do sexo feminino, a ocorrência de gravidez durante a participação no KIGS, deve ser prontamente informada ao médico envolvido no KIGS. A participação no KIGS é voluntária, O tratamento médico não é influenciado pela decisão de participar. Uma criança participante no KIGS sempre tem o direito de solicitar os dados relativos a ela que tenham sido registrados no banco de dados no KIGS, a qualquer momento, sem prejuízo a continuidade de seu tratameno. Se você tiver qualquer dúvida a respeito do KIGS, o Dr. ----------------------------------------------------ficará à sua disposição para reponder, através do telefone-fax----------------- ou e-mail----------------------. Portanto, após ler as explicações acima e retiradas as dúvidas que porventura ainda permaneceram, assine o termo abaixo descrito: “Eu concordo em permitir que o paciente (criança) ------------------------------ participe do KIGS. Eu entendo que a participação neste banco de dados internacional é voluntária e que eu tenho o direito de retirar a criança do mesmo a qualquer momento. Eu li as informações sobre o KIGS e todas as minhas dúvidas foram respondidas. Eu concordo quie os dados para este banco de dados internacional, sem mencionar o nome da criança, podem ser enviados para avaliação, armazenamento e processamento eletrônico. Entendo quje receberei uma cópia deste formulário de consentimento, o qual eu assinei e das informações dos consentimento livre e esclarecido. Eu fui informado a respeito e permito que os registros da criança sejam também avaliados pelos representantes da Pfizer para fins de monitorização e auditoria, bem como pelas Autoridades de Saúde-Regulatórias” Nome: ----------------------------------------------------------------------Pai ou respresentante legal Assinatura: ---------------------------------------------------Data:-----------------------------------Pai ou representante legal Declaração do administrados do Termo de consentimento Livre e Esclarecido “Confirmo que o paciente e seu pai, mãe ou representante legal foram informados sobre a natureza, o significado e as consequências deste banco de dados. As informações para os pais e o paciente foram discutidas e entregues com o Termo de Consentimento Livre e Esclarecido”. Nome: ---------------------------------------------------------------------------------------(Administrador do Termo de Consentimento Livre e Esclarecido) Assinatura: Data: Pacientes e Métodos Inclusão: diagnóstico de BEI e uso de GH há, no mínimo, 1 ano Exclusão: pacientes que não se enquadram no diagnóstico de BEI e/ou que fazem uso de GH por menos que 1 ano Pacientes incluídos no estudo Peso no Crianças 1 2 3 4 5 6 7 8 9 10 11 12 13 Sexo masculino feminino feminino masculino masculino masculino masculino masculino feminino masculino masculino masculino masculino Estatura - Idade no início Peso no início Estatura no início nascimento alvo familiar do tratamento do tratamento Estatura ao SDS da do tratamento final do 1º ano estatura SDS da estatura ao (g) (cm) (anos) (kg) (cm) (cm) inicial final do 1º ano 2.800 3.000 2.850 2.300 3.430 2.920 3.100 3.530 1.900 2.850 3.100 3.335 164,0 149,5 156,3 162,5 170,5 163,5 179,0 160,0 172,5 163,5 177,0 168,0 9,2 9,5 14,3 8,2 5,9 7,9 8,6 12,6 12,5 6,3 8,8 15,2 9,7 20,9 25,3 36,3 18,5 17,7 22,2 20,5 32,0 32,5 21,5 21,8 39,5 21,6 119,0 122,5 148,0 112,5 105,0 119,5 122,0 138,5 138,2 106,5 120,0 154,5 125,0 123,0 130,5 152,0 122,5 113,5 128,5 130,0 147,0 147,0 115,5 127,5 161,0 132,5 -2,29 -1,83 -1,98 -2,57 -1,74 -1,05 -1,23 -1,62 -1,95 -1,88 -1,75 -1,82 -1,67 -2,37 -1,45 -1,63 -1,76 -1,08 -0,33 -0,68 -1,22 -1,61 -1,35 -1,26 -1,72 -1,11 Distribuição por gênero feminino 23% masculino 77% Idade no início do tratamento número de crianças 5 4 4 3 3 2 2 2 2 11 - 13 13 - 16 1 0 5- 7 7- 9 9 - 11 idade (anos) Média de crescimento no 1º ano (cm/ano) 8,0 7,85 crescimento (cm) 7,8 7,64 7,6 7,4 7,2 7,0 6,93 6,8 6,6 6,4 meninas todos meninos Estatura em desvio-padrão no início e no final do 1º ano de tratamento desvio inicial desvio final 0,0 desvio-padrão -0,5 -1,0 -1,5 -2,0 -2,5 meninas meninos -3,0 3 9 2 4 1 10 12 crianças 11 5 13 8 7 6 Estatura absoluta no início e no final do 1º ano de tratamento cm estatura inicial meninos estatura inicial meninas ganho 170 160 150 140 130 120 110 100 90 80 70 60 5 10 4 1 6 11 7 crianças 2 13 9 8 3 12 estatura (cm) Estatura absoluta inicial dos pacientes do sexo masculino nos percentis estatura x idade 195 185 175 165 155 145 135 125 115 105 95 97 95 90 75 50 25 10 5 3 85 75 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 idade (anos) Fonte: CDC Estatura absoluta inicial dos pacientes do sexo feminino nos percentis estatura x idade 180 97 95 90 75 50 25 10 5 3 170 160 estatura (cm) 150 140 130 120 110 100 90 80 70 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 idade (anos) Fonte: CDC IMC IMC dos pacientes masculinos no início do tratamento 33 32 31 30 29 28 27 26 25 24 23 22 21 20 19 18 17 16 15 14 13 97 95 90 85 75 50 25 10 5 3 2 Fonte: CDC 3 4 5 6 7 8 9 10 11 12 13 14 idade (anos) 15 16 17 18 19 20 IMC IMC dos pacientes do sexo feminino no início do tratamento nos percentis IMC x idade 36 35 34 33 32 31 30 29 28 27 26 25 24 23 22 21 20 19 18 17 16 15 14 13 97 95 90 85 75 50 25 10 5 3 2 Fonte: CDC 3 4 5 6 7 8 9 10 11 12 13 14 idade (anos) 15 16 17 18 19 20 Velocidade de crescimento no 1º ano de tratamento x IMC no início do tratamento meninos meninas 19 18 IMC 17 16 15 14 13 3 4 5 6 7 8 velocidade de crescimento (cm/ano) 9 10 Distribuição do peso ao nascer* 6 Número de crianças 5 5 4 4 3 2 1 1 1,5 a 2,0 2,0 a 2,5 1 1 0 2,5 a 3,0 peso (kg) * Foram considerados 12 dos 13 pacientes do estudo. 3,0 a 3,5 3,5 a 4,0 Peso médio ao nascer * 3.127 3.150 3.100 3.050 peso (g) 3.000 2.926 2.950 2.900 2.860 2.850 2.800 2.750 2.700 meninos * Foram considerados 12 dos 13 pacientes do estudo. todos meninas Distribuição da estatura-alvo familiar* 7 Número de crianças 6 6 5 4 4 3 2 1 1 até 150 150 a 160 1 0 160 a 170 estatura (cm) * Foram considerados 12 dos 13 pacientes do estudo. 170 a 180 Estatura-alvo familiar média* 168,9 170 165,5 estatura (cm) 165 160 155,3 155 150 145 meninas * Foram considerados 12 dos 13 pacientes do estudo. todos meninos Conclusão BE apresenta várias etiologias Pacientes com BEI formam grupo heterogênio e são a maioria das crianças com BE Tratamento é eficaz, longo e de alto custo Conclusão Decisão terapêutica deve levar em consideração os aspectos: éticos, psicossociais, financeiros; critérios clínicos e laboratoriais Base molecular da BEI constitui campo promissor e um dos grandes desafios nessa área da medicina capaz de proporcionar melhor manejo dos pacientes com BEI
Download