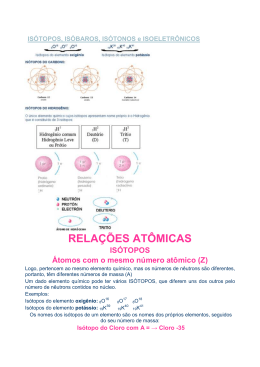
Ao serem examinados, podemos encontrar conjuntos de átomos com um ou outro número igual. Átomos de um mesmo elemento químico, portanto de mesmo número atômico (mesmo Z), podem ter diferentes números de nêutrons no núcleo. Por essa razão, seus números de massa (A) serão diferentes. É o que acontece, por exemplo, com o elemento químico hidrogênio, que possui três tipos de átomos, cada qual com um número de massa diferente: 1 H 1 2 H 1 3 H 1 1 1H O hidrogênio é o único átomo cujo número de nêutrons é inferior ao número de prótons. 𝟏 𝟏𝐇 (prótio, hidrogênio comum) 𝟐 𝟏𝐇 (deutério, hidrogênio pesado) 𝟑 𝟏𝐇 (trítio, hidrogênio super pesado) Neste exemplo, todos os isótopos do elemento hidrogênio possuem o mesmo número atômico (1), mas se diferem pelo número de massa (1, 2 e 3). É o carbono, conforme mostrado na figura abaixo: Carbono 14 Carbono 13 Carbono 12 Instável estável estável Próton Nêutron (radioativo) Elétron ● A reunião de isótopos de um mesmo elemento químico chama-se mistura isotópica e o fenômeno isotopia. ● O termo isótopo (do grego isso, ‘mesmo’, e topos, ‘lugar’) significa mesmo lugar, aludindo ao fato de que os isótopos ocupam lugar idêntico no sistema periódico. ● Átomos de elementos diferentes, portanto de diferentes números atômicos, possuírem igual soma de prótons e de nêutrons (mesmo A). ● A esse fenômeno chamamos de isobaria e aos átomos correspondentes, de isóbaros. ● Os elementos argônio, potássio e cálcio têm, cada um deles, um isótopo de mesmo número de massa (40). Esses átomos de mesmo A são isóbaros: 40 40 40 18Ar 19K 20Ca ● O termo isóbaro (do grego iso, ‘mesmo’, e baros, ‘peso’) quer dizer mesma massa (peso). ● Átomos de elementos químicos diferentes possuam o mesmo número de nêutrons. A esse fenômeno chamamos de isotonia e aos elementos envolvidos, de isótonos. Tomemos como exemplo o boro e o carbono, ambos, no caso, com seis nêutrons: 11 C12 B 5 6 ● O termo isótono (do grego iso, ‘mesmo’, e tonos, ‘força’) significa mesma força, alusão ao fato de que os nêutrons são responsáveis pelas forças de coesão do núcleo. ● Quando as espécies apresentam o mesmo número de elétrons, elas são isoeletrônicas, e tem estruturas eletrônicas semelhantes. ● Apresentam ainda as mesmas estruturas de Lewis e, portanto, igual número de elétrons de valência. ● Visto que os gases nobres são estáveis, as espécies isoeletrônicas em relação aos mesmos também devem ser relativamente estáveis. ● A seguir estão alguns exemplos de átomos e íons isoeletrônicos que apresentam camada de valência completa: ● Com 2 elétrons → 2He; 3Li+; 4Be2+; 1HCom 10 elétrons → 10Ne; 11Na+; 12Mg2+; 13Al3+ Isóbaros, isótonos e isótopos 1) O deutério é um: a) Isóbaro de hidrogênio. b) Isótopo de hidrogênio. c) Radio isótono do hidrogênio. d) Isômero do hidrogênio. e) Alótropo do hidrogênio. 2) (ITA) São definidas quatro espécies de átomos neutros em termos de partículas nucleares: Átomo I – possui 18 prótons e 21 nêutrons Átomo II – possui 19 prótons e 20 nêutrons Átomo III – possui 20 prótons e 19 nêutrons Átomo IV – possui 20 prótons e 20 nêutrons Pode-se concluir que: a) os átomos III e IV são isóbaros; b) os átomos II e III são isoeletrônicos; c) os átomos II e IV são isótopos; d) os átomos I e II pertencem ao mesmo período da Classificação Periódica; e) os átomos II e III possuem o mesmo número de massa.
Download