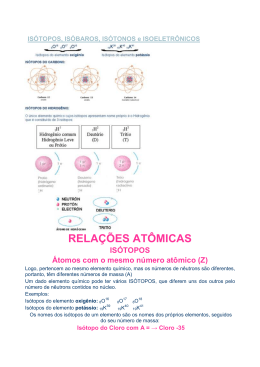
Isótopos, Isóbaros e Isótonos Professora: Maria do Socorro Araújo Universidade de Cuiabá São átomos de um elemento químico cujos núcleos têm o mesmo número atômico, ou seja, os isótopos de um certo elemento contêm o mesmo número de prótons, mas que contém diferentes números de massas atômicas. São elementos diferentes, portanto, com números atômicos diferentes, mas que possuem o mesmo número de massa. O termo isóbaro vem do grego iso = mesmo e baros = peso. São elementos diferentes (números atômicos diferentes), de massas diferentes, mas mesmo número de nêutrons. O termo isótono vem do grego iso = mesmo e tonos = força (alusão ao fato de que os nêutrons são responsáveis pelas forças de coesão do núcleo) Os isótopos são cada vez mais utilizados em diversos ramos como a Medicina, a Farmácia, a Agricultura, Engenharia, etc. O iodo 131 se emprega para avaliar, por exemplo, a atividade da glândula tireóide, onde o isótopo se acumula. Usa-se o fósforo 32 para identificar tumores malignos, porque as células cancerosas tendem a acumular fosfatos em quantidade maior do que as células normais. Isótopos radioativos como o cobalto 60 e o césio 137 são usados no tratamento do câncer, para minimizar os prejuízos causados a células vizinhas aos tumores. • Geração de energia a partir da fissão nuclear do urânio, nos reatores nucleares. • Medir a espessura de lâminas plásticas e metálicas e para induzir mutações genéticas em plantas, com a finalidade de obter espécies vegetais mais resistentes. • Pesquisa geológica e arqueológica fez sensíveis progressos com a utilização de técnicas de datação radiométrica, principalmente com o carbono 14, que ajudou a reconstituir a seqüência de eventos préhistóricos e históricos e a determinar a idade de fósseis e restos arqueológicos. ATIVIDADES 1. Dados os átomos imaginários, calcule o nº de nêutrons (N=A-Z) e determine quais são: ISÓTOPOS = ISÓTONOS = ISÓBAROS = 2. Dados os átomos imaginários, calcule o nº de nêutrons (N=A-Z) e determine quais são: ISÓTOPOS = ISÓTONOS = ISÓBAROS =
Baixar