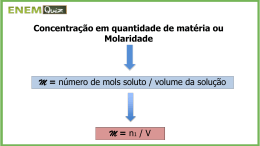
Please purchase PDFcamp Printer on http://www.verypdf.com/ to remove this watermark. Mol( n1=numer odemol s) m1 n= 1 M1 m1= massa do soluto (g) M1= Massa molar do soluto (g/mol) Mol ar i dade\Concent r açãoMol ar\Concent r açãodequant i dadedemat ér i a\M É a quantidade, em mols, do soluto existente em 1 litro de solução n m m1= massa do soluto (g) M= 1 M= 1 M1= massa molar do soluto (g/mol) V M1.V V= Volume (L) Unidade: mol/L Se o volume for dado em (ml) converte-se em (Litros) L ---------- ml 1L 1000 ml XL y ml (valor dado na questão) 1.y = X.1000 1. y =X 1000 X=....Litros Massa Molar (g/mol) É a soma das massas atomicas da substância dada na questão Exemplo Ácido Nitrico HNO3 H= 1 N= 14 O= 16 x 3 = 48 g/mol Cuidado: na formula dada possui 3 oxigênios portanto é preciso multiplicar por três a massa atomica do oxigênio Cloreto de zinco Na tabela dos íons tem os elementos com suas cargas Zn Zn +2 +2 Cl Cl - - ZnCl2 Zn= 65 Cl= 35,5 X 2 =71 136 g/mol Porque o Zinco precisa perder 2 eletróns para se estabilizar e cada Cloro precisa 1 eletróns.
Baixar