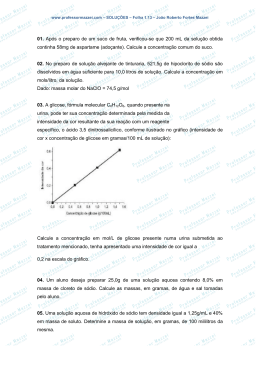
Preparação de uma solução aquosa a partir de um soluto sólido Preparação de uma solução aquosa de Tiossulfato de sódio Preparar experimentalmente 50 cm3 uma solução de tiossulfato de sódio, com a concentração de 0,030mol/dm3 a partir do soluto sólido (Na2S2O3. 5H2O). Solvente: água Soluto: tiossulfato de sódio Concentração: 0,030mol/dm3 Volume: 50 ml=50 cm3 Massa Molar (Na2S2O3. 5H2O)=248,1696g/mol Método de resolução 1 (Didáctico - Raciocínio proporcional) 1000 ml = 1L 50 ml B A 0,030 mol/ L 0,030 mol/ L Massa de 0,030 mol de soluto = 0,030 ×218,1696 = 7,445 g Razão entre os volumes A e B: 1000 50 = 20 Massa do soluto a dissolver para preparar 50ml = 1 20 ×7,44= 0,372 g Para preparar a solução A dissolvemos 0,372 g de tiossulfato de sódio em 50 ml de água obtendo uma solução com a concentração de 0,030 mol/ L. Isabel Marques, aluna nº33082 do MEFQ Page 1 Método de resolução 2 (uso de expressões analíticas) 𝑛𝑛 C= V=50 × 10-3 e C=0,03mol/L 𝑣𝑣 Então 0,030 = 𝑀𝑀 = 𝑚𝑚 𝑛𝑛 𝑛𝑛 50 × 10−3 ⇔ 𝑛𝑛 = 0,0015 = 1,5 × 10-3 𝑚𝑚𝑚𝑚𝑚𝑚 ⇔ 𝑚𝑚 = 1,5 × 10 − 3 × 248,169 = 0,372 𝑔𝑔 de soluto 0,372g é a quantidade de soluto( Tiossulfato de sódio) que é necessário pesar para dissolver em 50 ml de água obtendo-se assim uma solução aquosa de concentração 0,030mol/L tal como era pedido. Isabel Marques, aluna nº33082 do MEFQ Page 2
Baixar