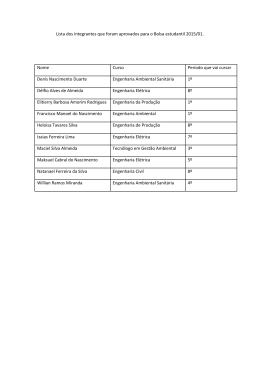
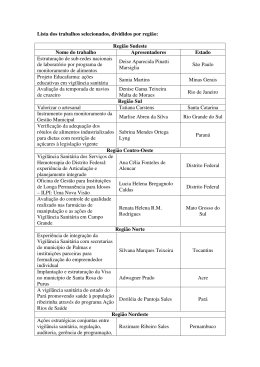
1 VIGILÂNCIA PÓS USO/COMERCIALIZAÇÃO VIGIPÓS Sua importância para a prática de vigilância sanitária no país Maria Eugênia Cury NUVIG/ANVISA 2 VIGIPÓS - Conceitos • Sistema de avaliação e alerta, organizado para coletar e analisar as informações sobre as queixas técnicas ou os eventos adversos quando do uso de produtos sob vigilância sanitária. • Incluem-se o monitoramento: medicamentos, produtos para a saúde, equipamentos, ... e os de origem humana (sangue, tecidos, células e órgãos). • Utilização de métodos epidemiológicos para análise dos dados. VIGIPÓS - Paradigma • “A construção social de uma nova prática sanitária, a da vigilância da saúde (...). • (...) A vigilância deverá articular novas estratégias de intervenção individual e coletiva e atuar sobre os nós críticos de um problema de saúde, com base em um saber interdisciplinar e um fazer intersetorial.” (Mendes, 1996). Vigipós - Amparo Legal PDVISA “Consolidação e ampliação, em âmbito nacional, da estratégia de vigilância e monitoramento de eventos adversos e queixas técnicas relacionadas ao uso de produtos e serviços de saúde” (Brasil, 2006). Lei nº 9.782, de 26 de janeiro de 1999. Define o SNVS e cria a ANVISA Art. 6º A agência terá por finalidade institucional promover a proteção da saúde da população, por intermédio do controle sanitário da produção e da comercialização de produtos e serviços submetidos à vigilância sanitária.... Lei nº 9.782, de 26/01/99 Art. 8o ... regulamentar, controlar e fiscalizar … § 1º … bens e produtos submetidos ao controle e fiscalização sanitária … • • • • • • • • • Medicamentos de uso humano Insumos, conjuntos reagentes Equipamentos Saneantes Cosméticos Sangue Órgãos, Tecidos humanos e veterinários Alimentos Outros produtos e serviços de interesse para o controle de riscos à saúde da população Decreto 3029 de 17 de abril de 1999 Aprova o Regulamento da Agência Nacional de Vigilância Sanitária, e dá outras providências. Competências Art. 3º....XVIII - manter sistema de informação contínuo e permanente para integrar suas atividades com as demais ações de saúde, com prioridade para as ações de vigilância epidemiológica e assistência ambulatorial e hospitalar; ... Vigipós – Base Teórica • Dados do sistema de informação sobre mortalidade (SIM), do ministério da saúde, revelaram que no período de1996 a 2003, ocorreram aproximadamente 6.000 óbitos devidos a problemas com medicamentos. • Em 2005, foram registradas no sistema de informação hospitalar do sistema único de saúde (SIH/SUS) cerca de 21.500 internações (59 internações/dia) devidas a problemas associados ao uso de medicamentos, totalizando o custo aproximado de R$ 8.300.000,00. Vigipós – Base Teórica • As reações adversas a medicamentos (RAM) podem reduzir a qualidade de vida do paciente e constituir freqüente causa de abandono da medicação, mas sua prevenção é possível em até 28% dos casos (bates et al., 1995). • Além de representar um problema de saúde, as RAM produzem grande impacto econômico. Dados da literatura demonstram que entre 5 e 9% dos gastos hospitalares podem estar relacionados a reações adversas a medicamentos (Moore et al., 1998). VIGIPÓS- IMPORTANCIA SANITÁRIA • As informações provenientes dos centros possibilitam nortear a adoção de políticas públicas na regulação de mercado: ▫ ▫ ▫ ▫ ▫ ▫ Reformulação de produtos. Troca de embalagem. Recalls. Retirada do mercado. Fundamentação de ações regulatórias. Além de contribuir na vigilância póscomercialização de novos produtos. ESTRATÉGIAS • Rede de Hospitais Sentinela • Farmácias Notificadoras • Criação de estrutura na ANVISA – NUVIG ▫ Tecnovigilância ▫ Farmacovigilância ▫ Hemovigilância • Sistema de informação – NOTIVISA • Perspectivas de uma Rede Notificadora RESOLUÇÃO - RDC Nº 4, DE 10 DE FEVEREIRO DE 2009 • Dispõe sobre as normas de farmacovigilância para os detentores de registro de medicamentos de uso humano. • § 3º. Caso existam indícios suficientes ou comprovação de desvio de qualidade que representem risco, agravo ou conseqüência danosa à saúde, os detentores de registro de medicamentos devem proceder de acordo com a legislação vigente para o desvio da qualidade de medicamentos. • § 4º. Os detentores de registro de medicamentos são responsáveis por registrar, acompanhar e avaliar os casos de exposição de pacientes grávidas a medicamentos, quando do seu conhecimento. • § 5º. Os eventos adversos relacionados às pacientes grávidas devem ser notificados nas formas e nos prazos estabelecidas nesta Resolução. • Art. 3º. Os detentores de registro de medicamentos devemdesenvolver ações de farmacovigilância no Brasil. Formulação de RDC de Tecnovigilância • CP – NOTIFICAÇÃO DE EA E QT PARA DETENTORES DO REGISTRO DE PRODUTOS PARA A SAÚDE FASE DE CONSOLIDAÇÃO NA ANVISA PORTARIA No- 1.660, DE 22 DE JULHO DE 2009 - MS • Institui o Sistema de Notificação e Investigação em Vigilância Sanitária VIGIPOS, no âmbito do Sistema Nacional de Vigilância Sanitária, como parte integrante do Sistema Único de Saúde - SUS. • Considerando a necessidade de promover a identificação precoce de problemas relacionados com os serviços e produtos sob vigilância sanitária, comercializados ou não, a fim de eliminar ou minimizar os riscos decorrentes do uso destes, a teor do que consta no § 1º do art. 6º da Lei No8.080, de 19 de setembro de 1990; • Considerando a responsabilidade da União na gestão do SUS em proceder à investigação complementar ou conjunta com os demais gestores do SUS em situação de risco sanitário, nos termos da Portaria No- 399, de 22 de fevereiro de 2006, que divulgou o Pacto pela Saúde; • Considerando a importância do trabalho integrado das vigilâncias sanitária, epidemiológica e ambiental nas três esferas de governo, visando ao impacto positivo no perfil epidemiológico da população, PORTARIA No- 1.660, DE 22 DE JULHO DE 2009 - MS • Considerando a importância do trabalho integrado das vigilâncias sanitária, epidemiológica e ambiental nas três esferas de governo, visando ao impacto positivo no perfil epidemiológico da população • Art. 1º Instituir o Sistema de Notificação e Investigação em Vigilância Sanitária, no âmbito do Sistema Nacional de Vigilância Sanitária, para o monitoramento, análise e investigação dos eventos adversos e queixas técnicas relacionados aos serviços e produtos sob vigilância sanitária na fase de pós-comercialização/pós-uso.
Download