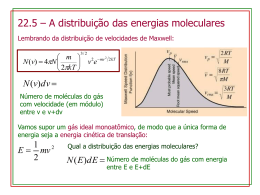
18/08/2014 Disciplina de Físico Química I - Diagrama de fases- Liquefação de gases. Prof. Vanderlei Inácio de Paula – contato: [email protected] Gás Real -Fator de Compressibilidade Z Z > 1: pVm RT Menor compressibilidade Forças repulsivas Z < 1: Maior compressibilidade Forças atrativas 1 18/08/2014 Fator de Compressibilidade - Exercícios Z pVm RT Um gás a 350K e 12 atm tem o volume molar 12% maior do que o calculado pela lei dos gases perfeitos. Calcular : a) o fator de compressibilidade nestas condições; b) o volume molar do gás; c) que forças são dominantes no gás? Atrativas ou repulsivas? Um gás a 350K e 12 atm tem o volume molar 12% maior do que o calculado pela lei dos gases perfeitos. Calcular a) o fator de compressibilidade nestas condições; b) o volume molar do gás; c) que forças são dominantes no gás? 2 18/08/2014 Fator de Compressibilidade - Exercícios Z pVm RT A 300K e 20 atm, o fator de compressibilidade de um gás é 0,86. Calcule o volume ocupados por 8,2 mmol do gás nessas condições. A 300K e 20 atm, o fator de compressibilidade de um gás é 0,86. Calcule o volume ocupados por 8,2 mmol do gás nessas condições. Z pVm RT 3 18/08/2014 Equação de Van der Waals p RT a 2 Vm b Vm Equação de Van der Waals – exercícios p RT a 2 Vm b Vm Calcular a pressão exercida por 1,0 mol de H2S, confinado em cada condição seguintes, na hipótese de (a) comportamento de gás perfeito e (b) comportamento de gás de van der Waals; (i) a 273,15K em 22,414L; (ii) 500k em 150 cm3. 4 18/08/2014 Calcular a pressão exercida por 1,0 mol de H2S, confinado em cada condição seguintes, na hipótese de (a) comportamento de gás perfeito e (b) comportamento de gás de van der Waals; (i) a 273,15K em 22,414L; (ii) 500k em 150 cm3. Calcular a pressão exercida por 1,0 mol de H2S, confinado em cada condição seguintes, na hipótese de (a) comportamento de gás perfeito e (b) comportamento de gás de van der Waals; (i) a 273,15K em 22,414L; (ii) 500k em 150 cm3. 5 18/08/2014 Calcular a pressão exercida por 1,0 mol de H2S, confinado em cada condição seguintes, na hipótese de (a) comportamento de gás perfeito e (b) comportamento de gás de van der Waals; (i) a 273,15K em 22,414L; (ii) 500k em 150 cm3. Equação de Van der Waals – exercícios p RT a 2 Vm b Vm Os cilindros de gás comprimido são cheios, nos casos comuns, até a pressão de 200 bar. Qual seria o volume molar do oxigênio, nesta pressão e a 25°C, com base na equação dos gases perfeitos e na equação de van der Waals? Para oxigênio considere a= 1,364 dm6 atm mol-2 e b = 3,19 x 10-2 dm3 mol-1. 6 18/08/2014 Os cilindros de gás comprimido são cheios, nos casos comuns, até a pressão de 200 bar. Qual seria o volume molar do oxigênio, nesta pressão e a 25°C, com base na equação dos gases perfeitos e na equação de van der Waals? Para oxigênio considere a= 1,364 dm6 atm mol-2 e b = 3,19 x 10-2 dm3 mol-1. p 𝑉𝑚° = 𝑅𝑇 0,08314 𝑥 298, 15 = = 0,124 𝐿/𝑚𝑜𝑙 𝑃 200 RT a 2 Vm b Vm Para determinação do volume molar através da equação de van der Waals é necessário reordenar a equação obtendo uma equação cúbica. X p Os cilindros de gás comprimido são cheios, nos casos comuns, até a pressão de 200 bar. Qual seria o volume molar do oxigênio, nesta pressão e a 25°C, com base na equação dos gases perfeitos e na equação de van der Waals? Para oxigênio considere a= 1,364 dm6 atm mol-2 e b = 3,19 x 10-2 dm3 mol-1. Redução de 15% 7 18/08/2014 Derivadas parciais e leis dos gases Um uso importante das equações de estado na termodinâmica é para determinar como uma variável de estado é afetada quando outra variável de estado muda de valor. (a) Definição de inclinação para uma linha reta. A inclinação é a mesma em cada ponto da linha. (b) Uma linha curva também tem uma inclinação, mas ela muda de um ponto para outro. A inclinação da linha em qualquer ponto em particular é determinada pela derivada da equação da linha. Derivadas parciais e leis dos gases Considere a equação de estado da lei dos gases ideais. 8 18/08/2014 Pressão de Vapor É a pressão exercida por um vapor quando este está em equilíbrio termodinâmico com o líquido de origem. Quanto maior for a pressão de vapor, mais volátil será o líquido, e menor será sua temperatura de ebulição. A pressão de vapor é uma propriedade física que depende intimamente da temperatura. Pressão de vapor 9 18/08/2014 Diagrama de Fases Diagrama de Fases As três linhas que dividem essas regiões: • AT, ebulição; • BT, fusão; • CT, sublimação; • o ponto T, simultaneamente, gelo, água líquida e vapor de água, e que por isso é chamado de ponto triplo da água. 10 18/08/2014 O diagrama mostra os estados físicos do CO2 em diferentes pressões e temperaturas. Um método de produção de geloseco (CO2 sólido) envolve: I. compressão isotérmica do CO2(g), inicialmente a 25°C e 1 atm, até passar para o estado líquido; II. rápida descompressão até 1 atm, processo no qual ocorre forte abaixamento de temperatura e aparecimento de CO2 sólido. a) Em I, qual a pressão mínima a que o CO2(g) deve ser submetido para começar a liquefação, a 25°C? b) Em II, qual a temperatura deve atingir ? Em fevereiro de 2014 aconteceram os Jogos Olímpicos de Inverno. A modalidade esportiva curling é um jogo disputado entre duas equipes sobre uma pista de gelo, seu objetivo consiste em fazer com que uma pedra de granito em forma de disco fique o mais próximo de um alvo circular. Vassouras são utilizadas pelas equipes para varrer a superfície do gelo na frente da pedra, de modo a influenciar tanto sua direção como sua velocidade. A intensidade da fricção e a pressão aplicada pelos atletas durante o processo de varredura podem fazer com que a velocidade da pedra mude em até 20% devido à formação de uma película de água líquida entre a pedra e a pista. O gráfico apresenta o diagrama de fases da água. Qual o número da seta que representa corretamente a transformação promovida pela varredura? 11
Download