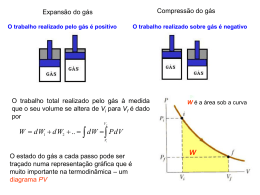
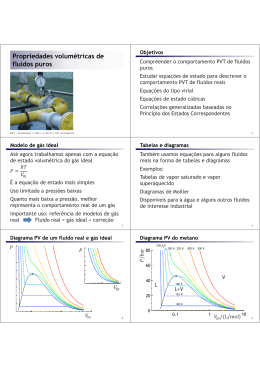
22.5 – A distribuição das energias moleculares Lembrando da distribuição de velocidades de Maxwell: 3/ 2 m 2 mv 2 2kT N (v) 4N ve 2kT N (v)dv Número de moléculas do gás com velocidade (em módulo) entre v e v+dv Vamos supor um gás ideal monoatômico, de modo que a única forma de energia seja a energia cinética de translação: 1 2 E mv 2 Qual a distribuição das energias moleculares? N ( E )dE Número de moléculas do gás com energia entre E e E+dE E N ( E )dE N (v)dv dv N ( E ) N (v ) dE 1 2 mv 2 E dE v 2E m dv 2 1 1 2 E dE m 2 Sabemos que: E v v dv v 2N 1 1 2 E kT N (E) E e 3/ 2 kT Distribuição de Maxwell-Boltzmann Ludwig Boltzmann (1844-1906) Se E >> kT, podemos aproximar: N ( E) e E kT Fator de Boltzmann: Estima a probabilidade relativa de uma molécula ter energia cinética E 2N 1 1 2 E kT N (E) E e 3/ 2 kT Exemplo: gás a temperatura constante no campo gravitacional (quadro-negro) p( y) p0emgy kT p0e gy0 p0 22.7 – As forças intermoleculares Mesmo átomos ou moléculas neutros interagem de forma atrativa a longas distâncias e repulsiva a curtas distâncias Potencial de Lennard-Jones Interação de Van der Waals 22.6 – Equações de estado para os gases reais A equação de estado dos gases ideais é uma aproximação que é válida apenas no limite de baixas densidades Há maneiras de melhorar esta descrição de modo a descrever gases reais 1. Expansão virial: 2 n n pV nRT 1 B2 B3 ... V V Reproduz o comportamento dos gases ideais no limite de baixas densidades 2. Equação de estado de Van der Waals n2 p a 2 V nb nRT V Johannes Diderik van der Waals (1837-1923) n2 p a 2 V nb nRT V pV nRT Podemos interpretar a equação de van der Waals da seguinte forma: Onde definimos uma pressão e um volume efetivos p’ e V’ Volume efetivo: V V nb é menor que o volume medido experimentalmente devido ao volume de exclusão molecular O parâmetro b é o volume excluído por mol n2 p a 2 V nb nRT V pV nRT Pressão efetiva: n2 p p a 2 V é maior que a pressão medida experimentalmente devido à atração entre as moléculas próximo às paredes do recipiente Uso da equação de van der Waals no estudo da transição de fase gás-líquido Isotermas do gás ideal Região de instabilidade (volume aumenta quando a pressão aumenta): sinaliza a transição para a fase líquida Isotermas da equação de van der Waals Questões
Download