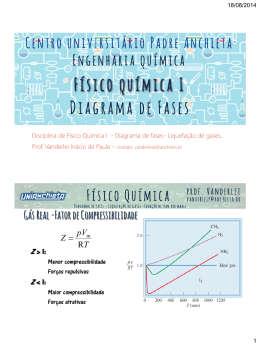
Aula: 03 Temática: Gases Reais A equação de estado que estudamos até agora é aplicável somente aos gases ideais. Para os gases reais esta equação não representa seus comportamentos adequadamente, por isso, estudaremos outras equações. 1. Desvios do comportamento ideal Os gases reais não cumprem exatamente a lei dos gases ideais. Isto fica claro nos desvios que são mais notáveis nas pressões elevadas e temperaturas baixas. As interações intermoleculares são responsáveis por tais diferenças. As forças repulsivas entre as moléculas contribuem para expansões e as atrativas para compressões. Nas pressões baixas, quando a amostra do gás ocupa um volume grande, as moléculas estão afastadas umas das outras. Ocorre uma influência insignificante nas forças intermoleculares e o gás comporta-se como ideal. Nas pressões médias, quando as moléculas não estão tão afastadas, as forças atrativas dominam as repulsivas, tornando o gás mais compressível que o gás ideal. Em altas pressões, quando as moléculas estão extremamente próximas, as forças repulsivas dominam, tornando o gás menos compressível, em virtude da ação que tende a afastar as moléculas. Os gases reais refletem essas propriedades das forças intermoleculares e, para observar os desvios da idealidade de modo mais claro, a relação é exemplificada entre o volume molar observado (Vm) e o volume molar ideal (Vid = RT/p), como uma função de p a uma temperatura constante (ver Indicação de Leitura ao final da unidade). Essa relação é chamada fator compressibilidade, Z. Para os gases ideais Z = 1, em qualquer condição: Z= Vm pVm = Vid RT FÍSICO-QUÍMICA de Vamos fazer uma análise em uma amostra de gás que é comprimida a uma temperatura constante, pela ação de um pistão. Inicialmente, o uso da lei de Boyle promove uma aproximação razoável (enquanto a pressão ainda é baixa). Com o aumento da pressão, os desvios vão ficando maiores. Em certo ponto da compressão é verificado que desaparece qualquer semelhança com o comportamento do gás ideal, pois abruptamente o pistão se desloca sem provocar aumento da pressão. Examinando o conteúdo do recipiente, vê-se a formação de gotas e, portanto, a ocorrência de duas fases. Com a diminuição do volume, a quantidade de líquido aumenta, por causa da condensação do vapor e a pressão não se modifica. Esta pressão na qual o líquido e o vapor estão em equilíbrio é a pressão de vapor, na temperatura da experiência. Equação de Van der Waals Uma equação de estado aproximada foi a proposta de Van der Waals, através de uma equação mais geral, embora menos precisa, válida para todos os gases. Esta proposta foi feita com base em dados experimentais associados a considerações termodinâmicas rigorosas. A equação de Van der Waals é: nRT n p= − a V − nb V 2 Onde a e b são as constantes de Van der Waals. A equação de Van der Waals pode ser escrita em termos do volume molar: p= RT a − 2 Vm − b Vm • Uma das principais características da equação de Van der Waals é o fato de que nas temperaturas elevadas e nos volumes molares grandes, as isotermas de Van der Waals (ver Indicação de Leitura ao final desta Unidade) coincidem com as isotermas do gás perfeito. • Outra característica, é que os líquidos e os gases coexistem quando os efeitos de colisão e de dispersão estão equilibrados. FÍSICO-QUÍMICA Tomando a equação de Van der Waals escrita em termos de Vm e multiplicando tudo por Vm2/p, ela poderá ser recomposta como uma equação do 3° grau, tendo três raízes reais para Vm, em certos valores de pressão e temperatura. RT 2 a ab Vm3 − b − Vm + Vm − =0 p p p Podem, então, as três raízes caírem dentro da região de duas fases ou nos seus limites em uma isoterma de diagrama p-Vm. A região de duas fases diminui gradualmente e se fecha no topo como vista no gráfico. Isso indica que existe uma certa pressão máxima pc e uma certa temperatura máxima Tc na qual o líquido e o vapor podem coexistir. Essa condição de pressão e temperatura é o ponto crítico e o volume correspondente é o volume molar crítico, Vc. À medida que a região de duas fases diminui, as três raízes da equação de Van der Waals se aproximam umas das outras, já que precisam permanecer dentro ou na fronteira desta região. No ponto crítico as três raízes são iguais (Vm’= Vm’’= Vm’’’= Vc). (V m − Vm' )(Vm − Vm'' )(Vm − Vm''' ) = 0 , logo (Vm − Vc )3 Vm3 − 3VcVm2 + 3Vc2Vm − Vc3 = 0 • Uma terceira característica da equação de Van der Waals é o fato de as coordenadas críticas estarem relacionadas com as constantes de Van der Waals. Podemos ver esta relação se escrevermos a equação do 3° grau com pc e Tc. RT a ab Vm3 − b + c Vm2 + Vm − =0 pc pc pc Igualamos os coeficientes desta equação também de 3° grau das raízes iguais (todas = Vc). FÍSICO-QUÍMICA 3Vc = b + RTc pc 3Vc2 = a pc Vc3 = ab pc Resolvemos o conjunto de equações para Vc, pc e Tc e termos de a, b e R Vc = 3b Estas relações pc = podem ser a 27b 2 verificadas Tc = pelo cálculo 8a 27 Rb do fator de compressibilidade no ponto crítico, Zc. Tivemos contato, nesta aula, com os gases reais. Analisamos o desvio do comportamento em relação ao gás ideal e determinamos equações generalizadas. FÍSICO-QUÍMICA
Download