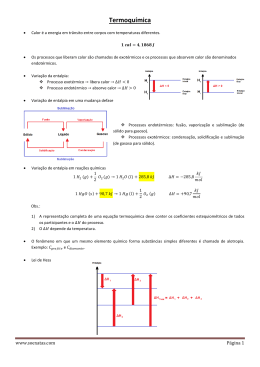
Alunos: Jonas Henrique dos Santos - 18717 Marcos Aurélio F. de A. Costa - 18726 Seminário de Química Instituto de Ciências Exatas Universidade Federal de Itajubá • A Natureza da Energia • A Primeira Lei da Termodinâmica • Entalpia • Entalpia de Reação • Calorimetria • Lei de Hess • Entalpia de Formação • Alimentos e Combustíveis A energia pode ser usada para atingir dois objetivos básicos: Trabalho e Calor. Energia Cinética: Forma de energia que se relaciona ao movimento de um corpo. Energia Potencial: Forma de energia encontrada em determinado sistema, que pode ser usada para realizar trabalho. Unidades de Energia Joule (J) Caloria (cal) 1 cal = 4,184 J Sistema e Vizinhança Quando se resolve analisar mudanças de energia, se limita uma parte do universo, desta forma a parte que se estuda é o sistema e todo o resto é a vizinhança. Transferência de Energia As formas mais comuns de se transferir energia são: Trabalho e Calor. A energia não é criada nem destruída, é conservada. Energia Interna Soma de toda a energia cinética e potencial de todos os componentes do sistema. E = Efinal – Einicial E = q + ω A energia interna é proporcional à massa e é influenciada por temperatura e pressão. Relações q > 0 : calor recebido q < 0 : calor desprendido ω > 0 : trabalho motor ω < 0 : trabalho resistente Processo Endotérmico: Transferência de calor da vizinhança para o sistema. Processo Exotérmico: Transferência de calor do sistema para a vizinhança. Função de Estado Depende unicamente de sua atual condição e não do histórico específico da amostra. Função de estado que representa o fluxo de calor nas reações químicas que ocorrem à pressão constante e sem outro tipo de trabalho a não ser o PΔV, sendo proporcional à energia interna. A entalpia é representada pelo símbolo H. H = E + PV H = Hfinal – Hinicial H = E + PV É a variação da entalpia que acompanha uma reação. ∆H = H(produtos) – H(reagentes) Esta reação pode ser: Endotérmica: Ocorre absorção de calor pelo sistema, ou seja, ∆H > 0. Exotérmica: Ocorre liberação de calor pelo sistema, ou seja, ∆H < 0. Estuda as trocas de calor entre os corpos e suas medidas. O aparelho utilizado para medir o fluxo de calor entre os corpos é denominado calorímetro. Quando dois corpos a temperaturas diferentes são colocados em contato térmico, verifica-se que, após certo tempo, ambos adquirem a mesma temperatura, denominada temperatura de equilíbrio térmico. Capacidade Calorífica: Quantidade de calor necessária para que um corpo aumente sua temperatura em 1K (1°C). Calor Específico: Capacidade calorífica de 1g de substância, ou seja, quantidade de calor fornecida a 1g de substância para variar sua temperatura em 1K (1°C). Q = m * c * ∆T Q = calor absorvido ou cedido pela substância. m = massa da substância c = calor específico da substância ∆T = variação de temperatura sofrida pela substância Estabelece que se uma reação for executada em uma série de etapas, o ∆H para a reação será igual à soma das variações de entalpia para as etapas individuais. Exemplo C(g) + O2(g) CO2(g) H = - 393,5 kJ CO2(g) CO(g) + ½ O2(g) H = + 283,0 kJ _____________________________________ C(g) + ½ O2 (g) CO(g) H = - 110,5 kJ Entalpia de Formação: é o calor liberado ou absorvido na formação de 1 mol de uma determinada substância a partir de substâncias simples no estado padrão. Elementos nas formas mais estáveis, ou seja, o alótropo mais abundante de uma substância simples, tem H = 0. Ex: O2, Cgrafite, H2, N2 ΔH = Σ ΔHf (produtos) – Σ ΔHf (reagentes) Alimentos O corpo utiliza a energia química dos alimentos para manter a temperatura corporal, contrair os músculos e construir e reparar tecidos. A maior parte da energia que nosso corpo necessita vem de carboidratos e gorduras. As formas de carboidratos conhecidas como amido são decompostas em glicose C6H12O6. Ela é transportada pelo sangue para as células, onde reage com O2 em uma série de etapas. C6H12O6(s) + 6 O2(g) 6 CO2(g) + 6 H2O(l) ΔH = - 2803 kJ Combustíveis Denomina-se combustível qualquer corpo cuja combinação química com outro seja exotérmica. Quanto maior a porcentagem de carbono e hidrogênio em um combustível, maior é seu calor específico de combustão. Fontes de Energia * Combustíveis Fósseis * Energia Nuclear * Energia Solar * Energia Eólica * Energia Geotérmica * Energia Hidrelétrica * Energia de Biomassa Combustíveis Fósseis Energia Nuclear Energia Solar Energia Eólica Energia Geotérmica Energia Hidrelétrica Energia de Biomassa Química: A ciência central, 9a edição – Brown, LeMay e Bursten www. google.com www.wikipedia.com
Download