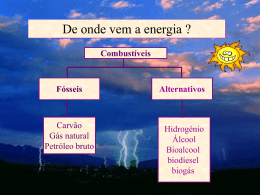
TERMOQUÍMICA Alyson Oliveira 15754 Vanessa Cortez 15787 Tópicos a serem abordados A Natureza da Energia A Primeira Lei da Termodinâmica Entalpia Entalpia de Reação Calorimetria Lei de Hess Entalpias de Formação Alimentos e Combustíveis A Natureza da Energia Energia: capacidade de realizar trabalho e de transferir calor. Energia Cinética: energia relacionada ao movimento de um corpo. Energia Potencial: é a forma de energia que se encontra em um determinado sistema e que pode ser utilizada a qualquer momento para realizar trabalho. A Natureza da Energia Unidades de energia: Joule (J) Caloria (cal) 1 cal = 4,184 J Sistema e Vizinhança Transferência de Energia: Calor Trabalho A Primeira Lei da Termodinâmica É a lei que enuncia a conservação de energia. Energia interna = Energia total do sistema = Σ Ecinética + Epotencial das partes constituintes do sistema. A energia interna é uma propriedade extensiva (proporcional à massa). A temperatura e a pressão exercem influência sobre a energia interna. A Primeira Lei da Termodinâmica ∆E = Efinal – Einicial ∆E = q + ω q > 0 : calor recebido q < 0 : calor desprendido ω > 0 : trabalho motor ω < 0 : trabalho resistente A Primeira Lei da Termodinâmica Processo endotérmico: transferência de calor da vizinhança para o sistema. Processo exotérmico: transferência de calor do sistema para a vizinhança. A Primeira Lei da Termodinâmica Função de estado : depende somente do estado final e inicial do sistema e não do processo pelo qual foi atingido este estado (pressão, volume, temperatura, entalpia etc). Entalpia Calor trocado sob pressão constante. Entalpia (H) é uma função de estado. Entalpia é uma propriedade extensiva (proporcional à energia interna) ∆H = Hfinal – Hinicial = qp (P = cte) ∆H > 0 : processo endotérmico ∆H < 0 : processo exotérmico Entalpia de Reação ∆Hr = Hprodutos – Hreagentes Representação: 2 H2(g) + O2(g) 2 H2O(g) ∆H = - 483,6 kJ Calorimetria A medição do fluxo de calor. O aparelho utilizado para medir o fluxo de calor é denominado calorímetro. Calorimetria Capacidade calorífica: é a quantidade de calor necessária para que um corpo aumente sua temperatura em 1 K (1ºC). Capacidade calorífica molar: é a capacidade calorífica de 1 mol de substância (pura). Calor específico: é a quantidade de calor que deve ser fornecida a 1 g de uma substância para aumentar sua temperatura em 1ºC (1 K), de 14,5 a 15,5ºC. Calor específico = q / m x ∆T (J / g x K) q = m x c x ∆T Calorimetria As técnicas e os equipamentos aplicados em calorimetria dependem da natureza do processo estudado (P = cte ou V = cte). ∆T > 0 qreação < 0 reação exotérmica ∆T < 0 qreação > 0 reação endotérmica Calorimetria Bomba calorimétrica: utilizada para estudar a energia química potencial acumulada nas substâncias, medida a volume constante. Para calcular o calor de combustão a partir do aumento de temperatura medido na bomba calorimétrica é necessário saber a capacidade calorífica (Ccal) do calorímetro. qreação = - Ccal x ∆T Calorimetria Bomba calorimétrica Lei de Hess A lei de Hess estabelece que se uma reação for executada em uma série de etapas o ∆H para a reação será igual à soma das variações de entalpia para as etapas individuais. Lei de Hess Exercício A entalpia de combustão de C em CO2 é -393,5 kJ/mol de C, e a entalpia de combustão de CO em CO2 é - 283,0 kJ/mol de CO. (1) C(s) + O2(g) CO2(g) ∆H = -393,5 kJ (2) CO(g) + ½ O2(g) CO2(g) ∆H = -283,0 kJ Utilizando-se esses dados, calcule a entalpia de combustão de C para CO: C(s) + ½ O2(g) CO(g) Lei de Hess Resolução C(s) + ½ O2(g) CO2(g) CO2(g) CO(g) ∆H = -393,5 kJ ∆H = 283,0 kJ C(s) + ½ O2(g) CO(g) ∆H = -110,5 kJ Entalpias de Formação Entalpia de Formação: é o calor liberado ou absorvido na formação de 1 mol de uma determinada substância a partir de substâncias simples no estado padrão. Estado padrão: forma original de uma substância pura à pressão atmosférica (1atm) e à temperatura de interesse (298 K ou 25ºC). H=0 Cgrafite O2(g) Srômbico P4 (branco) H>0 Cdiamante, C60, C40 O3(g) Smonoclínico Pn (vermelho) Alimentos e Combustíveis Calor específico de combustão: é a energia liberada quando 1 g de uma substância sofre combustão. Alimentos: Reação química da respiração celular C6H12O6(s) + 6 O2(g) 6 CO2(g) + 6 H2O(g) ∆H = - 2803 kJ Alimentos e Combustíveis Alimentos e Combustíveis Combustível: denomina-se combustível qualquer corpo cuja combinação química com outro seja exotérmica. Quanto maior a porcentagem de carbono e hidrogênio em um combustível, mais alto é seu calor específico de combustão. Alimentos e Combustíveis Alimentos e Combustíveis Combustíveis fósseis Alimentos e Combustíveis Energia Nuclear Alimentos e Combustíveis Energia Solar Alimentos e Combustíveis Energia Eólica Alimentos e Combustíveis Energia Geotérmica Alimentos e Combustíveis Energia Hidrelétrica Alimentos e Combustíveis Energia de Biomassa Referências Bibliográficas Theodore L. Brown, H. Eugene Le May, Jr. , Bruce E. Bursten - 9ª edição. – Química a Ciência Central Imagens – www.google.com
Download