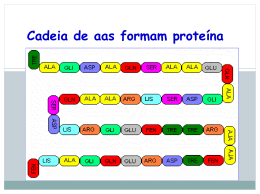
Cadeia de aas formam proteína Proteínas Uma proteína pode conter até milhares de aminoácidos diferentes,2 podendo até virar macromoléculas tridimensionais. COMPOSIÇÃO Citocromo C: 13.000 Ribonuclease: 14.000 Mioglobulina: 17.000 Gliadina: 28.000 Pepsina: 35.500 Insulina: 36.000 Ovoalbunina: 45.000 Hemoglobina: 68.000 Soroglobulina: 180.000 Caseína: 375.000 Fribrinogênio: 450.000 Tiroglobulina: 630.000 Hemocianina: 2.800.000 Vírus: 250.000.000 - Composição: o - - Contém sempre: elementos organógenos: C, H, O, N menor proporção: S, P, I, Br Composição percentual: C: 50 à 55% H: 6 à 7% O: 19 à 24% N: 15 à 19% S: 0 à 2,5% Profa. Denise Esteves Moritz - UNISUL Classificação 2. Seu papel biológico 3 a) Proteínas Estruturais ou de Construção: são as responsáveis pela construção dos tecidos. Colágeno (ossos, cartilagem, tendões e pele); Queratina (pelos, cabelo, unha); Miosina (músculos responsáveis pela contração); Albumina (plasma sangüíneo); - Hemoglobina (hemáceas – transporta gases). Profa. Denise Esteves Moritz - UNISUL Classificação 2. Seu papel biológico 4 b) Proteínas Reguladoras: são as que controlam e regulam as funções orgânicas. Enzimas (são catalisadoras das reações do metabolismo: amilase, maltase, pepsina, etc) Hormônios (regulam as funções orgânicas: insulina, gastrina ACTH e etc). Profa. Denise Esteves Moritz - UNISUL 2. Seu papel biológico Classificação 5 c) Proteínas Protetoras ou de Defesa: são os anticorpos que defendem o organismo e são produzidos por células específicas do sistema imunológico, chamadas linfócitos. - Antitoxinas: neutralizam as toxinas dos agentes de infecção, como as bactérias; - Aglutininas: aglutinam certos agentes de infecção; - Opsoninas: tornam os agentes de infecção mais facilmente atacados pelos fagócitos; - Lisinas: dissolvem certos agentes de infecção Profa. Denise Esteves Moritz - UNISUL Classificação 3. Valor Nutritivo 1. • • • • • • • Chamadas também de Proteínas Completas: são as que provêm e mantêm o ser vivo. ALTO valor Biológico 6 Caseína (leite) Ovoalbuminas e ovovitelinas (ovo) Glicinina (soja) Edestina e glutenina (cereais) Lactoalbuminas (leite e queijo) Albumina e miosina (carne) Excelsina (castanha do Pará) Contém Aa em quantidade e qualidade suficientes para suprir as necessidades! 2. Proteínas semi-completas: são as que provêm,mas não mantêm o ser vivo. • • • • Gliadina (trigo) Legunina (ervilha) Faseolina (feijão) Legumelina (soja) Contém Aa em quantidade ou qualidade insuficientes para suprir as necessidades! IMPORTANTE: Uma proteína é considerada de ALTO VALOR BIOLÓGICO – quando possui em sua composição TODOS os aminoácidos essenciais em quantidades adequadas. Profa. Denise Esteves Moritz - UNISUL 3. Valor Nutritivo 3. - Classificação Proteínas incompletas 7ou não completas: são as proteínas incapazes de prover e manter a vida. Zeína (milho – falta triptofano e tirosina) Gelatina (falta triptofano e tirosina) Contém Aa em quantidade ou qualidade insuficientes para suprir as necessidades! Chamadas também de BAIXO valor Biológico - Profa. Denise Esteves Moritz - UNISUL Classificação:Estrutura • 1 - Primária • 2 - Secundária • 3 - Terciária • 4 - Quaternária BIO-QUIMICA Estrutura a) b) c) d) Primária ou nível primário. Secundária ou nível secundário ou helicoidal Terciária ou nível terciário Quaternária ou nível quaternário Profa. Denise Esteves Moritz - UNISUL Estrutura a) Estrutura Primária ou Nível Primário É a seqüência em número de aminoácidos (cadeia peptídica). A ligação estabilizante é a ligação peptídica (covalente). Se imaginarmos os aminoácidos representados por letras: A, B, C, D, ... teremos uma esquematização da estrutura primária de uma proteína: ........A – B – C – D – A – D – A -.............. É importante salientar que o número de aminoácidos determina o número de proteínas. [Fatorial (!) do nº de aa]. Uma variação na seqüência conduz a uma proteína diferente e com ação bioquímica diferente. Ex: a ocitocina e a vasopressina diferem entre si na seqüência de apenas dois aa; a ocitocina provoca as contrações uterinas e a vasopressina provoca aumento da pressão sangüínea. Profa. Denise Esteves Moritz - UNISUL Estrutura b) Estrutura secundária ou nível secundário (helicoidal) É o enrolamento da estrutura primária em torno de um eixo imaginário, originando uma hélice chamada de hélice. Assim, esta estrutura está relacionada com a disposição espacial das estruturas primárias, e pode ser em forma de um hélice ou uma folha pregueada. Profa. Denise Esteves Moritz - UNISUL Estrutura As ligações estabilizantes dessa estrutura secundária são: Ligação ou Ponte de Hidrogênio: formada pela interação ou atração entre: oxigênio da carboxila de um aa e hidrogênio do grupo amino de outro/ - oxigênio da carboxila de um aa e hidrogênio do grupo carboxila de outro. 2. Ligação Iônica: formada pela atração entre as cadeias laterais dos aa ácidos e aa básicos. 3. Ligação hidrófoba ou apolar: formada pela interação de radicais apolares como: metil, etil, metileno, etc; dos aa constituintes da molécula. 4. Ligação ou ponte dissulfeto: formada pela união de grupos –SH dos aa chamados de cisteína. OBS: - As ligações estabilizantes em maior número são as pontes de H. - A ligação estabilizante mais forte é a ligação dissulfeto. 1. Profa. Denise Esteves Moritz - UNISUL Estrutura Secundária Hélice Laminar BIO-QUIMICA Estrutura c) Estrutura terciária ou nível terciário É a sua forma tridimensional ocasionada pelo enrolamento da espiral sobre si mesma (novelo). As ligações estabilizantes são as mesmas da estrutura secundária. Profa. Denise Esteves Moritz - UNISUL Estrutura Terciária Estrutura Terciária • Professora Dra Rosi Bio-quimica.blogspot.com Estrutura d) Estrutura Quaternária ou Nível Quaternário É a que resulta da reunião de várias estruturas terciárias que, em conjunto, assumem formas espaciais bem definidas. As ligações estabilizantes são as mesmas da estrutura secundária. OBS: nem todas as proteínas apresentam esta estrutura, mas de uma maneira geral, todas as enzimas as apresentam. Profa. Denise Esteves Moritz - UNISUL Estrutura Quaternária • Professora Dra Rosi Bio-quimica.blogspot.com Desnaturação A desnaturação de uma proteína é a desorganização das estruturas quaternárias, terciárias e secundárias. Agentes desnaturantes são os que provocam a desorganização. São eles: - agentes físicos (calor, radiações UV, alta pressão e ultra som) - agentes químicos (ácidos fortes, bases fortes, metais pesados e uréia) A proteína desnaturada apresenta as seguintes alterações: a) Físicas: aumento da viscosidade; não podem ser cristalizadas ou autoorganizadas. Químicas: maior reatividade: devido a exposição de grupos químicos que estavam encobertos por estruturas; diminuição da solubilidade do PHi e, conseqüente precipitação. Biológicas: perda de suas propriedades enzimáticas, antigênicas e hormonais; facilmente digeridas por enzimas hidrolíticas. b) c) Profa. Denise Esteves Moritz - UNISUL 21 Muitas proteínas apresentam-se firmemente enrolada em seu estado natural, como um novelo de lã. Porém, se alguma destas interações forem quebradas, sua forma será alterada e sua conformação – perdida! Chamamos isso de DESNATURAÇÃO DE UMA PROTEÍNA. SÃO AGENTES DESNATURANTES: •pH – abaixo de 5,0 •Temperatura – acima de 50 0C Profa. Denise Esteves Moritz - UNISUL Desnaturação Coagulação: é a desnaturação drástica, ou seja, é um processo irreversível de precipitação, porque não pode-se mais solubilizar a proteína. Profa. Denise Esteves Moritz - UNISUL Proteínas • Propriedades Gerais • Caráter anfótero • Ponto isoelétrico (pI) • Característica de eletrólitos • Solubilidade Caráter anfótero Presença de grupos -NH3+ e -COOCaráter básico ou ácido; dependendo do pH do meio Ponto isoelétrico pH que apresenta igualdade cargas (+) e (-) pl proteína apresenta menor solubilidade Característica de eletrólito Grupos ionizáveis garante presença de cargas (+) e (-) Solubilidade das proteínas Depende da quantidade de pontes de H que formam com a água hidrofílica solubilidade hidrofóbica solubilidade Solubilidade pH próximo do pI solubilidade Diminuem as forças repulsivas entre as moléculas das proteínas Agregados Precipitam FUNÇÃO DAS PROTEÍNAS ANABÓLICA blocos formadores para material celular CATABÓLICA combustível energético proteínas musculares e hepáticas FUNÇÃO ESPECÍFICA Tipos Exemplos Localização e Função Enzimas Catalisa a síntese de ácidos Ácido – graxo sintetase graxos Reserva Albumina Clara de ovo Transportadoras Hemoglobina Transporta O2 no sangue Protetoras no sangue Anticorpos Bloqueiam substâncias estranhas Hormonais Insulina Regula metabolismo da glicose Estruturais Colágeno Tendões, cartilagens, pelos Contráteis Miosina Constituíntes fibras musculares DIGESTÃO E ABSORÇÃO Inicia estômago PEPSINA meio ácido Pepsina PROTEÍNA POLIPEPTÍDEOS ABSORÇÃO dipeptidases e aminotripeptidases jejuno e íleo transporte passivo não existe depósito de aminoácidos proteínas Destino dos aas na célula • Após absorção os aas caem na corrente sanguínea • Síntese de peptídeos e proteínas • Oxidação para formação de energia (fígado e músculo) BIO-QUIMICA Biossíntese protêica • Também chamada Tradução • RNAm chega ao citoplasma se associa ao ribossomo; • RNAt levam os aminoácidos, que serão ligados, formando assim a proteína.
Download