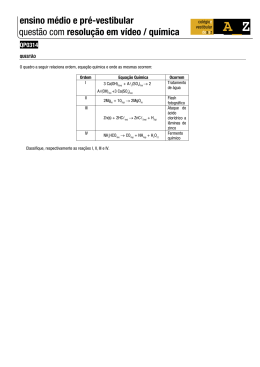
Mol – Exercícios 1) O silício é um semimetal utilizado na elaboração de componentes eletrônicos. Calcule quantos átomos de silício há em um cristal de 56 mg desse elemento. Resolução: Como as massas molares estão sempre na unidade “gramas”, convém também converter a massa de 56 mg para esta unidade: 56 mg de Silício = 0,56 g de Silício, ou 5,6 x 10 -2 g de Silício A massa do silício, obtida na tabela periódica, é igual a 28 g.mol-1. Utilizando-a, podemos calcular a quantidade de átomos presentes no cristal em referência. 2) Qual o número de mols contidos em 5,13 kg de sulfato de alumínio (Al2(SO4) 3)? Resolução: Deve-se, primeiro, calcular a massa de 1 mol de sulfato de alumínio. Para isso, basta multiplicar as massas molares de cada elemento presente na fórmula, pela quantidade de átomos desse elemento. Ao final, somam-se as massas, obtendo-se a massa molar do Al2(SO4) 3. Em seguida, a conversão da massa de sulfato de alumínio, em kg, para a unidade “g”, mesma unidade da massa molar do Al2(SO4) 3. 5,13 kg de do Al2(SO4) 3 = 5130 g de do Al2(SO4) 3, ou 5,13 x 10 3 g de do Al2(SO4) 3 Com uma regra de três, calculamos, agora, o número de mols de do Al2(SO4) 3. Acesse nosso site e acompanhe tudo o que estamos desenvolvendo para você! www.senosecossenos.com.br 3) De um cilindro contendo 640 mg de gás metano (CH4), foram retiradas 12,04 x 1020 moléculas. Quantos mols de CH4 restaram no cilindro? (Massas molar do CH4 = 16 g, calculada como no primeiro passo do exercício anterior). Calculamos, inicialmente, o número de moléculas inicial no cilindro, utilizando a massa do gás em gramas. Em seguida, o número de moléculas retiradas do cilindro. Assim, restam no cilindro: (4,0 x 10 -2) – (2,0 x 10 -3) = 3,8 x 10 -2 mol de CH4. Acesse nosso site e acompanhe tudo o que estamos desenvolvendo para você! www.senosecossenos.com.br
Download