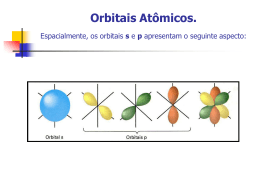
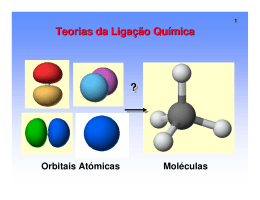
SISTEMA EDUCACIONAL INTEGRADO CENTRO DE ESTUDOS UNIVERSITÁRIOS DE COLIDER Av. Senador Julio Campos, Lote 13, Loteamento Trevo – Colider/MT Site: www.sei-cesucol.edu.br e-mail: [email protected] FACULDADE DE COLIDER- FACIDER Portaria de Autorização:: PLANO DE CURSO CURSO: FARMÁCIA DISCIPLINA: PRINCÍPIOS DE QUÍMICA GERAL E INORGÂNICA SEM: 2º DEPARTAMENTO: FARMÁCIA PROFESSOR: ANO: 2009/1 PERÍODO CURSADO: NOTURNO Aula Prevista CONTEÚDO PROGRAMÁTICO Dada 1 1. FUNÇÕES QUÍMICAS INORGÂNICAS 2 1.1 classificação 3 1.2 formulação 4 1.3 nomenclatura 5 2.1 Ácidos 6 2.2 Bases 7 2.3 Sais 8 2.4 Óxidos 9 3. CONCEITOS BÁSICOS DE LIGAÇÕES QUÍMICAS 10 3.1 Ligação Iônica 11 3.2 As estruturas de Lewis para compostos iônicos. 12 3.3 Ligação iônica e energia. 13 3.4 Ligação Covalente. 14 3.5 A molécula de hidrogênio. 15 3.6 As estruturas de Lewis e a ligação covalente. 16 3.7 Ligações múltiplas 17 3.8 Exceções à regra do octeto. Assinatura / Obs. 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 3.9 Polaridade da ligação 4. GEOMETRIA MOLECULAR E TEORIA DE LIGAÇÃO 4.1 Repulsão dos pares de elétrons da camada de valência (RPECV). 4.2 A polaridade das moléculas. 4.3 Teoria da ligação de valência e sobreposição de orbitais. 4.4 Ligações simples. 4.5 Ligações Múltiplas. 4.6 Orbitais híbridos. 4.7 Relação entre as teorias: RPECV e Orbitais híbridos. 4.8 Teoria do Orbital Molecular. 4.9 Distribuições dos orbitais moleculares. 4.10 Energias dos orbitais moleculares. 4.11 Preenchimento dos orbitais moleculares. 4.12 Moléculas diatômicas homonucleares. 5. SOLUÇÕES 5.1 Misturas e tipos de soluções 5.2 Cálculos de concentração 5.3 Estequiometria em soluções aquosas 5.4 Eletrólitos e íons em soluções aquosas 5.5 Sistemas coloidais 5.6 Abaixamento da pressão de vapor 5.7 Elevação da temperatura de ebulição 5.8 Abaixamento da temperatura de congelamento 6. CINÉTICA QUÍMICA 6.1 Ordem de uma reação. 6.2 Meia vida. 6.3 Fatores que alteram a velocidade de reação. 7. TERMODINÂMICA 46 47 7.1 Calor, trabalho e o primeiro princípio. 7.2 Aplicações da termodinâmica: termoquímica. . 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 7.3 Entropia e Energia Livre. 8. EQUILÍBRIO QUÍMICO 8.1 Equilíbrio químico homogêneo e suas leis 8.2 Princípio de Le Chatelier e fatores que interferem no equilíbrio 8.3 Cálculos de equilíbrio 9. PROCESSOS NUCLEARES 9.1 Radioatividade 9.1.1 - Histórico e principais modos de decaimento 9.2 Estabilidade nuclear 9.3 Cinética dos processos nucleares 9.4 Reações de fissão e fusão e cálculos de energia PRÁTICA 1. Normas de Segurança e Materiais mais Utilizados num Laboratório; 2. Técnicas de Separação e Purificação de Substâncias 3. Comportamento do cobre sólido imerso em solução de nitrato de prata 4. Relações de massa e de quantidade de matéria em uma reação entre soluções de nitrato de prata e de cloreto de sódio 5. Investigação quantitativa da reação de um metal com ácido clorídrico 6. Determinação do teor de ácido acético no vinagre 7. Equilíbrio ácido-base em solução aquosa 8. Balanceamento de equação química a partir de dados de titulação TOTAL H/ A: ........................... -------------------------------------------------------------------Assinatura do Professor
Download