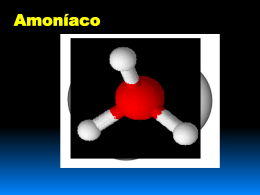
Carlos Corrêa – O amoníaco O amoníaco Carlos Corrêa Departamento de Química (FCUP) Centro de Investigação em Química (CIQ) Carlos Corrêa – O amoníaco NH3 Fórmula molecular .. H NH H .. Fórmula de estrutura N H H H Fórmula estereoquímica Carlos Corrêa – O amoníaco Obtenção do amoníaco Diferenças entre os dois processos: Laboratorial Síntese de qualquer composto Caras Matérias-primas Industrial Baratas Pequenas Barato Quantidades Equipamento Muito grandes Muito caro (NH4)2SO4 + 2 HO– 2 NH3 (g) + SO42– + 2 H2O H + H–N–H H .. H–O ..: H .. H – N: + H – .. O–H H Carlos Corrêa – O amoníaco Aqui se realiza a síntese industrial do NH3 : N2(g) + 3 H2(g) 2 NH3(g) Amoníaco de Portugal Carlos Corrêa – O amoníaco Preparação laboratorial Ca(HO)2 + 2 NH4Cl 2 NH3 + CaCl2 + 2 H2O ou CaO NH3(g) Ca(HO)2(s) ou CaO(s) + NH4Cl (s) Aquecimento Papel indicador (para se saber quando o tubo está cheio) Carlos Corrêa – O amoníaco Recolha do amoníaco numa seringa NH3(g) NH4Cl(s) + Ca(HO)2(s) Carlos Corrêa – O amoníaco Clica NH4Cl(s) + Ca(HO)2(s) Aquecimento Carlos Corrêa – O amoníaco Clica Carlos Corrêa – O amoníaco O amoníaco é uma base NH3(aq) + H2O (l) NH4+(aq) + HO¯(aq) NH4Cl(s) + Ca(HO)2(s) Caixa plástica de chocolates NH3 Nem é preciso calor NH4Cl(s) + Ca(HO)2(s) Água + fenolftaleína Carlos Corrêa – O amoníaco Àgua + gotas sol. fenolftaleina NH4Cl + Ca(HO)2 NH3 Placa transparente Carlos Corrêa – O amoníaco NH4Cl(s) NH3(g) HCl(g) Fumos brancos Ca(HO)2(s) + NH4Cl(s) NH3(aq) + HCl (g) NH4Cl(s) H+ O amoníaco é uma base Carlos Corrêa – O amoníaco Clica NH4Cl(s) NH3(g) Ca(HO)2(s) + NH4Cl(s) HCl(g) Vareta molhada com HCl(aq) concentrado Carlos Corrêa – O amoníaco O amoníaco forma iões complexos 4 NH3(aq) + Cu2+(aq) [Cu(NH3)4]2+ Catião tetraaminocobre(II) 2+ NH3 .. H3N : Cu : NH3 .. NH3 Ligações coordenadas ou covalentes dativas Complexo Cu(HO)2(s) Cu2+(aq) Carlos Corrêa – O amoníaco Por que se forma hidróxido de cobre(II)? Como o NH3 é uma base, reage com a água e produz iões HO¯que precipitam o Cu(II): 2 HO¯(aq) + Cu2+(aq) Cu(HO)2(s) Com excesso de NH3, o precipitado dissolve-se e forma-se o complexo, solúvel: Cu(HO)2(s) + 4 NH3(aq) [Cu(NH3)4]2+ + 2 HO¯(aq) Carlos Corrêa – O amoníaco NH3(aq) [Cu(NH3)4]2+(aq) Cu(HO)2(s) Cu2+(aq) Clica Carlos Corrêa – O amoníaco [Cu(NH3)4]2+(aq) Cu(HO)2(s) Cu2+(aq) Carlos Corrêa – O amoníaco Solubilidade do NH3 em água NH3(g) Repuxo O NH3 dissolve-se rapidamente em água, criando um certo vazio, que faz entrar a água (repuxo). Água com fenolftaleína Carlos Corrêa – O amoníaco O amoníaco é muito solúvel em água Água com fenolftaleína Seringa com NH3 Clica Carlos Corrêa – O amoníaco Novamente Clica Carlos Corrêa – O amoníaco
Baixar