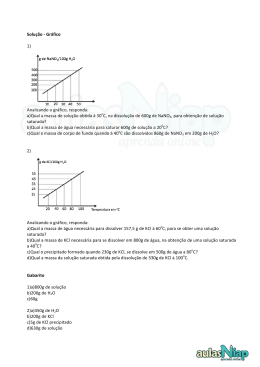
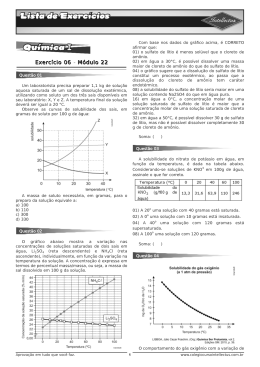
▼ Questão 33 O cloreto de potássio é solúvel em água e a tabela a seguir fornece os valores de solubilidade deste sal em g/100 g de água, em função da temperatura. TEMPERATURA (ºC) SOLUBILIDADE (g/100 g H2O) 10 20 30 40 31,0 34,0 37,0 40,0 Preparou-se uma solução de cloreto de potássio a 40ºC dissolvendo-se 40,0 g do sal em 100 g de água. A temperatura da solução foi diminuída para 20ºC e observou-se a formação de um precipitado. a) Analisando a tabela de valores de solubilidade, explique por que houve formação de precipitado e calcule a massa de precipitado formado. b) A dissolução do cloreto de potássio em água é um processo endotérmico ou exotérmico? Justifique sua resposta. Resolução a) Os valores de solubilidade indicam as composições das soluções saturadas nas diversas temperaturas. Solução inicial (40ºC) Solução final (20ºC) Solubilidade: 40,0 g KCl 100 g H2O Solubilidade: 34,0 g KCl 100 g H2O No experimento: 40 g KCl No experimento: 100 g H2O serão 100 g H2O (solução saturada) saturadas com 34,0 g KCl Precipitou = 40,0 – 34,0 = 6 g b) A solubilidade de KCl em água é um processo endotérmico, já que é favorecida (aumenta) com o ganho de calor provocado pelo aumento da temperatura. 1
Baixar