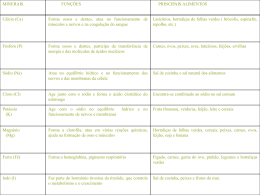
10 INTRODUÇÃO O trabalho monográfico nos Cursos de Licenciatura constitui-se numa ferramenta responsável pela relação teoria-prática na formação do educador. Segundo Vasques (2001) a teoria e a prática se efetivam através de uma dinâmica em que a teoria orienta a ação, entendida como transformação da realidade e esta, por sua vez, pode reorientar a própria teoria, fazendo-a avançar e progredir. Entre ambas existe uma autonomia e dependência mútua relativa, fazendo parte de um processo histórico social. A reflexão sobre a prática, sua análise e interpretação constroem a teoria, que retorna à prática para esclarecê-la e aperfeiçoá-la. Na medida em que se trabalha integradamente teoria e prática, permitindo que a primeira seja o ponto de reflexão crítica sobre a realidade a fim de poder compreendê-la e transformá-la o trabalho científico estará sendo um elo de ligação que certamente culminará numa proposta de inovação criativa, de interferência com vistas à mudanças e à busca de qualidade de ensino. Pretendeu-se através deste trabalho efetivar a inserção de alunos e professores na realidade educacional; essa inserção far-se-á num crescendo que abrangerá desde a integração até o assumir de projetos específicos, encargos docentes e outras formas de atuação na instituição escolar. Pode-se perceber o quanto é gratificante quando o aluno consegue com seus próprios méritos entender como que se processa um fenômeno científico em sua própria casa, que anteriormente era visto como algo superficial e sem sentido. O trabalho permitiu aos alunos do ensino médio, vivenciar uma reflexão dos problemas levantados no cotidiano da sala de aula, pois o desenvolvimento deste projeto possibilitou a aquisição de habilidades/conteúdos necessários à condução do processo ensino/aprendizagem. Pôde-se perceber a partir de tal estudo, a importância do trabalho do professor para o sucesso do aluno e para que haja dinamismo, coerência e entusiasmo. Outro fator relevante percebido ao longo do estudo foi o da resistência e da rotulação dos alunos em relação à disciplina de Química; onde os mesmos denominaram-na a priori, como “... difícil e até mesmo chata” (S.I.C. – Segundo informações do cliente). A partir de então, pode-se pensar que é possível através 11 dos professores desmistificar esta imagem aversiva que muitos alunos possam ter em relação a esta disciplina. Assim, temos: A Química, assim como a Música, a Computação e a eletrônica, utiliza-se de representações que podem ser entendidas por qualquer pessoa familiarizadas com elas. (PERUZZO e CANTO, 2007, p.12). Foi trabalhado neste projeto a “química do dia-a-dia”, em que fazem parte substâncias químicas ligadas a produtos de higiene matinal e produtos alimentícios; associadas ás reações químicas que ocorrem em muitos eventos do nosso cotidiano. Todos estes aspectos abordados tiveram o intuito de despertar nos alunos a busca pelo conhecimento científico através de questionamentos e levantamentos de hipóteses, de observações cotidianas e de senso comum. Os conteúdos abordados foram apresentados de forma conjunta e interdisciplinar, haja visto o quanto a fragmentação dos temas na área de Ciências Naturais traz desinteresses e uma realidade descontextualizada, não promovendo a construção de conhecimentos significativos. No entanto, o projeto enfatizou conteúdos relacionados à química, mas a física e a biologia, também foram utilizadas nas interpretações dos fenômenos. O projeto também se constitui num campo de integração com Temas Transversais, tais como: Saúde, Ética, Trabalho e Consumo, Vida e Ambiente. Segundo Vasques (2001) a teoria e a prática se efetivam através de uma dinâmica em que a teoria orienta a ação; entendida como transformação da realidade e esta, por sua vez, pode reorientar a própria teoria, fazendo-a avançar e progredir. Entre ambas, existe uma autonomia versus dependência mútua relativa, fazendo parte de um processo histórico-social. A reflexão sobre a prática, sua análise e interpretação constroem a teoria; que retorna à prática para esclarecê-la e aperfeiçoá-la. Na medida em que se trabalha integradamente teoria e prática, permitindo que a primeira seja o ponto de reflexão crítica sobre a realidade, para que possa compreendê-la e transformá-la. O Estágio Supervisionado pôde ser um elo de ligação que culminará numa proposta de inovação criativa, de interferência com vistas à mudanças e à busca de qualidade de ensino. O ponto de contato entre a 12 Instituições de Ensino Superior e as Escolas de Ensino Fundamental e Médio, possibilita a integração e a análise da prática pedagógica dessas instituições. Por essas características, a Pesquisa de campo tem o poder de efetivar a inserção de alunos e professores na realidade educacional. Essa inserção far-se-á num crescendo que abrangerá desde a integração até o assumir de projetos específicos, encargos docentes e outras formas de atuação na instituição escolar. A maior parte dos conteúdos fora operada por meio da realização de experiências, para despertar o interesse dos alunos e desenvolver a capacidade de observação, propondo desafios que os motivassem a buscar as soluções. Enfim, observação, experimentação, questionamentos, levantamentos de hipóteses e conclusões levam à construção do conhecimento cientifico. Dessa forma, este trabalho acadêmico trouxe resultados significativos que construíram conhecimentos através de fontes variadas, tais como relatos individuais e coletivos, experiências, leitura de textos, produção de síntese e atividades escritas. Dentre os objetivos do trabalho, pode-se citar: • Valorização das ações diárias dos alunos e seus conhecimentos prévios sobre substâncias químicas, aprimorando-os através de questionamentos, investigações e experimentação. • Desenvolvimento de atividades que permitissem aos educandos estabelecer ligações entre conceitos usados no cotidiano e a linguagem científica. • Formulação de questões, diagnósticos e proposições para problemas reais a partir do nosso dia-a-dia, colocando em prática conceitos, procedimentos e atitudes desenvolvidos no ambiente escolar. • Valorização do trabalho em grupo, sendo capaz de ação crítica e cooperativa para a construção coletiva do conhecimento. O trabalho supracitado foi desenvolvido no município de Anaurilândia – MS, na Escola Estadual Maria José, com os alunos do 2° ano do Ensino Médio regular no período vespertino. 13 2 REFERENCIAL TEÓRICO Uma das principais características do ser humano é a curiosidade, a necessidade de descobrir os segredos da natureza. A ciência, assim, como a vida, é feita de experiências, observações e interpretações, principalmente sobre assuntos polêmicos e interessantes ligados à química. No intuito de desenvolver o senso crítico, a capacidade de questionar e refletir continuamente sobre hábitos e fenômenos químicos há necessidade de aprofundar nossos conhecimentos através de pesquisas e experiências, pois mesmo que não percebemos ao nosso redor e a todo tempo ocorrem fatos ligados à ciência. Como por exemplo: quando salgamos a carne para conservá-la, quando pintamos uma grade de ferro para evitar que ela enferruje, quando usamos a luz elétrica, quando tomamos vacinas contra doenças. Todos esses exemplos são descobertas da ciência que beneficiam nossa vida. Mas também tornou-se comum associar a química, o cientista e a ciência, de um modo geral, a coisas ruins e nocivas à saúde. Nesse sentido, fala-se de “produtos químicos” referindo-se ao não natural. A idéia de “natural” é associada àquilo que é “puro” e faz bem à saúde. Entretanto, todos os materiais com os quais lidamos são constituídos por substâncias e são, portanto, objeto de estudo da química. Em seu estado natural, os materiais são constituídos de mistura de substâncias e não são, nesse sentido, puros. A água, o leite, o sangue, o solo são, dentre tantos outros, exemplos de misturas de substâncias. O leite de origem animal é constituído de água, açúcares, gorduras, proteínas, sais minerais e vitaminas, dentre outros compostos químicos. Da mesma forma, a granola é uma mistura de cereais rica em amido, proteínas, óleos, sais minerais e vitaminas. Assim é possível dizer que os anunciantes dizem que o material é puro, provavelmente estão se referindo ao fato de não existir aditivos nestes materiais. Analisando a química, compreendemos a sua importância na sociedade atual e como ela aparece e interfere, seja positivamente, seja negativamente, no nosso cotidiano. Várias transformações ocorrem na natureza e em situações artificiais de laboratório. Diariamente, lavamos o rosto com sabonete, escovamos os dentes com creme dental, utilizamos cremes hidratantes e protetores solares na pele, lavamos os cabelos com xampu e condicionadores, usamos desodorantes e perfumes. 14 Comemos pão com margarina ou manteiga, lemos jornal impresso com tinta e papel. Vamos para o trabalho ou para a escola de ônibus ou de carro, feitos de metais e plásticos, que consomem combustíveis derivados do petróleo ou da fermentação da cana-de-açúcar. O que nos mantém vivos é uma série de substâncias químicas que consumimos a cada instante, como por exemplo, o oxigênio do ar que respiramos, as proteínas, açúcares, vitaminas e sais minerais que ingerimos na alimentação diária. As células são os mais complexos laboratórios de síntese química que conhecemos. As plantas também são produtoras de substâncias químicas. A partir do gás carbônico existente no ar e da luz solar, as plantas sintetizam os nutrientes consumidos por elas e pelos animais. Elas também produzem o oxigênio que é essencial à vida de muitos organismos. Enfim, vivemos num mundo de materiais e de suas transformações. Para explicar a ocorrência dos fenômenos químicos é necessário compreender passo a passo todo o processo, utilizando-se do conhecimento teórico, para justificar as experiências. 2.1 Osmose A sobrevivência de muitas plantas e outros seres vivos depende da absorção de água pela raiz e do trabalho intestinal dos animais, isto se dá através de um fenômeno chamado osmótico que é a passagem de moléculas de água através de uma membrana semipermeável sempre no sentido do meio hipotônico, isto é, menos concentrado (onde, proporcionalmente, a quantidade de moléculas de água é maior por unidade de volume). O termo semipermeável está relacionado com o tamanho limitado dos poros da membrana, os quais restringem a passagem de partículas com tamanho maior. Algumas das membranas semipermeáveis mais comuns são: bexiga de porco, tripa de carneiro, papel celofane, papel pergaminho, paredes de células de organismos vivos. Os fenômenos osmóticos são de extrema importância na atividade orgânica, de tal sorte que o descontrole dessa função impedindo que a célula se mantenha em 15 isotonia com os líquidos intersticiais acaba levando-a a situações de anormalidades, como a turgescência e a plasmólise. Na turgescência, a célula absorve um excesso de água que faz aumentar de volume. Se a situação não for controlada, a turgescência evolui até a plasmolise, que é a ruptura da célula, com a sua conseqüente morte. Na plasmólise, a célula perde a água para o meio e se desidrata. Seu volume sofre retração e regride, podendo ocorrer a morte celular. Mas se a célula plasmolisada for recolocada em meio hipotônico ela realiza a deplasmólise e volta ao seu volume normal. As principais formas de transporte de substâncias através da membrana plasmática estão indicadas no quadro abaixo: Transporte Passivo Difusão Simples Osmose Diálise Difusão Facilitada Passagem moléculas de água através da membrana. Passagem de moléculas do soluto através da membrana semipermeável. Transporte de moléculas e íons através de membranas por meio de moléculas de proteínas, sem consumo de energia. Transporte Transporte Ativo de de moléculas e íons através de membranas por meio de moléculas de proteínas, com consumo de energia. Transporte em Bloco Endocitose Fagocitose Englobamento de partículas sólida pela célula. Pinocitose Englobamento de líquido pela célula. Exocitose Eliminação de substâncias inúteis pela célula através de vesículas de clasmocitose. A passagem de moléculas de água para a solução pode ser impedido aplicando-se sobre a solução uma pressão externa, denominada pressão osmótica da solução (pressão externa que deve ser aplicada a uma solução para evitar a sua diluição, osmose). Quanto maior for a concentração da solução, mais acentuado será o fenômeno da osmose e, por conseguinte, para impedir a sua ocorrência, uma pressão osmótica maior deve ser exercida sobre a solução. 16 A pressão osmótica, como as outras propriedades coligativas, não depende da natureza das partículas, mas sim da concentração da solução. A pressão osmótica pode atingir valores muito elevados, mesmo quando se trabalha com soluções que apresentam pequenas diferenças de concentração. Esse fato é determinante para a movimentação da água através das membranas celulares nas raízes das plantas, por exemplo, a pressão osmótica pode atingir valores de 50 atm, o que permite que a água atinja todas as regiões da planta. A pressão osmótica normal do sangue é de aproximadamente 7,4 atm quando comparada com a água pura. Os glóbulos vermelhos (hemácias) do sangue assim como todas as células vivas do organismo, são afetados por diferenças de pressão osmótica. Por isso, é importante que as células dos organismos vivos não sejam submetidas a soluções hipertônicas nem hipotônicas. No caso das injeções endovenosas, por exemplo, elas devem apresentar uma concentração igual à do sangue, ou seja, devem ser isotônicas. 2.2 Homeostase O termo homeostase ou homeostasia designa um complexo mecanismo de atividade orgânica e celular que tem por objetivo manter o meio interno do indivíduo sempre constante, nas mesmas condições de temperatura, pH, salinidade e de equilíbrio eletrolítico ou iônico, mesmo que estejam mudando as condições do meio externo ou ambiental. Na verdade, a homeostase depende do funcionamento integrado de diversos sistemas, como o sistema excretor, o sistema endócrino (através dos hormônios), o sistema nervoso etc. Mas ao primeiro deles, cabe um papel extremamente relevante, que é a osmorregulação, fenômeno que pode ser definido como o controle da concentração osmótica celular ou orgânica em função de meio externo. A osmorregulação é exercida pela absorção ou eliminação de substâncias face às variações de densidade dos líquidos em que estejam mergulhados a célula ou o indivíduo. Já vimos, no estudo da célula, que posta ela num meio de menor concentração salina (meio hipotônico), ocorre passagem de água do meio 17 extracelular para o intracelular, resultando a turgescência ou turgência celular. Se a situação persistir, a célula pode chegar à ruptura, ou seja, à plasmoptise. Se, ao contrário, a célula for mantida num meio hipertônico (mais concentrado do que ela), haverá passagem de água do meio intracelular para o meio extracelular. Com perda de água, a célula murchará, realizando a plasmólise. O organismo, para eliminar suas excretas, precisa eliminar conjuntamente uma grande quantidade de água. E isso tem de ser feito sem quebrar o equilíbrio osmótico que deve existir entre as células e o meio extracelular. É isso que caracteriza a osmorregulação. Para que não aconteçam alterações do equilíbrio osmótico, os organismos utilizam os mais diversos expedientes para controlar a perda ou o ganho de água (ou, mesmo, de sais) nos seus líquidos biológicos. Os paramécios e as amebas de água doce (protozoários dulcícolas) são notavelmente hipertônicos em relação ao meio em que vivem. Por isso, estão continuamente “recebendo” água por osmose. Para descartar-se desse excesso de água, eles dispõem de um orgânulo especial – o vacúolo pulsátil – que atua inflandose e murchando ritmadamente, para eliminar a água. Já as amebas e outros protozoários marinhos que, ao contrário, são isotônicos em relação à água do mar, não possuem esse problema e, por isso, são desprovidos de vacúolos pulsáteis. Os peixes exercem a osmorregulação por meio de mecanismos diversos. Os peixes ósseos marinhos são hipotônicos em relação à água do mar. Por essa razão, estão sempre “perdendo” água para o meio. Para não sofrerem desidratação (o que, aliás, seria bem paradoxal num animal aquático!), eles bebem a água salgada. Absorvem essa água no intestino. O sangue, entretanto, ao passar pelas brânquias, elimina os sais por transporte ativo. Mas a água, ele conserva. Como você vê, as brânquias nesses animais se constituem não somente em órgãos respiratórios, mas também excretores. A urina desses peixes é reduzida e muito concentrada, pois também elimina o excesso de sal. Eles urinam pouco exatamente para conservar a água o máximo possível no organismo. Já os peixes cartilaginosos marinhos, como o tubarão, recorrem a outro expediente: acumulam no sangue altas taxas de uréia (incompatíveis com a vida, se fosse em outros seres), aumentando a concentração ou a densidade sangüínea até mantê-la próxima da concentração ou densidade da água do mar. Assim, ficam quase isotônicos com o meio externo e não enfrentam problemas de osmolaridade. 18 Os peixes de água doce são hipertônicos em relação à água dos rios e lagos. Por isso, sofrem intensa endosmose (entrada de água nas suas células). Para evitar a turgescência, eles praticamente não bebem água e eliminam grandes quantidades de urina. E ela é bastante diluída. Como isso pode acarretar certa perda de sais do organismo, eles absorvem, compensadoramente, sais pelas brânquias, também à custa de transporte ativo. 2.3 Conservação de Alimentos No processo de fabricação do charque, também chamado jabá ou carne-seca, a manta da carne é deixada dentro da salmoura até que esta seque. Já na fabricação de carne-de-sol, está é mergulhada na salmoura e posta a secarem em varais. A água é retirada do interior das células pelo processo de osmose; estabelecendo um gradiente de concentração salina que cresce de dentro para fora, formulando-se um fluxo aquoso nesse sentido. O alimento então, fica duplamente protegido; primeiro por não propiciar um meio aquoso favorável ao desenvolvimento microbiano, e segundo, porque os microorganismos ao se aproximarem do sal são desidratados por osmose, morrendo ou se esporulando. O processo de osmose também é a explicação para a conservação de geléias, doces em pasta, balas, mel, melados e, em menor grau, compotas. A concentração de açúcar é tão grande que impede o desenvolvimento microbiano. A preparação de doces é uma forma de conservação da fruta pelo açúcar. A fruta seria facilmente perecível e o doce não. O processo de osmose explica o porquê da remoção da casca do pêssego e também o talho em cruz que se dá na base do figo na preparação de suas compotas. Sem essa técnica, que no fundo é à ruptura da membrana, o pêssego e o figo ficariam totalmente murchos e enrugados, em conseqüência da retirada da água do seu interior. As hortaliças contêm água, sais minerais e são pouco ácidas. Em contato com uma solução concentrada de vinagre e sal, a água movimenta-se espontaneamente do interior da hortaliça para a solução de vinagre e sal. Vinagre e sal, por sua vez, deslocam-se para dentro das hortaliças, numa tentativa de igualar a concentração nos dois meios. 19 Trocando uma parte de água por vinagre e sal, as hortaliças ficam mais duras, mais ácidas e mais salgadas do que eram. Essas novas características inibem o desenvolvimento dos micróbios decompositores. E sem decompositores não há deterioração. 2.4 Funções Químicas O número de substâncias químicas existentes na natureza é muito grande, mas existem substâncias químicas produzidas em laboratórios. Entre as substâncias químicas, naturais ou artificiais, existem as que apresentam as mais variadas propriedades, e ao contrário do que se possa imaginar, é possível reuní-las em grupos com propriedades químicas semelhantes. Esses grupos são chamados funções químicas e são: ácidos, bases, sais, óxidos e hidretos. Foi feita esta divisão para se tornar possível um conhecimento mais aprofundado de todas as substâncias químicas. O estudo das funções químicas foi iniciado no final do século passado pelo químico sueco Arrhenius. 2.4.1 Ácidos Segundo Arrhenius, ácidos são todas as substâncias que, em solução aquosa, sofre ionização, liberando como único cátion o H+. Uma das características comuns dos ácidos é o seu sabor azedo, presente em muitas substâncias usadas no nosso cotidiano. Todas as substâncias azedas estimulam a secreção salivar, mesmo sem serem ingeridas. Em solução aquosa, os ácidos conduzem eletricidade. Isto ocorre pelo fato de os ácidos se quebrarem em íons, quando em solução aquosa. Os cátions são atraídos pelo pólo negativo, enquanto os ânions são atraídos pelo pólo positivo. Esse movimento de cargas elétricas é que caracteriza a corrente elétrica. Antes de se dissolverem em água, os ácidos são compostos moleculares. Existem vários critérios para classificar os ácidos. São eles: − Quanto à presença do oxigênio na molécula: • Hidrácidos – ácidos que não apresentam oxigênio em sua molécula. Ex. HCN. • Oxiácidos – ácidos cujas moléculas apresentam oxigênio. Ex. HNO³ . 20 − Quanto ao número de hidrogênios que estiverem ligados a um outro átomo ou grupo de átomos, cuja eletronegatividade seja significante maior que a sua. Nos hidrácidos, todos os hidrogênios que estiverem ligados a um outro átomo ou grupo de átomos, cuja eletronegatividade seja significativamente maior que a sua. Nos hidrácidos, todos os hidrogênios presentes nas moléculas são ionizáveis, enquanto nos oxiáciodos somente os hidrogênios diretamente ligados ao oxigênio. Assim, em função do número de hidrogênios ionizáveis, podemos classificar os ácidos em: • monoácidos – produzem apenas um íon H+ por molécula ionizada. Exemplo HF; • diácidos – produzem dois íons H+ por molécula ionizada. Exemplo H2S; • triácidos – produzem três íons H+ por molécula ionizada. Exemplo H3PO4; • tetraácidos – produzem quatro íons H+ por molécula ionizada. Exemplo H4P2O7. Para saber, com certeza, o número de hidrogênios ionizáveis em um ácido, é fundamental conhecer sua fórmula estrutural. Como já vimos nos hidrácidos, todos os hidrogênios são ionizáveis. H - CL HCL S H 1H+ ionizável monoácido H 2H+ ionizáveis diácido Nos oxiácidos, são ionizáveis somente os hidrogênios ligados a átomos de oxigênio (O). Quanto aos números de elementos químicos: • ácidos binários – são os ácidos cuja molécula contém dois elementos. Exemplo: HCl; • ácidos ternários – são os ácidos cuja molécula contém três elementos. Exemplo: HCN; • ácidos quaternários – são os ácidos cuja molécula contém quatro elementos: exemplo: HCNS; 21 Quanto à presença de carbono: Em geral, os ácidos que contém carbono são ácidos orgânicos e os demais são minerais ou inorgânicos. Orgânicos – H2CO2, H4C2O2. Inorgânicos – HCl, H3PO4. Os ácidos, H2CO3, HCNO, HCN e HCNS são considerados intermediários entre os dois grupos,pois embora tenham carbono, o seu comportamento químico se assemelha aos dos outros ácidos inorgânicos. Quanto ao estado físico: Os ácidos, sendo todos covalentes, podem ser encontrados nos três estados físicos, a temperatura ambiente: − Sólidos – H3PO4, H3BO3. − Líquidos – HF, H2SO4. − Gasosos – HBr, HCN. Quanto ao ponto de ebulição: Os ácidos que volatizam com muita facilidade são chamados voláteis. em oposição, temos os não voláteis ou fixos, que apresentam alto ponto de ebulição. − Voláteis – HCl, HF, H2S. − Não Voláteis – H2SO4, H3PO4. O grau de ionização de um ácido (a) é a relação entre moléculas ionizadas e o número de moléculas dissolvidas .matematicamente, temos a expressão: α= n.°de moléculas ionizadas n.°de moléculas dissolvidas Assim temos: − ácidos fortes – onde α ≥ 50%. Exemplos HCl, H2SO4. − ácidos moderados – onde 5% α 50%. Exemplos HF, HNO2. − Ácidos fracos – onde α ≤ 5%. Exemplos H2S, H2CO3. 2.4.2 Principais Ácidos O ácido clorídrico consiste no gás cloreto de hidrogênio, que é bastante solúvel dissolvido em água. O estomago secreta esse ácido, num volume aproximado de100ml, para auxiliar a digestão dos alimentos. quando impura , é vendido no 22 comércio com o nome de ácido muriático, sendo usado principalmente na limpeza de pisos e de superfícies metálicas antes do processo de soldagem. Na extração de petróleo, ácido clorídrico é introduzido no bolsão rochoso, dissolvendo uma parte das rochas e facilitando o fluxo de petróleo e até a superfície. Ácido cítrico CH2 – COOH | HO – C – COOH | CH2 – COOH Sólido incolor, de sabor agradável e solúvel em água e álcool. O ácido cítrico é dos ácidos vegetais os mais difundidos na natureza. É encontrado também no organismo humano, no dos animais e no suco de frutas cítricas. Foi descoberto no suco de limão onde existe uma grande quantidade e a partir do qual foi obtido através de seu sal de cálcio que é dificilmente solúvel em água. Pode ser obtido a partir de glicose, maltose e dextrina por ação de certos fungos (citromicetos) com um rendimento de 50%. As principais propriedades do ácido cítrico são: alta solubilidade, seu efeito sobre o sabor de certos alimentos e sua ação como quelante de metais (cobre, ferro, etc.) A adição de 0.5% de ácido cítrico e 0,2% de ácido-isoascórbico é suficiente para prevenir o escurecimento de bananas Durante a compilação ou descongelação. No vinho, na cidra e no vinagre não destilados há formação de precipitado. Esse precipitado é devido, a formação de tanino–metálico ou fosfato insolúveis. O ácido cítrico neste caso age como sequestrante. Os produtos alimentícios em conserva contem ácido cítrico que age como acidificante ou sequestrante. Conhece-se o ácido acético sob a forma de vinagre desde os tempos mais remotos. O ácido acético concentrado foi obtido no ano 200 aproximadamente. Encontra-se extraordinariamente difundindo no reino vegetal, no estado livre ou na forma de ésteres. Também é encontrado em secreção animais. 23 Grande números de fungos tem a capacidade de degradar certas substancias orgânicas a ácido acético. O ácido acético pode ser obtido do vinho pela oxidação do álcool etílico em presença de acetobacter acetil (mãe de vinagre ). Também é obtido em maior quantidade pela destilação seca da madeira, juntamente com outros produtos, dos quais é separado por meio de cal. Há formação de acetona de cálcio que é decomposto pelo ácido sulfúrico obtendo-se ácido acético mais sulfato mais sulfato de cálcio. O ácido acético puro é muito pouco utilizado em alimentos. Vinagre são obtidos além do vinho , de sidra de sacarose e malte por fermentação alcoólica e posteriormente acética. O ácido acético além de ser usados como condimento é empregado na síntese de perfumes, corantes, acetona e na obtenção do acetil celulose e acetatos que são usados também em tinturarias, etc. Têm, portanto, grande importância industrial. O ácido acético tem ação preservativa. Nos estados unidos, as regulamentações vigentes reconhecem o uso do vinagre, ácido acético como seguro para alimentos. Ácido acético é corrosivo e deve ser manuseado com cuidado. Vitamina c ou Ácido Ascórbico Esta vitamina é abundante nas frutas cítricas e vegetais verdes. Suas funções no organismo são múltiplas: participa da síntese do colágeno (proteína importante na formação da pele saudável), da manutenção das paredes dos vasos sanguíneos; do metabolismo de alguns aminoácidos; e de síntese ou liberação de harmônios da glândula supra–renal. Tem nítida participação no desenvolvimento do tecido conjuntiva e é estimulante da produção de anticorpos pelo organismo. Por essa razão, ela é conhecida como vitamina anti- infecciosa. Sua deficiência produz o escorbuto, doença caracterizada por lesões nas gengivas, queda de dentes e hemorragias por todo o corpo, que podem levar à morte. É uma vitamina que se decompõe com muita facilidade quando exposta às condições normais do ambiente. A vitamina C ajuda a prevenir ou mesmo curar certas doenças, como o resfriado comum ou algumas doenças malignas e infecciosas. 24 2.4.3 Bases São compostos que em solução aquosa se dissociam ionicamente, libertando como ânions exclusivamente íons hidroxila OH. Para Arrhenius, as bases seriam constituídas do grupo OH e de um metal, sendo o NH4OH uma exceção, porque o cátion é um íon composto, não um metal. Segundo Arrhenius as bases são substâncias iônicas. As bases apresentam sabor que denominamos cáustica, adstringente ou ainda lixívia. Seu valor assemelha-se ao de uma banana verde. Classificamos as bases da seguinte forma: Quanto ao número de hidroxilas: − monobases – NaOH, NH4OH − dibases – Ca (OH) 2, Mg (OH)2 − tribases – Fe (OH)3, Cr (OH)3 − tetrabases – Pb (OH)4, Sn (OH)4 Quanto ao grau de dissociação iônica: O grau de dissociação iônica corresponde ao grau de equilíbrio (α), aqui chamado de grau de dissociação, pois refere-se a uma dissociação, já que nas bases de um modo geral, prevalece o caráter iônico. Podem ser: − Bases fortes – as dos metais alcalinos e os hidróxidos de calcio, estrôncio e bário. − Bases fraca – todas as demais inclusive o NH4OH. Quanto ao grau de solubilidade em água: − solúveis – as bases dos metais alcalinos e o HH4OH. − parcialmente solúveis – Ca (OH)2, Sr (OH)2 e Ba (OH)2. − insolúveis – todas as outra bases. 2.4.4 Principais bases Hidróxido de sódio (NaOH) O hidróxido d sódio é conhecido por soda cáustica, cujo termo cáustica significa que ela pode corroer ou de qualquer modo, destruir os tecidos vivos. É um sólido branco, cristalino e higroscópico, ou seja, tem a propriedade de absorver água. Por isso, quando exposto ao meio ambiente, ele se transforma, após 25 um certo tempo, em um líquido incolor. As substâncias que possuem essa propriedade são denominadas deliqüescentes. Quando preparamos soluções concentradas dessa base, elas devem ser conservadas em frascos plásticos, pois lentamente reagem com o vidro. Além disso, reagem também com óleos e gorduras e, por isso, uma das principais aplicações da soda cáustica é a produção de sabão e, também, a fabricação cáustica converte as graxas em uma substância solúvel e fluída, que é removida pela lavagem: Óleo ou gordura + NaOH ―∆→ sabão + glicerina As outras aplicações do hidróxido de sódio estão relacionadas à indústria petroquímica, de fabricação de papel, de celulose, de corantes etc. A soda cáustica não existe na natureza e a sua preparação é feita a partir do cloreto de sódio (NaCl), através da eletrólise. O hidróxido de cálcio é conhecido por cal hidratada, cal extinta ou cal apagada. Nas condições ambiente, é um sólido branco, pouco solúvel em água. Sua solução aquosa é chamada água de cal e a suspensão de Ca (OH)2 é chamada leite de cal. Essa base é consumida em grande quantidade nas pinturas a cal (caiação) e na preparação de argamassas (massa de assentamento de tijolos e recobrimento de paredes). Hidróxido de magnésio [Mg (OH)2] O hidróxido de magnésio é um sólido branco, pouco solúvel em água. Quando disperso em água, a uma concentração de aproximadamente 7% em massa, o hidróxido de magnésio origina um líquido branco e espesso que contém partículas sólidas misturadas à água. A esse líquido damos o nome de suspensão, sendo conhecido também por leite de magnésia, cuja principal aplicação consiste no uso com antiácido e laxante. Hidróxido de amônio (NH4OH) O hidróxido de amônio não existe isolado, sendo obtido quando borbulhamos amônia (NH3) em água, originando um solução comercializada como amoníaco. NH3(G) + H2O → ← NH+4(aq) + OH-(aq) A amônia é um gás incolor, de cheiro irritante, presente numa mistura chamada inalador de amônia, usada para restabelecer pessoas desmaiadas. A partir da amônia são fabricadas várias outras substâncias de grande importância, tais como: 26 • ácido nítrico; • sais de amônio, muito empregados como fertilizantes na agricultura; • produtos de limpeza doméstica (ájax, fúria etc). 2.5 Potencial Hidrogeniônico (pH) É um número sem unidade que caracteriza a concentração dos prótons em moles por litro [H+], medida em uma solução aquosa ou não. A escala de pH consiste em um meio para designar a concentração real de íons H+ em qualquer solução aquosa na faixa de acidez de 1,0 molar de H+ e 1,0 molar de OH-. A escala de pH foi idealizada pelo químico dinamarquês Sörensen em 1909 para as seguintes expressões: pH = log _1_ pOH = log __1__ [H+] [H-] pH = log [H+] pOH = log [OH-] Em uma solução neutra a concentração do [H+] é a concentração da [OH-], em 24°C possuem o mesmo valor numérico. Lembre-se que o produto iônico da água é a base. [H+] = [H-] 10-7 Logo o pH é 7 Os métodos mais comuns para a medida do pH de soluções fundamenta-se no comportamento de algumas substancias orgânicas quando em meio ácido ou alcalino. Para determinada acidez do meio, elas apresentam uma cor; variando as condições do meio, ocorre uma viragem de cores nas substâncias. O alaranjado de metila, por exemplo, apresenta-se avermelhado em soluções de pH inferior a 4; para valores de pH superiores a este, assume cor amarela. Já com o amarelo de alizarina com pH inferior a 11, apresenta-se amarelo, passando a vermelho quando o pH da solução é superior a este valor. Além destas substâncias, ainda temos a fenolftaleína, que é incolor em pH < 8 e rosa em pH > 10, temos o vermelho de metila que “vira” a um pH igual a 5; o tornassol, a um pH igual a 7; o azul de timol, a um pH igual a 2, e assim por diante. Elas são chamadas substâncias indicadoras. Procurando o pH de uma solução, o 27 experimentador testa amostras da solução com vários indicadores, chegando, por tentativas, ao valor do pH. Esse procedimento, contudo, não é muito prático. Em utilizações corriqueiras, e quando não há necessidade de grande precisão, prefere-se lançar mão do indicador universal, que é uma mistura de diversas substancias, sendo, assim, capaz de fornecer informações sobre o pH de qualquer tipo de solução. Para tornar ainda mais rápida a determinação utiliza-se folhas de papel absorvente impregnadas com o indicador universal. Essas folhas são cortadas em tira que por sua vez imersas na solução-problema. A coloração assumida pela tira vai depender das condições de acidez do meio e, assim, por comparação entre essa cor e as cores de uma escala fornecida pelo fabricante, chega-se ao valor do pH da solução. Quando a precisão da medida efetuada com o indicador universal é insuficiente, recorre-se à medida eletrônica: é o chamado método potenciométrico. É levada a efeito com o auxílio de instrumentos que permitem medidas de maior ou menor precisão, de acordo com a complexidade de sua construção. Eles baseiam-se no principio de comparação entre potenciais eletrônicos, sendo, em última análise, uma pilha eletroquímica de características particulares. Os elétrodos, um de referência e outro de medição imersos na solução a ser examinada que funciona como eletrólito. Um voltímetro eletrônico, cuja escala é calibrada em valores de pH, completa o conjunto. Um dos principais aparelhos para determinar o pH de uma solução chama-se pHmetro ou “peagâmetro”. A noção de pH tem implicações importantes em diversos domínios: na agricultura (acidez dos solos), na indústria (agroalimentar, cosmética), na vida cotidiana (alimentação, trabalhos cosméticos) e inclusive em biologia e na medicina. As misturas tampão são soluções onde uma adição de ácido ou de base não provoca uma grande variação de pH. Os meios biológicos são exemplos disto. O principal tampão do plasma sanguíneo é constituído das espécies CO2 (DIÓXIDO DE CARBONO), HCO3 ( íon hidrogeno-carbonato), CO2, (íon carbonato) que permite manter o pH do sangue em 7,4. Um pH de 6,9 não permite a sobrevivência do ser humano. Muitas das reações químicas, tanto as praticadas em laboratório, quanto aquelas realizadas na industria, são processadas em meio líquido. São assim 28 fortemente dependentes das condições de acidez do meio para serem levadas a bom termo. Daí a importância de se saber utilizar indicadores e aparelhos que determinam o pH. 2.6 Sal Na química moderna, “sal” é um termo descritivo aplicado a uma família determinada de substancias e não a qualquer substancia individual, em particular. Produz-se um sal substituindo o hidrogênio de um ácido, no todo ou em parte, por metal ou radical básico. Nos sais normais todo hidrogênio deslocável do ácido está substituindo pela base. Nos sais ácidos, somente parte do hidrogênio substituível foi deslocado pelo hidrogênio (base), e o sal ainda contêm dois ou mais átomos de hidrogênio substituíveis, não é necessário que todos sejam deslocados pelo mesmo elemento. Assim acontece com o ácido sulfúrico (H2SO4). Algumas vezes usa-se o termo “hidrogênio” em lugar de “ácido” para os sais ácidos; em outras, acrescenta-se o prefixo “di” ao nome de ácido correspondente ao sal. Assim, o sulfato de hidrogênio e potássio é denominado sulfato ácido de potássio, bissulfato de potássio, sulfato monopotássico etc. Os sais normais denominam-se também sais neutros; neles, todo o hidrogênio do ácido foi neutralizado. Esses sais não são necessariamente neutros ao tornassol. Os sulfatos normais de zinco ou cobre agem com aquele indicador (tornassol) como se fossem ácidos. O bórax, nitrito de potássio e o carbonato normal de potássio agem como se fossem bases. As vezes é necessário usar os prefixos “mono”, “di”, “tri” etc. Para diferenciar os diversos sais de um ácido. Assim, no caso do ácido fosfórico, no qual o elemento fósforo é pentavalente (valência 5) temos: fosfato monossódico, NaH2PO4 fosfato dissódico, N2HPO4 e fosfato trissódico, Na3PO4. Nem todo o hidrogênio de um ácido é substituível por um hidróxido. O ácido hipofosforoso, H3PO2, tem somente um se seus três átomos de hidrogênio substituível por um metal. Até hoje ainda não foi preparado o hipofosfito dissódico, Na2HPO2, e o hipofosfito trissódico, Na3PO2. Também o ácido acético, CH3COOH, tem unicamente um átomo de hidrogênio substituível. 29 Na formação de sais deve ser observada a basicidade do ácido, numero de átomos de hidrogênio contido em sua molécula (do ácido), substituíveis por um metal ou por um radical. Assim, o ácido clorídrico (Hcl) é monobásico porque cada uma de suas moléculas contém um átomo de hidrogênio substituível; o ácido sulfúrico (H2SO4) é dibásico, o ácido fosfórico (H3PO4) é tribásico e o ácido silícico (H4SIO4) é tetrabásico. O ácido acético, o ácido hipofosforoso são monobásicos, em geral, os sais são compostos associados devido a um grupo de propriedades comuns. Têm um ponto de fusão relativamente alto; são condutores da eletricidade no estado fundido. Suas soluções aquosas são condutoras de eletricidade. Muitos sais levam água (ou algum outro composto) fracamente unida a eles em quantidades definidas. Um dos sais hidratados é o sulfato de cobre pentaidrato (CUSO4. 5H2O) e o carbono de sódio decaidratado (Na2CO3 . 10H2O). Para a formação de sais a ação de um ácido sobre uma base não é o único processo, podendo ser obtidos também por dupla troca entre dois outros sais. Assim quando se trata uma solução de cloreto de bário (BaCl2) com solução de sulfato de sódio (Na2SO4), obtém-se o sulfato de bário (BaSO4), precipitado branco, e o cloreto de sódio (NaCl) em solução. Os sais são também classificados conforme a sua solubilidade em água: solúveis e insolúveis. Quando se diz que um sal é insolúvel, na verdade se que dizer que sua solubilidade em água é muito pequena, pois nenhuma substância é totalmente insolúvel. A solubilidade do sal tem uma relação importante com o seu grau de dissociação iônica. Os sais solúveis apresentam um elevado grau de dissociação, originando soluções iônicas e, por isso, são considerados bons eletrólitos. Já os sais insolúveis com pequena quantidade de íons, sendo por isso considerados maus eletrólitos. Conheça a formação de alguns sais e simultaneamente, as suas aplicações. O sal mais importante e mais utilizado é o NaCl. (sal de cozinha). Sal de Cozinha Designação usual do cloreto de sódio (NaCl) mais típico dos compostos pertencentes à função sal da química inorgânica. Conhecido pelo homem desde o Eolítico, o sal foi fator determinante na migração de algumas tribos primitivas. O 30 “salário” dos legionários romanos era uma porção de sal que lhes cabia como parte de seu pagamento, donde se derivou a atual acepção da palavra. O cloreto de sódio pode ser obtido de quatro origens diferentes, aparecendo sempre em mistura com sais de cálcio, magnésio, potássio ou ferro: (1) sal marinho, resultante da evaporação da água do mar; (2) sal-gema, resultante da exploração das jazidas do mineral halita, cujos principais depósitos se encontram na Polônia (Wieliezka), Espanha (Cardona) e França (Dieuze e Salins); (3) Salmora, resultante da evaporação das água de lagos ou mares interiores, e que é o tipo produzido em maior quantidade pelos EUA; e (4) sais mistos, obtidos de depósitos onde se encontra misturado a outros minerais. A extração do sal-gema é feita conforme a localização da mina. Na Polônia é retirado de geleiras subterrâneas que alcançam 300m de profundidade; em Stassfurt, em Cardona a exploração é feita a céu aberto; no Texas e na Pensilvânia introduz-se no solo da mina uma sonda de dois tubos concêntricos, servindo um para conduzir a água de dissolução e o outro para saída da solução salgada, ou será então evaporada e filtrada. A salmoura e o sal marinho são extraídos nas salinas, instalações construídas em locais periodicamente recobertos pelas marés. A água recolhida nos tanques rasos impermeáveis (evaporadores), onde se concentra aos poucos por meio do calor solar ou de um processo de vácuo. O sal obtido é acumulado em montes ou moendas ou meda para secar e depois submetido a processos de refinação, visando sobretudo à eliminação dos sais de magnésio. A refinação pode ser feita pelo regamento do sal com solução saturada de cloreto de sódio e ácido clorídrico, que arrasta somente as impurezas, ou pelo tratamento com cal, que precipita todos os sais restantes, principalmente os de magnésio. O sal é empregado in natura para consumo humano ou pecuário e para conservas e charqueadas. É a matéria-prima de inúmeros produtos químicos essenciais à industria, como o carbonato de sódio, o hidróxido de sódio, o sulfato de sódio, o cianeto de sódio, o bissulfato de sódio, o ácido hidroclorídrico. Pela eletrólise é também fonte de cloro livre, com múltiplas aplicações. O cloreto de sódio puro é sólido, incolor, inodoro e de sabor salgado característico. Sua massa molecular é 58,5; densidade em relação à água: 2,17; ponto de fusão: 780° e, ponto de ebulição 792°C. Cristaliza no sistema cúbico, agrupando-se os cristais em pirâmides quadrangulares e ocas chamadas tremonhas ou trêmias. Os cristais são anidros, mas ao agrupar-se guardam entre si pequena 31 quantidade d´água, causa da crepitação que se observa ao serem lançados no fogo. São também diatermanos, isto é, transparentes para os raios vermelhos e infravermelhos do espectro solar. FLUORETO DE SÓDIO (NaF) Esse sal é formado pelo ânion fluoreto (F0, proveniente do ácido fluorídrico (HF), e pelo cátion sódio (Na). O fluoreto de sódio é usado como anticárie, pois inibe a desmineralização dos dentes, tornando-os menos suscetíveis a cárie. NITRATO DE SÓDIO (NaNO3) Esse sal é formado pelo ânion nitrato (NO3), proveniente do ácido nítrico (HNO3), e pelo cátion sódio (Na+). Esse sal é conhecido por salitre do Chile, sendo muito utilizado na fabricação de fertilizantes (adubos). A transformação do NaNO3 em nitrato de potássio (KNO3) permite a fabricação mais comuns, e cuja composição, nas proporções adequadas, é:KNO3+ carvão+ enxofre. CARBONATO DE SÓDIO (NA2CO3) Esse sal é formado pelo ânion carbonato (CO2), proveniente do ácido carbônico (H2CO3), e pelo cátion sódio (Na+). O carbonato de sódio é conhecido por barrilha ou soda e comumente é utilizado no tratamento de água de piscina, na fabricação de sabões, remédios, corantes, papel etc. sua principal aplicação, é a fabricação de vidro comum: Barrilha+ calcário+ areia. BICARBONATO DE SÓDIO (NaHCO3) Esse sal é formado pelo anion bicarbonato (HCO3), proveniente do ácido carbono (HCO3) e pelo cátion sódio(Na+). O bicarbonato de sódio é o nome comercial do carbono ácido de sódio ou hidrogênio-carbono de sódio. É um sólido de cor branca, sendo aplicado medicinalmente como anti-acido estomacal, por ser capaz de neutralizar o excesso de acido clorídrico presente no suco gástrico. 32 Considerando que o bicarbonato de sódio reage com o ácido clorídrico do estômago: NaHCO3 + HCl → NaCl + H2O + CO2 O CO2 liberado é o responsável pela eructação (“arroto). Nos principais ante ácidos comerciais efervescentes,existem compostos,como o ácido tartárico, o ácido cítrico e outros, que na presença do bicarbonato de sódio produzem a efervescência. Uma outra aplicação do bicarbonato de sódio é a sua utilização como fermento de pães e bolos. O crescimento da massa deve se a liberação de CO2. Esse sal também é utilizado na fabricação de extintores de incêndio de espuma. No extintor há NaHCO3 (sólido) e uma solução de ácido sulfúrico (H2SO4) em compartimentos separados. Além disso, o bicarbonato de sódio é utilizado como um dos componentes dos talcos desodorantes, pois reage com os ácidos liberados da transpiração, neutralizando-os. CARBONATO DE CÁLCIO (CaCO3) Esse sal é formado pelo ânion carbonato (CO⅔), proveniente do ácido carbônico (H2CO3) e pelo cátion cálcio (Ca2+). . O carbono de calcio é encontrado em grande quantidade na natureza, constituindo o calcário e o mármore. O mármore é utilizado para a fabricação de pias, estátuas, pisos e escadarias. A decomposição térmica do calcário irá produzir a cal viva e o gás carbônico: CaCO3 → Cal + CO2 O calcário é utilizado na fabricação do vidro comum e a produção do cimento. O carbono de cálcio é praticamente insolúvel em água pura com dióxido de carbono existente na atmosfera. Essa é a principal reação responsável pela formação de cavernas de calcário. Uma aplicação da formação do carbono de cálcio no nosso dia-a-dia ocorre quando pintamos paredes usando cal extinta (Ca (OH)2). Após a caiação ,e cal extinta reage com o gás carbônico da atmosfera, originando uma película de carbono de cálcio que, por ser insolúvel na água, protege a parede. Ca (OH)2 + CO2 → CaCO3 + H2O 33 O carbono de cálcio também é usado na vinicultura, para diminuir a acidez do vinho e em cremes dentais, como abrasivo. SULFATO DE CALCIO (CaSO4) Esse sal é formado pelo ânion sulfato (SO2/4), proveniente do ácido sulfúrico (H2SO4), e pelo cátion cálcio (Ca2+). Esse sal pode ser encontrado na forma de sal anidro (sem água) CaSO4, ou de sal hidratado (com água) CaSO4. 2H2O, sendo essa forma conhecida por gipsita. O CaSO4 anidro é utilizado na fabricação do giz escolar, e o caso hidratado é utilizado como gesso em medicina e na construção civil. SULFATO DE MAGNÉSIO Esse sal é formado pelo ânion sulfato (SO2/4), proveniente do ácido sulfúrico (H2SO4) e pelo cátion magnésio (Mg2+). Esse sal é encontrado dissolvido na agua do mar, mais em quantidades menores que o cloreto de sódio e o cloreto de magnésio. Comercializado pelo nome de sal amargo e também por sal de Epson, sua principal aplicação medicinal ocorre devido a sua ação laxativa. FOSFATO DE CÁLCIO (Ca3 (PO4) 2) Esse sal é formado pelo ânion fosfato (PO3/4-), proveniente do ácido fosfórico (H3PO4), e pelo cátion cálcio (Ca2+). Encontrado na crosta da terra, é um sal que constitui a matéria-prima utilizada na produção do elemento fósforo. Quando tratado com ácido sulfúrico, produz fertilizantes fosfatado. A “farinha de osso” contem fosfato de cálcio que é obtido pela calcinação de ossos de animais. 2.7 Reações de Oxi-redução • Oxidação – é a perda de elétrons por um elemento (ou o aumento de seu número de oxidação); • Redução – é o ganho de elétrons por um elemento (ou a diminuição e seu número de oxidação). Dizemos que: 34 • Oxidante é o elemento (ou substância) que provoca oxidações – ele próprio se reduzindo; • Redutor é o elemento (ou substância ) que provoca redução – ele próprio se oxidando. Os processos, envolvendo perca e ganho de elétrons, ocorrem simultaneamente, ou seja, na medida em que uma espécie se oxida, outra espécie se reduz. essas reduções são chamadas reações de óxido-redução e uma de suas características é que o número total de elétrons recebidos pela outra espécie. Isto pode ser percebido no exemplo, a seguir, analisando conjuntamente as duas semi-reações. Podemos observar nas reações de oxido-redução, o número total de elétrons permanece constante, porque o número de elétrons recebidos é igual o número de elétrons perdidos. O conceito de estado de oxidação tem origem na necessidade de descrever as mudanças que se dão em virtude dos processos de oxido-redução. Para substâncias monoatômicas simples, é conveniente e direto definir o estado de oxidação ou número de oxidação como o número atômico menos o número de elétrons existentes nos orbitais, ou, mais simples, a carga “liquida” do átomo. O estado de oxidação de um elemento em qualquer de suas formas alotrópicas é sempre zero. Enquanto que há uma relação direta entre o estado de oxidação e a carga efetiva em espécies monoatômicas, a extensão poliatômicas é menos nítidas. 2.7.1 A Oxidação nos alimentos Consistem principalmente de carboidratos, proteínas, gorduras e água. Há vários tipos de oxidação e na maioria dos casos eles ocorrem simultaneamente, principalmente nos alimentos complexos. a) A oxidação dos carboidratos na maioria, dos alimentos é evidenciado pela mudança de cor, e perda do “flavor”.essa variação de cor é frenquentemente para marrom, ligeiramente parda ou amarela. Pode- se processar reações enzimáticas. Há ainda um terceiro tipo de perda de cor em alimentos contendo pigmentos. esse tipo de reação se processa por meio de radicais livres, isto é, semelhantes aos lipídios. É catalisada por metais e depende da temperatura. Os íons metálicos são removidos por meio de quelantes. 35 b) A oxidação enzimática está associada com enzimas, tais como peroxidase, polifeniol oxidase e catalase, e na maioria das vezes termina com uma polimerização, cujo produto final são escuros ou marrons. esse tipo de reação é comumente inibidas por processamentos quente para inativação das enzimas ou por tratamento com dióxido de enxofre, sulfitos e ácido ascórbico. c) A oxidação de proteínas por si não é considerada como fator da mudança de odor ou flavor em alimentos. Proteínas são quebradas por enzimas proteolíticas e são desnaturadas pelo aquecimento e reações enzimáticas. OXIDAÇÃO LIPÍDICA Ranço – é um termo muito usado na indústria de alimentos e abrange um grande número de “flavores” desagradáveis originados da auto-oxidação de ácidos alifáticos insaturados, resultando numa mistura de componentes voláteis. Existem três tipos de deterioração que são: 1 – Deterioração oxidativa: oxidação pelo oxigênio atmosférico, autocalisada pelos próprios lipídios. 2 – Deterioração hidrolítica: ocorre por ação das lípases, principalmente nas gorduras de ácidos graxos com quatro a dez átomos de carbono. 3 – Polimerização: polímero que pode ser formado por associação direta de radicais alcoxi e alquila livres originados pela auto-oxidação lipídica. OXIDAÇÃO TÉRMICA DE ÓLEOS Certos tipos de tratamento podem resultar em baixo do valor nutricional da gordura. Pesquisas demonstram que as gorduras podem ser alteradas pelo aquecimento d gorduras há formação de polímeros. Neste caso , três tipos de mudança ocorrem nestas condições: -auto-oxidação: borbulha-se O2 (oxigênio), dentro do óleo ou da gordura fundida. -polimerização térmica: a polimerização térmica do linoteato de alquila é processado pela migração de duplas ligações para a posição conjugada. - ácido linoléico- reage com o oxigênio do ar para formar reativos hidroperóxidos particularmente por aquecimento. Uma das reações de oxido- redução que presenciamos no dia-a-dia é a 36 corrosão do ferro e também de outros metais. O metal tem a capacidade de uma espécie com o oxigênio (O2) de se reduzir (agente oxidante). A temperatura e as concentrações dos reagentes afetam as reações de corrosão. Para que o ferro sofra corrosão é necessário que ele esteja na presença de ar (O2) e água (H2O), pois o ferro se oxida facilmente quando exposto ao ar úmido. A reação de oxidação do ferro pode ser representada por: Fe → Fe² + 2e A mesma medida que o fero se oxida o O2 (g) , presente no ar e dissolvido na água se reduz .Essa redução pode ser representada por : O2 + 2H2O + 4e → 4OH . PROTEÇÃO CONTRA CORROSÃO A ferrugem pode ser evitada utilizando-se revestimentos de proteção, como tintas, graxas , óleos, esmaltes ou alguns metais mais resistentes a corrosão. Podem ser usados, também, metais que, apesar de serem mais reativos que o ferro, quando se oxidam, por um oxido que adere ao ferro, revestindo-o e protegendo-o. Quando acontece o revestimento do ferro ou aço utilizando o zinco ocorre processo conhecido por galvanização. O revestimento de zinco impede o contato do ferro com o ar e a água. Se o objeto galvanizado sofre algum “risco” o ferro fica exposto ao ar e se oxida. O zinco apresenta menor potencial de redução, portanto a sua oxidação é mais fácil de ocorrer, ou seja, ele perde elétrons com maior facilidade que o ferro. CONSERVAÇÃO DE ALIMENTOS Já a cerca de 30 mil anos atrás, o homem vivia em bandos a procura de alimentos, como frutos e animais para aproveitar a carne. Com o tempo, o homem verificou que, se a carne não fosse consumida logo, estragava. O homem percebeu que, se a carne fosse exposta á fumaça das fogueiras, durava mais que a carne crua, com isso inventou-se a primeira técnica de conservação: a defumação. Observando os frutos secos que permaneciam nas arvores e que ainda pode ser consumido, o homem descobriu outro método de conservação de alimentos: a desidratação, ou seja, a retirada de água dos alimentos. Baseado neste método, o homem começou a deixar secar ao sol ou no calor de uma fogueira, a carne da pesca e da caça. Deste modo, o homem percebeu que as carnes duravam muito mais tempo quando desidratadas. Por razoes econômicas, sociais, políticas, religiosas ou culturais, o homem sempre se viu obrigado a explorar novas religiões. 37 Para isso, fazia viagens que poderiam durar meses, daí a importância da alimentação a bordo e conseqüentemente de uma boa conservação dos alimentos. Desde o aparecimento do homem, a alimentação tem sido uma preocupação constante. Daí a importância de buscar novas técnicas de conservação dos alimentos por mais tempo, a fim de que não se deteriorem. Apenas em 1957, Pasteur descobriu a causa da deterioração dos alimentos. Pasteur descobriu que seres microscópicos eram os responsáveis pela transformação do suco da uva em vinho. Esses seres tinham a capacidade de se multiplicar rapidamente, e estavam presentes no ar atmosférico. Consequentemente com estudos posteriores Pasteur descobriu que a deterioração dos alimentos era causada por alguns destes seres: as bactérias. Existem vários tipos de bactérias, as que causam doenças, outras fermentam o leite e o vinho e ainda existem aquelas que desempenham papel fundamental na decomposição de restos vegetais, animais e as fezes. A maioria das bactérias não fabrica seu próprio alimento, e, consumido os mesmos alimentos que o homem, produz neles substancias que alteram suas características, tornando-os impróprios para o consumo humano. Para se desenvolverem, as bactérias também necessitam de água liquida e temperatura adequada. Diante disso foram criados métodos de esterilização, como a pasteurização, que reduzem o numero de microorganismos nos alimentos pela aplicação de altas temperaturas. Os alimentos também podem se estragar pela ação de um grupo de substancias chamadas enzimas. Promovendo um conjunto de reações químicas necessárias ao metabolismo da célula, essas enzimas continuam a atuar mesmo após a morte do animal ou a colheita do vegetal. Essa atividade enzimática modifica o gosto e o cheiro dos alimentos, deteriorando-os. Esse processo também depende da umidade e da temperatura: próximo a 0°C a atividade enzimática é baixa acima de 70°C, as enzimas são destruídas. É simplesmente impedir que se estraguem devido a alterações provocadas por bactérias, fungos e enzimas. Para uma boa conservação de alimentos, é necessário: Redução ou eliminação total dos microorganismos responsáveis pela deterioração; 38 - Criação de um meio desfavorável ao desenvolvimento desses microorganismos; - Criação de um meio que diminua ou acabe com a atividade enzimática. Os melhores métodos são aqueles que garantem uma conservação prolongada e proporcionam um mínimo de alterações nas qualidades naturais dos alimentos. MÉTODOS DE CONSERVAÇÃO DE ALIMENTOS A industrialização faz das formas de conservação de alimentos uma necessidade básica do homem moderno. Existem vários métodos conhecidos de conservação de alimentos, sendo que, cada método, apresenta vantagens e desvantagens. Vejamos alguns destes métodos. A defumação é o método mais antigo para a conservação dos alimentos. Consiste em expor o alimento á fumaça e, na maioria dos casos, ao calor, por certo tempo. A duração e a temperatura para a defumação dependem do produto que se vai defumar. A defumação pelo uso do calor tem por objetivo a destruição de todos, ou pelo menos a maioria, dos microorganismos e enzimas. A secagem foi o primeiro processo de conservação a usar o calor. É por ela que todos os cereais são conservados, além de algumas frutas e das carnes. Reduzindo consideravelmente a água do alimento, a secagem, dessa forma, deixa condições desfavoráveis ao desenvolvimento dos microorganismos e das enzimas, que ambos necessitam da água. Além da secagem, há a pasteurização e a esterilização, que são processos industriais que também utilizam o calor para a conservação dos alimentos. A utilização do frio na conservação de alimentos também é muito antiga, pois os povos que habitavam regiões geladas usavam a neve para conservar os alimentos. Existem duas formas de conservação de alimentos pelo frio: a refrigeração e o congelamento. Na refrigeração, os alimentos são submetidos a temperaturas próximas de 0°C. Quanto mais próximo de 0°C maior será o tempo de conservação. No congelamento, os alimentos são mantidos a temperaturas de até 30°C negativos. Nestas condições, a maior parte da água presente nos alimentos se 39 transforma em gelo, impedindo a sua utilização pelos microorganismos, pois eles necessitam da água em forma liquida. Com a falta da água para os microorganismos e a quase total redução da atividade enzimática, causada pala baixa temperatura, os alimentos podem ser conservados por meses ou anos. Nas geleiras e frigoríficos, os alimentos são mantidos sob refrigeração, e, nos freezer e congeladores, eles são armazenados congelados. Sal ou açúcar são freqüentemente utilizados para preservar alimentos. O sal é geralmente empregado na conservação de carnes e derivados; já o açúcar é empregado em geléias, frutas cristalizadas, compotas, etc. Quando sal ou açúcar é colocado em contato com os alimentos, ocorre o fenômeno da osmose. Radioatividade é o nome dado à capacidade que certos átomos têm de emitir raios e partículas capazes de penetrar, e até mesmo atravessar corpos materiais. O urânio, rádio, polônio e o plutônio são exemplos de átomos radioativos. A radiação intensa pode ser fatal a qualquer ser humano, entretanto, quando usada adequadamente, pode trazer vários benefícios á humanidade, como por exemplo, na medicina. Em meados deste século, também começou a ser usada na conservação de alimentos. Este processo de irradiação utilizada como fonte de radiação, normalmente, o cobalto-60 e o césio-137. A irradiação é utilizada para: • Destruir total ou parcialmente os microorganismos responsáveis pela deterioração dos alimentos. • Combater larvas e ovos de insetos danificadores de colheitas. • Controlar o período de germinação das sementes. Diferentes tipos de radiação são empregados em processos como a pasteurização, a desinfestação e a esterilização. Daí, a abrangência da irradiação na área da conservação de alimentos. Na pasteurização a dosagem é cerca de 10 vezes menor que a utilizada na esterilização, o que torna parcial a destruição dos microorganismos. Sabendo disso, o alimento pasteurizado deve ser mantido sob refrigeração, enquanto que o esterilizado basta a temperatura ambiente. Já a desinfestação é um processo que, através da irradiação, procura destruir larvas e ovos de insetos nos alimentos. Os fungos são uns grupos de (micro) organismos heterotróficos, isto é, incapazes de sintetizar matéria orgânica a partir de substancias inorgânicas, cujo 40 corpo é formado somente de um talo unicelular ou pluricelular. São conhecidos popularmente como bolores, cogumelos, orelhas de pau, champignons, lêvedos e trufas. Por muito tempo incluído no reino vegetal, apesar de carecerem de clorofila e possuírem características muito diferentes das que apresentam as plantas, os fungos são hoje classificados em reino independente. Algumas características são essenciais para classificar os fungos em um reino a parte. São elas: a. São aclorofilados e, conseqüentemente, heterótrofos; b. Suas células não possuem parede celulósica, mas é comum um reforço de quitina; c. O seu hidrato de carbono de reserva é o glicogênio e não o amido, como nas plantas; c. Alguns (mixomicetos) deslocam-se por movimentos ativos; d. Reprodução sexuada ou assexuada. Neste ultimo caso, por meio de esporos; e. Nutrição por digestão extra corpórea; f. Células protoplasmáticos eucarióticas, contínuos porém pluricelulares, fusionadas, sem formando membranas de filamentos separação, chamados hifas, a organização das hifas constitui um “falso tecido” a que se da o nome de pletênquima. Como se vê, as quatro primeiras características correspondem as de animais; a quinta corresponde ao que se observa com certas plantas; a sexta não é comum ás plantas e é muito rara entre os animais; a sétima é exclusivamente dos fungos. Já foram descritas cerca de cinqüenta mil espécies, mas calcula-se que tal numero possa chegar a 250.000. O fungo encontra-se em habitat muito diversos: em meio aquático, no solo, no ar, sobre partículas em suspensão ou ainda a custa das plantas e também dos animais, os quais podem ser parasitados por espécies de fungos. Os fungos aparecem em qualquer lugar que exista certo grau de umidade. Além disso, os fungos permitem a produção de antibióticos e favorecem muitos processos de fermentação. Os povos primitivos sabiam que p leite, sob determinadas condições, transformava-se em queijo; sucos de frutos forneciam, por transformações, bebidas 41 alcoólicas. Eles ignoravam que tais transformações eram promovidas por microorganismos (bactérias e fungos). No século XVIII, Lavoisier observou que quando a glicose sofria transformação, como ocorria no suco de frutos, hoje a chamada fermentação, produzida bióxido de carbono e álcool e equacionava o processo do seguinte modo: C6H12O6 2C2H5OH Glicose álcool etílico + 2CO2 dióxido de carbono Como se observa, o O2 livre não participa do processo. No século XIX, muitos cientistas concluíram que, para ocorrer fermentação, era necessária a atividade de organismos vivos e só poderia ocorrer no interior de células vivas. Pasteur verificou que, quando o vinho “azedava”, formavam-se nele certos compostos originários da atividade de fungos, que transformavam glicose em álcool etílico, e de bactérias, que transformavam álcool etílico em acido acético (que dava o sabor acre), resultando o vinagre. Em fins do século XIX, o químico Buchner determinou que para acorrer fermentação não era necessária a presença de células vivas, mas certas substancias por elas produzidas e que ele denominou zimases (hoje chamadas enzimas). Os fungos filamentosos, cujas hifas se entrelaçam formando micélio ou ramificações com conídios (esporos assexuados) nas extremidades, denominam-se bolor ou mofo. Os bolores são do grupo dos zigomicetos e são comuns sobre determinados alimentos, como o pão. Outros gêneros se desenvolvem sobre o queijo e as frutas muito maduras. Os micélios não representam verdadeiros tecidos, pois entre as hifas agrupadas não há paredes celulares, comuns, como nos parênquimas, falando-se em pletênquimas. Nos fungos mais desenvolvidos os micélios se apresentam como corpos de frutificação. Estes, ao aparecem na superfície do solo ou de um tronco podre, cresceram a partir do micélio subterrâneo que ás vezes aí viveu durante anos. Tipos de fungos também filamentosos, que se caracterizam principalmente por formar grandes estruturas. Existem corpos frutíferos, que em algumas espécies constituem-se os chamados fungos ectomicorrizicos. Há cogumelos pertencentes ao 42 grupo dos ascomicetos e dos basidiomicetos. Muitos deles são fundamentais na decomposição da matéria orgânica do solo. Os cogumelos crescem no húmus dos bosques, como saprófitos que aproveitam à putrefação ou como parasitas nas raízes das arvores, nos troncos cortados ou em troncos vivos. Os fungos mais simples normalmente se reproduzem apenas por esporos, mas no gênero Saccharomyces, responsável pela fermentação alcoólica, há gemiparidade. É extensa a nomenclatura dos esporos, que depende da sua origem e estrutura. Dependendo do processo que os produziu, são mitóticos ou meio ticos. Estes últimos sempre estão relacionados com a alternância de gerações. a) Aplanósporos Sem mobilidade própria. b) Zoósporos Com flagelos, ocorrendo em fungos aquáticos como Saprolegnia. c) Conidiósporos Muito pequenas como partículas de poeira, produzidos em fila, na extremidade das hifas. Ocorrem nos gêneros Aspergillus e Penicillium. d) Endósporos Produzido no interior de um esporângio, como no bolor comum, os gêneros Mucor e Rhizopus. e) Ascósporos Geralmente em numero de oito, no interior de um esporângio alongado, o asco. f) Basidiósporos Em número de quatro, formados numa estrutura especial, dilatada, na extremidade de uma hifa e chamada basídio. Nos fungos mais desenvolvidos, há uma típica alternância de gerações com uma fase esporofitica diplóide e uma fase gametofitica haplóide. A meiose é esporica, portanto os esporos são haplóides. Com os conhecimentos atuais, sabe-se que as leveduras não produzem uma, mas varias enzimas, cada uma delas atuante numa determinada etapa do processo da fermentação. A fermentação não é exclusiva dos protistas, mas também realizada por muitas plantas e animais, inclusive o homem. Descobriu-se depois que a fermentação é um processo energético. 43 Analisando esse histórico, podemos dizer que fermentação é uma seqüência de reações químicas na ausência de O2 livre, com a libertação de energia de moléculas orgânicas. As reações do processo são as mesmas da fase anaeróbica (glicólise) da respiração, isto é, através da formação dos mesmos compostos intermediários, uma molécula de glicose dá duas de acido pirúvico. A fermentação acética ocorre, por exemplo, quando o vinho é contaminado espontaneamente por um germe, o Acetobacter aceti. Dessa fermentação origina-se o vinagre. Na fermentação láctica, realizada pelos Lactobacilos SP., o acido pirúvico é reduzido diretamente a acido Láctico. As enterobácterias da flora intestinal realizam uma fermentação láctica mista onde se produz grande quantidade de ácido láctico, além dos ácidos acético e fórmico, álcool e gases (CO2, H2). São as seguintes as reações da fermentação alcoólica. Em resumo, teríamos. Como se verifica, o numero de moléculas de ATP formadas por molécula de glicose é menor do que no processo respiratório normal. Isso ocorre porque na fermentação o substrato não é totalmente oxidado, restando ainda muita energia no álcool etílico. CLASSIFICAÇÃO SISTEMÁTICA DOS FUNGOS Mixomicetos Fungos primitivos com características comuns ás dos protozoários, constituem massas de aspectos mucosos chamados plasmódios. Fungos primitivos cujas células em geral se desenvolvem como massas protoplásmicas Ficomicetos Arquimicetes amorfas. Parasitos vegetais, como os do gênero Plasmopora ou mílidio das videiras mofos que vivem á custa de matéria em decomposição (saprófitos), entre os quais se Oomicetes Zigomicetes contam os dos gêneros mucor e rhizopus, que se desenvolvem com freqüência no pão e nas frutas. Ascomicetos Fungos superiores que se caracterizam pelos filamentos ou hifas, fechados e uni nucleados, Hemiascomicetes paredes celulares quitinosas e esporos 44 reprodutivos gerais no interior de células Euascomicetes chamadas ascos. Leveduras que produzem diferentes tipos de fermentação. Fungos superiores, entre os quais espécies importantes como o Penicillium notatum, fonte da penicilina; o Claviceps purpúrea, produtor do esporão de centeio, também usado em medicina; e as trufas. Basidiomicetes Fungos superiores com parede celular quitinosas, que se caracterizam pela estrutura de seus esporos reprodutivos, os basídios; entre eles se encontram as ferrugens e os carvões-importantes pelos graves danos que produzem as colheitas - e todos os cogumelos, comestíveis e venenosos. 2.7.2 A importância dos fungos Muito mais do que se poderiam pensar, os fungos se relacionam as inúmeras atividades humanas, aja na indústria, na medicina, na farmacologia, seja na pesquisa biológica. Desempenham um importante papel na efetivação dos ciclos da matéria e são, juntamente com as bactérias, os principais organismos decompositores nos mais diversos ecossistemas. Eles têm uma excepcional capacidade de dispersão, graças ao elevado numero de microscópicos esporos produzidos, que praticamente ocorrem em todos os ambientes. Substâncias orgânicas como substrato, umidade e ausência de luz fraca é as condição requeridas para um bom desenvolvimento da maioria das espécies. Na indústria, varias espécies são utilizadas na produção de queijos (Camembert, Roquefort e Gorgonzola) e bebidas alcoólicas. O Saccharomyces, da fermentação alcoólica, e também usada no preparo de massas de pães e bolos. Muitos fungos servem como alimento. O champignon (Agaricus campestris) é rico em proteínas, vitaminas do complexo B e sais minerais de P e K. nos Estados Unidos, a produção anual desse fungo ultrapassa a 100 mil toneladas. 45 2.8 Cosméticos Há milhares de anos, homens e mulheres utilizam cosméticas. Arqueólogos encontraram em túmulos egípcios de aproximadamente 3.500 a.C. sinais do uso de pintura para os olhos e ungüentos aromáticos. O termo cosmético designa substancias de origens diversas, usadas sobre a pele e cabelos para limpar, suavizar, encobrir imperfeições e embelezar. Na antiga Grécia, usavam-se óleos pra banho e outros produtos de embelezamento, mas muitas mulheres sofriam de envenenamento por chumbo porque usavam mascaras faciais que continham esse metal. Em Roma, fabricam-se pós para tornar a pele mais alva, carvões para delinear os olhos e pintar cílios e sobrancelhas, carmim para as faces, produtos abrasivos para clarear dentes etc. os óleos consumidos eram produtos naturais, como os que se obtinham de azeite de oliveira, os perfumes, usados tanto por mulheres como por homens, extraiam-se de flores ou especiarias, com resinas naturais empregadas como fixadores. Cosméticos para o rosto, tinturas para o cabelo, perfumes e sais de banho já eram utilizados na Europa medieval. Atribui-se a Catarina de Médici a introdução do uso de perfumes na França. As civilizações orientais faziam amplo uso dos cosméticos, bem como os povos indígenas da América e África. No século XX, massificaram-se a produção e o uso dos cosméticos, sobretudo graças ao aperfeiçoamento das embalagens e a promoção publicitária desses produtos. Entre as embalagens da indústria de cosméticos destacam-se: o tubo descartável, em fim do século XX, e os xampus sem sabão, os laquês em aerossol, as tinturas de cabelo menos tóxicas, e a pasta de dentes com flúor, no século XX. A legislação varia da pais para pais, mas como norma procura atender a segurança dos usuários. Os principais testes empregados são referente à irritação de tecidos, danos a visão, toxidade aguda e crônica. A legislação brasileira define e classifica estas substancias tomando por base principalmente suas finalidades. Cosméticos é o produto de uso externo destinado a proteção ou ao embelezamento das diferentes partes do corpo. Produto de higiene é o de uso externo, anti-séptico ou não, destinado ao asseio ou a desinfecção corporal. 46 Perfume é o produto de composição aromática a base de substancias naturais ou sintéticas que, em concentração e veículos apropriados tenha como principal finalidade a odorização de pessoas ou ambientes. Parece, no entanto, preferível, para o estudo dos riscos e segurança destes produtos, embora conservando aquelas definições, classificá-las de acordo com as regiões do corpo para as quais vão ser usadas ou, em outras palavras de acordo com o tipo de exposição mais comum. Neste critério podemos classificar estes produtos em quatro grandes grupos: 1. Produtos para pele e unhas; 2. Produtos para o cabelo; 3. Produtos para boca; 4. Produtos para ambiente. 2.8.1 Principais produtos para pele e unha SABONETE Quimicamente são sabões, ou seja, sais de um acido graxo, produzidos usualmente pela ação de um álcali sobre óleos e gorduras naturais ou sobre ácidos graxos obtidos de óleos e gorduras naturais. Tecnicamente são produtos destinados a limpeza corporal, podendo apresentar, alem de sabões, outros agentes tenso ativos, corantes e perfumes. O sabão (ou sabonete) é conhecido há pelo menos 2.600 anos, quando os fenícios se banhavam com uma pasta fabricada a partir da fervura da banha de cabra com cinzas de madeira. Mas não foi em todos os períodos da historia que esse produto de higiene esteve em voga, muito apreciado nos termas de Roma, o sabão desapareceu do mapa depois da queda do Império Romano, na Itália - eis a origem de seu nome. Na época era consumido pelos nobres. O uso do sabão se difundiu pela população apenas dez séculos mais tarde. Então, o químico alemão Justus Vonleibrig (1803-1873), declarou que o grau de civilização de um país podia ser indicado pela quantidade de sabão consumido. Se isso é certo, o brasileiro pode ser considerado o povo mais civilizado da Terra, com um consumo de 12 sabonetes per capita. Essa medida só é menor do que os 13 sabonetes per capita dos americanos e dos australianos. 47 O farmacêutico da universidade de São Paulo Luiz Antonio Gioilli, explica que: ao aquecer a mais de 80 graus Celsius qualquer espécie de gordura com soda caustica ou outra substancia muito alcalina, eu realizo uma saponificação, ou seja, fabrico sabão. Nessa reação, formam-se moléculas com dois pólos, um solúvel em água e outro, em gordura. Em pleno banho essas moléculas de sabão ficam cravadas em cada minúscula gota de água, deixando para fora a sua metade capaz de se ligar a gordura do corpo na realidade ninguém molha o corpo inteiro. Uma olhada pelo microscópio mostra que as gotículas de liquido se espalham distantes entre si sobre a pele. Mas tudo bem, porque as moléculas de sabão, alcalinas, atraem feitas pequenas imãs aquele sebo que é acido, com pH em torno de 4,5. Seqüestrada, a sujeira oleosa é conduzida pela água, até escoar pelo ralo. Quanto mais alcalino é um sabonete, mais gordura ele consegue retirar; sabonetes alias, sempre são alcalinas, se fosse possível fabricar um sabão realmente neutro, ele não oferecerá vantagens, porque não limparia direito. A Farmacêutica, Maria Elizete, explica que: É verdade que, quanto menos alcalino é o sabonete, menos ele irrita a pele. Essa quantidade dependerá da proporção de gorduras animais e vegetais utilizadas como matérias-primas. O balanço desses ingredientes também faz um sabonete ser mais duro ou mais macio. Um dos óleos mais aplicados nos chamados sabonetes finos é o de coco. O óleo de coco, com seus doze átomos de carbono, assegura muitas bolhinhas de sabão. Espuma, contudo, não é sinal de limpeza. A massa de sabão propriamente dita, os fabricantes acrescentam ainda corantes, essenciais de perfume e uma boa dose de óleo, isto é, que não passou pela saponificação. Sua função é besuntar novamente a área da qual acabou de se tirar o sebo. Pois sem a sua gordura natural, a camada externa da pele apareceria ta qual é - um forro de células mortas e esturricadas. Fora o problema da aparência, a pele seca é muito mais suscetível a irritação. É por isso que alguns discutem se não faria mal tomar banho com sabonete mais de uma vez por dia, costume de muitos brasileiros. No entanto, em condições normais, uma a duas horas depois de você ter saído do banho, sua pele já terá recuperado a oleosidade própria. 2.8.2 Principais produtos perfumados EXTRATOS E ÁGUA PERFUMADA 48 Consistem essencialmente em solução ou dispersão de uma composição aromática (perfume) em concentrações variadas. Nos extratos sua concentração é de 30%, enquanto que nas águas perfumadas, colônias, loções, a concentração é inferior a 10% em álcool de diversas graduações. Perfume ou composição aromática é constituído por uma mistura de óleos essenciais, óleos florais, gomas, resinas, substancias de origem animal ou sintético. Estas são dissolvidas em álcool e proporção variável de água. Estes produtos podem ser considerados como praticamente isentos de riscos quando usados corretamente sobre a pele. ANTIPERSPIRANTES E DESODORANTES Antiperspirantes são produtos destinados a inibir ou diminuir a transpiração e geralmente estão associados com desodorantes, que combatem seus odores. Podem ser coloridos ou perfumados e apresentados em formas e veículos apropriados. Os principais agentes antiperspirantes são sais de alumínio, geralmente encontrados na proporção de 10-20% e as substancias desodorantes mais utilizadas são o álcool etílico e o cetílico. Além disso, podem ser encontrados nos cremes, ácido esteárico, glicerina, estearatos, essências e perfumes. As barras podem apresentar também sabões e pequenas quantidades de ceras, umectantes, corantes, etc. Para a cosmetóloga da USP, Maria Elizete Ribeiro, a função do desodorante é evitar que bactérias, habitantes das axilas, estraguem o seu esforço matutino para passear o dia inteiro limpo e, quem sabe, cheiroso. O suor aumenta durante o dia, para refrescar o corpo aquecido pelo calor do sol. Mas esse liquido em si não tem o aroma desagradável graças ao qual leva má fama. O mau cheiro é devido à degradação de seus componentes por tais bactérias. Os desodorantes são combinações de álcool, bactericidas e essências perfumadas. Ao diminuir a quantidade de bactérias, diminui a degradação e o mau cheiro. Passar perfume sobre as axilas é um habito antigo praticado há 5000 anos na Suméria. Desodorantes de fato só surgiram nos Estados Unidos, no final do século passado quando os químicos descobriram que sais de zinco poderiam inibir a produção do suor. Na época, é verdade, eles nem desconfiavam que isso acontecesse porque partículas de metal tampavam os poros. Ainda hoje, ao menos 49 na França, a maioria das pessoas continua ignorando as propriedades dos sais de zinco e de outros metais usados em desodorante de acordo com a Federação Nacional das Indústrias de Cosméticos francesas, enquanto o consumo de perfume é o mais elevado do mundo – cerca de 12 frascos anuais por pessoa -, apenas três em cada dez franceses usam desodorante, apesar de metade da população só tomar banho uma vez por semana. TALCOS E PÓS FACIAIS Talcos são produtos constituídos por substâncias pulverulentas contendo, mínimo 80% de talco. Pós faciais, também constituídos por substancias pulverulentas, são destinados a modificar a tonalidade e uniformizar o aspecto da pele. Talco é o silicato de magnésio natural finamente pulverulento. Nos talcos, alem do seu componente principal, podem ser encontrados estearato de zinco, carbonato de cálcio, carbonato de magnésio, essências e caolim. Nos pós faciais, o talco entra em geral na proporção de 25% a mais de 50%, encontram-se também carbonato de magnésio, caolim, estearatos, essências, corantes e ocasionalmente acido bórico, álcool, dióxido de titânio, etc. Talcos e pós faciais são praticamente inócuos quando usados corretamente. PREPARADOS ANTI-SOLARES, BROZEAMENTO E SIMULADORES. Preparados anti-solares são destinados a proteger a pele contra queimaduras produzidas pelas radiações de origem solar: bronzeadores têm as mesmas propriedades, mas não impedem o escurecimento da pele, enquanto que os simuladores promovem o escurecimento da pele independentemente da exposição solar. Os agentes bronzeadores, tais como, pigmentos de oxido de ferro, dióxido de titânio, p-aminobenzoatos, são adicionados na proporção de 1-5% na formula dos preparados anti-solares. Estes, em geral, são misturas de óleos, estearatos, álcool etílico, emolientes, corantes, etc. Os simuladores têm como constituintes ativos álcool etílico, sulfato de brucina, deidroxiacetona e outros solventes orgânicos. PREPARADOS PARA BANHO 50 Preparados para banhos são definidos como os destinados a perfumar e colorir a água de banho e/ou modificar sua viscosidade ou dureza. São incluídos neste grupo os óleos de banho, sais de banho e espumas. Óleos de banho são constituídos em geral por óleo da mamona, palmitos ou outros óleos vegetais e minerais, junto com corantes e essências, e às vezes álcool ou lanolina. Sais de banho podem conter vários tipos de sais, tais como, fosfato trissódico, cloreto de sódio, bicarbonato de sódio e hexametafosfato de sódio, junto com corantes e perfumes. Espumas de banho apresentam uma composição semelhante á dos xampus, em que os agentes principais são tensos ativos, como surfactantes aniônicos e em especial a alquilsulfato de sódio. CREMES DE LOÇÕES PARA PELE Grande grupo de produtos de tipos e propriedades as mais variadas, essencialmente destinadas ao embelezamento da pele, incluindo entre outros, os cremes de limpeza, os emolientes, os hidratantes, os clareadores (anti-sardas), os cremes com hormônio, cremes para face, para mãos, para uso geral, etc. Em virtude de sua grande variedade é praticamente impossível esquematizar sua composição. De um modo geral apresentam lanolina, vaselina, óleos, estearatos e água. Cremes hidratantes também contem sorbitol e trioleato de sorbitol: cremes de limpeza podem conter surfactantes aniônicos, trietanolamina e o tipo “cold cream” é constituído por óleo mineral, cera de abelha, bórax e água. Mais importantes sob ponto de vista toxicológico são os cremes clareantes (antisardas), pois podem apresentar, alem do veiculo comum, substancias potencialmente lesivas, tais como cloreto de mercúrio e cloreto mercuroso, óxido de mercúrio, hidroquinona ou acido oxálico. CREMES E LOÇÕES DEPILATÓRIAS São produtos destinados a eliminar os pêlos do corpo quando aplicados sobre a pele, sem ter efeitos lesivos sobre está, geralmente apresentados sob a forma de cremes ou ceras. 51 Os principais agentes ativos dos cremes são os tioglicolatos, encontrando-se com menor freqüência sulfetos, nas ceras as substâncias mais atuantes são as parafinas. Os tioglicolatos são colocados na formulação usualmente em concentrações que permitem um pH entre 8e 10. Embora esteja alcalinidade não seja muito intenso, o produto pode determinar irritação da pele, com eritema edema e ás vezes hemorragia subcutânea. Os produtos para unha são produtos destinados ao cuidado e embelezamento das unhas e incluem esmaltes, removedores, clareadores, removedores de cutícula, polidores, etc. Sob ponto de vista toxicológico são mais importantes os removedores de cutícula, cujos agentes ativos são alcalinos (hidróxido de potássio, por exemplo), as bases, que podem apresentar solventes variados, tais como, como acetona, dibutiftalato ou butilacetatoe os esmaltes, que contêm solventes tipos acetatos, ftalatos, fosfato tricresílico, nitro celulose e corantes. PRINCIPAIS PRODUTOS PARA O CABELO/TINTURAS CAPILARES São produtos com propriedades modificadoras da cor ou da tonalidade, destinados a tingir o cabelo, de imediato ou progressivamente. A composição destes produtos é muito variável e não á descrita na embalagem. Como em alguns ingredientes são potencialmente tóxicos, convém sempre em caso de acidente consultar o fabricante. Arena (1979) considera cinco tipos mais importantes tinturas capilares: 1. Produtos que contêm tintas vegetais como índigo e extratos de maneira. 2. Produtos que contêm pigmentos metálicos, entre os quais, cloreto de cádmio, de cobalto, cúprico e férrico ou acetato de chumbo. 3. Produtos que contêm pigmento vegetais e metálicos. 4. Produtos que contêm pigmentos de oxidação, dos quais os mais importantes usados podem ser os peróxidos de hidrogênio. Persulfatos ou perboratos. 5. Produtos que contêm pigmentos semipermanentes. AGENTES CLAREADORES DE CABELO sintéticos produtores de cores 52 São como o nome índice, produtos destinados a clarear ou descolorir os cabelos. A substância ainda mais usada para esta finalidade é o peróxido de hidrogênio (água oxigenada). Usualmente as soluções caseiras usadas como desinfetantes apresentam uma concentração de cerca de 3% (10 volumes). Como clareantes a concentração mais adequada situa-se entre 5 a 6% (17-20 volumes), mas com freqüência são usadas concentrações muito elevadas, entre 20 a 30%. Peróxido de hidrogênio em concentrações elevadas é irritante para a pele e mucosas, alem de, se usado continuamente, tornar o cabelo opaco e de difícil tratamento. PRODUTOS PARA ONDULAR CABELOS Estes produtos são definidos pela legislação brasileira como os destinados a ondular ou frisar os cabelos, de maneira mais ou menos duradoura. Os preparos de uso domiciliar apresentam em geral alcalinidade relativamente alta, sendo pó isso com freqüência acompanhada por soluções neutralizantes. Os principais ingredientes ativos são o acido tioglicólico ou tioglicolatos e amônia ou aminas. Como neutralizantes são utilizados peróxidos de hidrogênio, perborato de sódio ou de potássio. Os produtos para ondular cabelos devem ter, de acordo com a legislação brasileira, alcalinidade livre inferior a 2% em NH3 ou no máximo 10% de substancia ativa em acido tioglicólico, não podendo se pH exceder de 10. PRODUTOS PARA ALISAR CABELOS Apresentam características semelhantes aos usados para ondulação, podendo conter quantidade maiores de substancias ativas (no mínimo 15% em acido tioglicólico) e apresentar maior alcalinidade (pH até 11). TONICOS CAPILARES São definidos como produtos destinados a estimular o couro cabeludo, apresentados em forma liquida com concentração variável de álcool. Alem do álcool, óleo mineral, perfumes e corantes encontrados praticamente em todos, os demais componentes são muito diversificados. Entre eles, podemos citar, 53 apenas a titulo de ilustração e por seu significado toxicológico, acido salicílico, cânfora, cloreto de benzoalcônio, hidrato de cloral, mentol e resorcinol. XAMPUS São definidos como produtos destinados a limpeza do cabelo o do couro cabeludo pó ação tenso ativa ou ação absortiva sobre as impurezas. São enquadrados pela legislação brasileira entre os produtos de higiene. A grande maioria dos xampus tem como ingredientes básicos surfactantes aniônicos e não-iônicos, alem de perfumes, corantes e preservativos. Os produtos saponificados são usualmente constituídos por sabões de óleo de coco, de oliva, de mamona ou de soja, alem de álcool, água, glicerol, etc. Nos xampus anti-caspa, alem dos surfactantes, podem ser incluídos sulfeto de selênio, enxofre coloidal, zinco derivados de alcatrão, etc. Xampus para uso infantil devem apresentar um pH entre 7 e 8. O xampu só foi aparecer na Alemanha no final do século passado-até então, as pessoas lavavam os cabelos diluindo sabão em água. Para vender mais o produto recém-criado, os ingleses resolveram batiza-lo com um nome exótico de origem indiana-champo, na Índia quer dizer massagear. Só nos anos 50, porem, as indústrias de cosméticos começaram a transformar o xampu de produto de pura higiene, para produto de tratamento acrescentando nas formulas alguns ingredientes capazes de fortalecer os fios. No Brasil, o grande problema é que não se tem controle da quantidade dessas substancias em um xampu qualquer. Quem acabou de lavar cabeça, porem, esta com as células que revestem os fios abertos, como galho de uma arvore esbarrando uns nos outros. O atrito tem efeito certo: seus cabelos estão embaraçados. Se cabelos opacos e difíceis de pentear é sintoma de cutícula capilar aberta, então a receita de brilho e maciez é simples: basta fechar suas células. Nesse instante, entra em cena o condicionador. Alem de conter doses de ácidos graxos, para repor a oleosidade perdida com a primeira etapa da lavagem, o condicionador possui carga elétrica oposta a do xampu, ou seja, positiva. PRODUTOS PARA ASSENTAR OS CABELOS São produtos destinados a fixar ou lubrificar e amaciar os cabelos. Incluem-se neste grupo as brilhantinas, os fixadores e os laquês. 54 Brilhantinas e fixadores são geralmente constituídas por óleos minerais, lanolina, vaselina, cera de abelha, alem de perfumes, corantes, resinas, emolientes, surfactantes, etc. Laquês, usualmente apresentados em aerossóis, têm como principais ingredientes e polvinilpirrolidona (PVP), resinas plásticas ou álcool polivinilico. O propelente é usualmente um fluoro carbono. 2.8.3 Principais produtos para a boca BATONS E LAPIS LABIAIS São produtos destinados a colorir e proteger os lábios. Os batons são geralmente misturas complexas de óleos minerais ou de mamona, ceras, especialmente cera de abelha, perfumes e pigmentos de tipos os mais variados. A legislação brasileira estabelece um limite para seus componentes em 2 PPM de arsênico (em AS2O3), e 20 PPM de metais pesados (em Pb). DENTIFRÍCIOS São produtos destinados à higiene e limpeza dos dentes, dentaduras postiças e da boca. A pasta de dente foi mencionada pela primeira vez por historiadores egípcios: tratava-se de uma mistura muito abrasiva feita com pedra-pomes triturada e vinagre. Os antigos romanos trocaram o vinagre pela urina a qual se atribuíram poderes de deixar os dentes brancos. O ingrediente, um tanto exótico, foi usado até o século XVIII em diversos paises europeus. Hoje se sabe que a urina era capaz de branquear os dentes por conter amônia, substancia que continua sendo usada nas formulações. Sua composição é muito variável, entre os ingredientes podem ser citados: fosfato dicásio ou tricalcio, surfactantes, gomas, diversos tipos de essências, flurosfosfatos, agentes alcalinizantes, mentol, etc. A saliva e o esmalte do dente compartilham dois minerais, o cálcio e o fosfato, cuja tendência é passar do lugar mais alcalino para o mais acido. Desse modo, quando o pH da saliva fica inferior a 5,5 ela começa a roubar cálcio e fosfato dos dentes. Com isso, depois de certo tempo o equilíbrio acido básico volta a reinar. 55 Então, os dentes podem até tomar de volta os dois minerais. Se uma pessoa toma café açucarado, por exemplo, e não escova os dentes, inicia a degradação de substancias pelas bactérias, os dentes acabam perdendo mais minerais. Quando os dentes mais perdem do que ganham a batalha pelo cálcio e pelo fosfato, a carie aparece. Ai o flúor é a substancia ideal para reverte o processo. Ele esta presente na pasta de dente, no qual o ministério da saúde estabelece o padrão de 600 partículas por milhão (PPM) de flúor. A NOVA CARA DA MAQUIAGEM A maquiagem era uma mistura de tintas que não tinha outra função a não ser pintar e enfeitar, afirma Anton Philip Hunger, diretor da marca francesa Gueriain, famosa no mundo inteiro por seus batons, sombras e afins. Hoje, mos produtos de maquiagem são instrumentos para tratar a pele. Os rimeis lançados no ultimo ano contem ceramidas, moléculas fortalecedoras porque fazem parte do revestimento natural dos fios. É como se cada cílio descascasse, perdesse algumas ceramidas ao longo do tempo, ficando a ponto de cair. O rimel repõe esse substancia, tampando buracos. Muitos produtos, segundo Hunger, contem ainda vitaminas, hidratantes e filtros solares. Há também maior conforto na área. Entre 1989 e 1994, Hunger trabalhou duro para colocar no mercado o Kiss Kiss, então o único batom que não saia com a água da saliva e nem deixava marcas nas roupas. Ele é feito com silicone volátil em vez de ceras. As sombras, lápis e delineadores são utilizados para dar a impressão de maior profundidade ou ressaltar o brilho dos olhos. Em sua formula básica encontramos vaselina, ceras, gorduras e pigmentos. Nas mascaras para incorporar os cílios, essas substancias são acrescidas de sabão. As tonalidades marrons são obtidas por pigmentos a base de oxido de ferro. As negras, a base de carvão. A verde é extraída do oxido de cromo e a azul de um tipo de silicato. 2.8.4 Verdades e mentiras dos cosméticos As prateleiras das drogarias estão repletas de produtos que prometem embelezar a pele e extinguir as marcas da velhice. Mas nem sempre as promessas são verdadeiras. Muitas vezes, a solução esta nas academias de ginástica, nas bancas de frutas ou no consultório dos dermatologistas, como você verá a seguir. 56 ACNE O que é: distúrbio dermatológico que surge quando as glândulas sebáceas produzem secreção em excesso, entupindo os poros. As promessas: pomadas antiacne e cremes esfoliantes limpam os poros e eliminam a acne. A verdade: o tratamento deve atacar as causas do distúrbio, que podem ser disfunção hormonal, consumo indevido de remédios e até o uso inadequado de cosméticos. As lesões mais graves podem ser tratadas com acido retinóico, que promove descamações da pele, ou com isotretinoína, um derivado da vitamina A capaz de atrofiar as glândulas sebáceas. Em ultimo caso, indicam-se intervenções cirúrgicas. CASPA O que é: nome popular da dermatite seborréia, a caspa é composta por partículas de queratina, proteína que se encontra na superfície da pele, e ácidos graxos (gorduras). As promessas: xampus eliminam a caspas. A verdade: a caspa pode ser provocada por predisposição genética, disfunção hormonal ou estresse. Por isso, os xampus podem apenas minimizar o problema. Os mais indicados são os de hemamélis, de propriedades adstringentes (fecham os poros), e os antifúngicos. Estes atuam eliminando os fungos que se alimentam de queratina e liberam substancias irritantes ao couro cabeludo, provocando mais caspas. CELULITE O que é: distúrbio no metabolismo de gordura e água. As promessas: cremes e géis combatem a celulite e a gordura localizada, ativando a circulação sanguínea. A verdade: celulite não tem cura. Mas os cremes a base da raiz ginko biloba, de ação antioxidante, e celulinol, antiinflamatório e descongestionante, podem melhorar o aspecto da pele, ao dissolverem parte dos nódulos de gordura. Mas eles apresentam melhores resultados quando associados á ginástica e a dieta equilibrada. ESTRIAS 57 O que é: linhas róseas ou esbranquiçadas que surgem a partir do rompimento das fibras de colágeno e elástica da pele, após estiramento provocado, geralmente, por ganho de peso. As promessas: cremes que renovam as células e uniformizam a coloração da pele. A verdade: uma vez formadas, as estrias são irreversíveis, podendo, apenas, ser atenuadas. O tratamento mais eficaz é a base do acido retinóico. O melhor mesmo é evitar seu aparecimento com uma hidratação adequada, com o uso de cremes hidratantes. FLACIDEZ O que é; perda da elasticidade da pele. As promessas: cremes, loções e géis tonificam e enrijecem a pele. A verdade: definitivamente, não existe nenhum produto de beleza capaz de combater a flacidez. A única forma de enrijecer a musculatura de qualquer parte do corpo é o exercício físico. RUGAS O que é: as rugas surgem quando a pele desidrata e perde a elasticidade, num processo natural de desgaste. As promessas: um gama de produtos apregoa o fim das rugas: cremes e loções para hidratar a pele, vitamina A, E e C para rejuvenescer, cremes a base de colágeno e elastina, ácidos glicólico e retinóico. A verdade: vários cremes podem ajudar a repor à água da pele perdida no dia-adia, como os hidratantes a base de uréia (encontrados em frutas e cana-de-açúcar). Mas nenhum deles faz isso sozinho. A melhor hidratação ocorre de dentro para fora, com a ingestão de, no mínimo, dois litros de liquido por dia. Cosméticos com vitamina A, E e C também ajudam na prevenção de rugas, aumentando a síntese natural de colágeno e elastina, substancias responsáveis pela sustentação da pele. Uma vez instalada a ruga, pode-se somente atenua-la, recorrendo-se a métodos mais agressivos, com orientação especializada. Neste caso, os médicos indicam a aplicação de acido glicólico ou retinóico, que provocam descamação e renovação da pele. Outra novidade que acaba de chegar ao Brasil é a toxina botulinica tipo A, 58 obtida a partir da bactéria Closteidium botulinum, a mesma que ingere junto com alimentos enlatados, provoca o botulismo, doença que atinge o sistema nervoso central e pode matar em poucas horas. Aplicada na pele, no entanto, a toxina apenas impede o movimento do músculo local e, assim, as rugas desaparecem, por um período Maximo de seis meses. Mas deve ser realizada com cuidado. Se atingir músculos errados pode prejudicar a fisionomia. Outro recurso da moderna cosmetologia é a vitamina c tópica. Ele protege a pele da exposição de radiação ultravioleta, tem efeito antiinflamatório e atua na cicatrização e síntese de colágeno. ESPREMEÇÃO GERAL A celulite aparece quando células de gordura mal nutridas se deformam. A celulite surge na adolescência quando a gordura se acumula nas coxas, mas a maioria das adolescentes ainda não percebe o processo. Os adipócitos, células que guardam essa gordura, tendem a ficar inflamados. Então, incham e endurecem. Os vasos sanguíneos terminam espremidos entre eles e não transporta direito os nutrientes e o oxigênio, o que deixa essas células deformadas. Para combater o problema, as formulas mais modernas contem cafeína. A substancia expulsa o excesso de gordura de dentro dos adipócitos inflamados. Então, a consumidora não só perde centímetros como diminui o aperto para o sangue passar. A formula do laboratório francês Clarins tem a mesma finalidade. Mas no lugar de cafeína são usadas enzimas que param entre a superfície cutânea e as gorduras. Ali, elas estimulam a produção de outras enzimas, estas sim, capazes de esvaziar os adipócitos. A cafeína nos cremes mal alcança a camada gordurosa, justifica o químico Lionel de Benetti, da Clarins. Na pratica, porem, as duas estratégicas tem o mesmo efeito. Os cremes, de fato, apenas aceleram o sumiço da celulite, quando a usuária mantém o peso normal e faz ginástica. Sozinhos, não resolvem nada. Antes de usarem cosméticos é importante tomar algumas precauções. A primeira delas é observar com cuidado as informações do rotulo, como a data de validade, o registro do ministério da saúde, a existência de um químico responsável, a formulação e as instruções sobre o modo de usar o produto. Devido aos riscos de reações alérgicas com o uso destes produtos, algumas indústrias pedem para que o consumidor faça em casa o chamado “exame de toque”. O teste consiste em aplicar uma pequena quantidade de cosmético no braço ou atrás da orelha para observar 59 eventuais efeitos alérgicos antes que a substancia seja usada em maior quantidade no cabelo ou na pele. Se ocorrer alguma sensibilidade alérgica, a recomendação é procurar orientação médica para exames mais detalhados. Nestes casos, o dermatologista coloca a pele do paciente em contato com uma placa contendo 30 substancias potencialmente alérgicas, empregadas em cosméticos, alimentos e vários produtos químicos, após 48 horas, é possível identificar as reações alérgicas e as substancias que as causam. 2.8.5 Sabões e Detergentes Já nos primeiros anos da era Crista, os gauleses ferviam sebo e cinzas para fabricar uma forma primitiva de sabão. Conhecido pelos romanos e fenícios e artigo de luxo na idade media, o sabão tornou-se produto de uso generalizado a partir do século XIX. Desde a segunda guerra mundial, a fabricação do sabão a partir de materiais naturais vem diminuindo em beneficio de detergente sintético. Sabão e detergente são compostos químicos destinados à limpeza. Os detergentes são produtos sintéticos destinados a remover detritos de superfícies sólidas, lisas ou porosas. O sabão é, na verdade, um tipo mais simples de detergente e compreende todos os sais de ácidos gordurosos. Os sabões se dividem em duros, ou sódicos, e moles, ou potássios. Os sabões são fabricados com álcalis e gorduras. Tradicionalmente, a soda caustica e as gorduras eram misturadas em grandes cubas aquecidas por diferentes meios até chegar ao ponto de ebulição. O processo moderno é o da hidrolise direta das gorduras a temperaturas elevadas. Uma grande desvantagem do sabão é a sua tendência a reagir ao cálcio e magnésio da água dura, com a formação de um resíduo insolúvel motivo pelo qual tende a ser substituído pelos detergentes sintéticos. No começo do nosso século era comum a fabricação caseira de sabão pelo aquecimento, em panelas de ferro, do sebo ou gordura de boi ou de porco com solução concentrada de soda caustica. Para facilitar a reação de saponificação, era usado excesso de soda, que produzia um sabão final com forte caráter básico, o qual, muitas vezes, danificava gradativamente as mãos das lavadeiras. 60 O processo de hidrolise pode inclusive, ser feita apenas com água, em autoclaves a temperaturas elevadas, o que facilita o aproveitamento da glicerina. O acido graxo será então neutralizado por: NaOH ou Na2CO3, dando R - COONa (sabões de sódio, em geral mais duros); KOH ou K2CO3, dando R – COOKC (sabões de potássio, mais moles e usados em cremes de barbear); Hidróxidos de amônio quaternário, como, por exemplo, (CHO – CH2 – CH2) 3NHOH, dando R – COONH (sabões de amônio, que são em geral líquidos e usados, por exemplo, em xampus). De qualquer forma, o sabão mais comum é o de sódio, o qual praticamente é neutro, é o sabonete que contem glicerina, óleos, perfumes e corantes. O elemento básico do detergente é um agente de superfície ou agente tenso ativo, que reduz a tensão superficial dos líquidos, sobre tudo da água e facilita a formação e a estabilização de soluções coloidais, de emulsões e de espuma no liquido. Para penetrar na superfície e interfaces dos corpos, as moléculas do agente tenso ativo contem uma parte polar ou hidrofílica, solúvel em água, e uma parte lipofilica, solúvel em gordura. Os detergentes dividem-se em aniônicos, em que a atividade superficial é desempenhada por íons negativos (anions), catiônicos, em que a mesma é desempenhada por íons positivos, não-ionicos, cuja molécula inteira é superficialmente ativa, e anfoliticos em que a atividade superficial pode ser positiva ou negativa, de acordo com o índice de acidez (pH) da solução. COMO O SABÃO LIMPA? A água tem tensão superficial elevada, decorrente da atração (pontes de hidrogênio) entre as moléculas de sua superfície. Essa tensão superficial é responsável pela flutuação de pequenos objetos (agulha, lamina de barbear, etc.) e possibilita inclusive que pequenos insetos andem sobre a água. Os sabões são formados por moléculas que possuem uma cadeia carbônica longa, apolar e, portanto, solúvel em gorduras e também pelo grupo carboxílica (COO-), que é polar e, portanto, solúvel em água. A ação dos sabões ocorre pelos seguintes motivos: Eles diminuem a tensão superficial da água, de modo que esta possa “molhar melhor” os materiais, por isso os sabões são chamados de substancias tenso ativas; concentram as partículas de 61 óleo ou gordura em micelas coloidais, que se mantêm dispersas na água (daí os sabões são chamados de substancias emulsificantes ou surfactantes); impedem a reaglomeração das micelas, que ficam por uma película de sabão e se afastam por repulsão de cargas elétricas. 2.9 Moléculas Polares e Apolares 2.9.1 Ligações Polarizadas e não Polarizadas Na molécula H2, pode-se admitir que o par eletrônico se encontre igualmente distribuído entre os átomos, trata-se de átomos de mesmo eletro negatividade. A situação é diferente no caso do MC1. Com efeito, a maior eletro negatividade do cloro faz com que o par eletrônico comum seja mais atraído por estes ultimo do que pelo hidrogênio. Conseqüentemente, a nuvem eletrônica é mais densa próxima do cloro menos densa próxima do hidrogênio. Essa distribuição desigual da nuvem torna uma extremidade da molécula mais negativa que a outra embora a molécula em si seja neutra, pois o total de prótons é igual ao total de elétrons. Esquematicamente: + e – indicam as cargas formais, isto é, cargas divididas unicamente a distribuição desigual, da nuvem eletrônica. Na pratica, as indicações são feitas na própria formula estrutural: O raciocínio feito nos leva a seguinte conclusão: ü Ligações covalentes entre átomos de eletro negatividade igual são não-polarizadas; ü Ligações covalentes entre átomos de eletro negatividade são polarizadas; Essas polarizações são tão mais acentuadas quanto maiores for a diferença de eletro negatividade entre os elementos combinados. Assim, considerando os compostos de hidrogênio e halogênios, teremos: A polarização é mais intensa no HF, diminuindo progressivamente no HI e inexistindo no H2, representando apenas para efeito de comparação. 62 MOLECULA POLAR E APOLAR Analisemos, por exemplo, o comportamento da água, cuja molécula é angular. Chamemos as ligações de a e b: Na ligação, o par eletrônico esta mais próxima do oxigênio do que do hidrogênio. Portanto, essa ligação é covalente polarizada. Na ligação b ocorre o mesmo. Cada ligação polarizada da molécula de água pode ser representada por vetores, para os quais definimos: • Modulo proporcional a intensidade da polarização; • A direção, dada pela reta que passa pelos pólos, em seu núcleo; • O sentido, que, por convenção, vai do átomo menos eletro negativo ao mais eletro negativo, ou seja, do pólo positivo para o negativo. Como as ligações são iguais, devem ser representadas por vetores de mesmo tamanho. Somando-os pelo processo poligonal, obteremos o resultado R.. Como a soma vetorial é diferente de zero, a molécula da H2O é polar. Vejamos agora, o CO2, cuja molécula é linear. Chamemos as ligações de c e d: Na ligação c, o par eletrônico esta mais próxima do oxigênio do que no carbono. Portanto, essa ligação é covalente polarizado. Na ligação d, ocorre o mesmo. Como as ligações são iguais, podem ser representadas por vetores de mesmo tamanho. Somando-os, obteremos a resultante nula: Como a soma vetorial é igual a zero a molécula é apolar, com efeito, a verificação experimental comprova que a molécula de CO2 é apolar, apesar da diferença de eletro negatividade. Podemos concluir que, são apolares as moléculas assimétricas. Moléculas simétricas são aquelas cujo centro geométrico das cargas positivas coincide com o centro geométrico das negativas. É interessante saber que, as moléculas diatônicas formadas por átomos iguais são sempre apolares. 63 MATERIAIS E MÉTODOS A Escola Estadual Maria José – Ensino Fundamental e Médio, encontra-se localizado no Bairro Jardim São Jorge, da cidade de Anaurilândia. Funciona desde 1955, atualmente oferece Ensino Fundamental ( 5ª. á 8ª. série) e Ensino Médio. No mesmo prédio funciona a Escola Municipal Noêmia R. do Amaral oferecendo Educação Infantil e Ensino Fundamental (1ª. à 4ª. série). A Escola Estadual Maria José – EFM atende a população do bairro local e bairros adjacentes, como também alunos da zona rural. Atualmente dispõe de mais de vinte salas de aula, biblioteca, quadra de esportes, secretarias, atendendo em período matutino, vespertino e noturno um total de 1.407 alunos. Apresenta como atual diretor o professor Ivan Lisboa Leão, estando na direção desde 2008. O colégio comporta 54 professores, equipes de supervisão, coordenação, orientação e demais funcionários necessários. O projeto “O FANTASTICO MUNDO DA QUÍMICO” foi apresentado na turma da 2ª. série 'B' do Colégio, sendo a turma composta por 30 alunos, no período vespertino. Antes da apresentação do projeto, foi permitido a equipe assistir aulas de algumas disciplinas, tendo como objetivo a socialização do grupo do projeto com os alunos da sala. Fomos todos bem recebidos pela turma e professores, acompanhamos as aulas e pudemos perceber o quão dedicados e participativos são os alunos. A partir desta vivência, pôde-se compreender que a boa disciplina apresentada pelos alunos surge em decorrência da postura autônoma dos professores em sala de aula, pois, em algumas disciplinas, há cobrança contínua do conteúdo; incitando-os assim, a estar em sincronismo com os conteúdos apresentados. Por fim, é uma turma com grande interesse em aprender, principalmente construir seus conhecimentos a partir das experiências questionamentos levantados. 3.1 Encaminhamento Metodológico 1ª ETAPA Ø Constantes presenças de substancias químicas em nossa vida; realizadas e 64 Ø Substancias química acido base; Ø Indicadores. OBJETIVOS Ø Vincular o estudo da química com experiências cotidianas; Ø Identificar a presença de substancias químicas nos produtos que usamos no cotidiano; Ø Compreender substancia químicas ácidas, base suas características e aplicação; Ø Compreender a função dos indicadores. METODOLOGIA Iniciamos a aula apresentando-nos aos alunos a logo após entregamos a eles crachás para facilitar a identificação no decorrer da aula, neste mesmo momento convidamos os alunos para escolherem em cartão, que estavam enumerados de 1 a 6, estes números foram utilizados para a formação das equipes. Em seguida cada aluno recebeu uma apostila de atividades que foram realizadas por etapas. Após a socialização com os alunos entregamos a eles uma folha onde eles deveriam escrever em poucas palavras o que eles entendem por química, qual o pensamento deles quando ouvem falar a palavra química. Ressaltamos que até o final do projeto queremos saber se eles vão continuar com esta mesma opinião. A partir desta explicação convidamos os alunos a participarem da primeira atividade, ressaltando que durante a aula estaremos contextualizando os conteúdos com as ações que realizem no seu dia-a-dia. Pedimos para cada equipe relatarem quais ações que praticam e que produtos utilizam após acordarem. Em seguida entregamos a eles em embalagem de sabonete e pedimos que cada equipe leia a composição, ou seja, os ingredientes utilizados na sua fabricação ressaltam após a leitura a presença de substancias químicas neste produto, lembrando que ele é um produto industrializado. Questionamos os alunos, utilizando um cartaz fixado na parede, se os produtos naturais possuem ou não substancias química e mediante respostas enfatizamos a imagem da química relacionada apenas a produtos não naturais nocivos ao homem. Relatamos vários exemplos sobre a presença de substancias químicas no nosso corpo, no ar que respiramos, nos alimentos que digerimos (produtos naturais como frutas, verduras), procuramos através de estes exemplos despertarem nos alunos uma visão de que a química não ocorre apenas 65 em laboratório, mas sim que ela ocorre a todo instante, em situações que se quer imaginamos a química esta presente. Para explicarmos a constante presença das substâncias químicas em nossas vidas, citamos alguns produtos que utilizamos diariamente, estimulamos os alunos a citarem as propriedades de cada um, para que possamos dividi-las em grupos ácidos, bases. Logo após entregarmos aos alunos tubos de ensaio contendo diferentes soluções para que eles as classificassem, em acido ou base de acordo com seus conhecimentos para que estes sejam comprovados com a experiência (anexo A). Realizada a experiência estimulamos as equipes a relatarem para a sala suas conclusões e em seguida descreverem as mesmas na folha de atividades. Com auxilio desta experiência explicamos acido e base, suas características, aplicações e usos. Através desta atividade explicamos também indicadores fabricados em laboratório, mas que também podemos encontrar indicadores na natureza, citamos exemplos e logo após estimulamos os alunos a responderem algumas questões na folha de atividade. (anexo A). RECURSOS MATERIAIS § Cartazes; § Embalagens (rótulos); § Fenolftaleina; § Tubos de ensaio; § Conta-gotas; § Suporte para tubos de ensaio; SOLUÇÕES DE: § Acido clorídrico; § Hidróxido de sódio; § Suco de laranja; § Creme dental; § Vinagre; § Sabonete; § Limão; § Sabão em pó. 66 AVALIAÇÃO Neste primeiro momento a avaliação ocorreu de acordo com a interação de conhecimentos entre alunos e professores (estagiários), procuramos sempre utilizar os conhecimentos prévios dos alunos sobre o assunto trabalhado, proporcionando situações para que eles ampliem estes conhecimentos. Avaliamos também os alunos continuamente durante as atividades de acordo com a participação, questionamentos realização e conclusão de atividade. 2ª ETAPA CONTEUDOS ü pH; ü Reações químicas ocorridas entre nosso corpo e cosméticos: (creme, hidratante, xampu, condicionador, creme dental, etc.); ü Características dos sabões e sabonetes, com eles agem para retirar as sujeiras; ü Polaridade e apolaridade nas reações ocorridas durante uso do sabão. OBJETIVOS ü Compreender a função do pH e sua importância na sobrevivência de muitas espécies; ü Interpretar as reações ocorridas entre os cosméticos e nosso corpo; ü Compreender a função do sabão e sabonete e suas reações para retirada das sujeiras. METODOLOGIA Após as explicações sobre ácidos, bases e indicadores estimulam os alunos a responderem uma questão fixada na parede sobre pH. Após o levantamento de hipóteses entregamos aos alunos um rotulo de produto que indicava o seu pH, destacamos presença e importância do pH nos diversos produtos que utilizamos. Para estimular os alunos a construírem conceitos sobre o pH realizamos uma experiência (anexo B) e através dela desenvolvemos o assunto, sempre questionando os alunos e acrescentando novas informações, através de explicações. Após ter sido concluída a experiência, convidamos um componente de cada equipe para escolherem um dos envelopes que estavam dispostos sobre a mesa. 67 Após a escolha, verificou-se nas equipes o material contido em cada envelope, sendo reportagens sobre reações químicas ocorridas na rotina de nossa vida, como por exemplo: quando utilizamos creme dental (anexo C) quando lavamos nossos cabelos com xampu e condicionador (anexo D), quando usamos creme hidratante em nossa pele (anexo E) e também quando utilizamos sabonete e sabão para retirarmos as sujeiras (anexo F). Pedimos que cada equipe realize a leitura de sua reportagem, interpretando-a e estabelecendo relações entre o conteúdo da reportagem e ações de sua vida. Em seguida estimulamos cada equipe a exporem para a sala uma síntese da reportagem, explicando as conclusões que eles obtiveram através da leitura, compartilhando com a sala o conhecimento adquirido. Enquanto os componentes das equipes estavam explicando, um estagiário ficou responsável em auxiliá-los, sendo um facilitador na conclusão da atividade. O procedimento acima citado foi utilizado por todas as equipes, ocorrendo uma exposição de conhecimentos e troca de informações sobre as reportagens. Para indicarmos de forma mais ampla a função do sabão e sabonete, e como ocorre o processo de retirada das sujeiras, realizamos a experiência (anexo G) que proporcionou aos alunos levantamento de hipóteses e compreensão de toda a reação que ocorre entre a água o sabão e as sujeiras. Após vários comentários sobre este conteúdo os alunos resolveram as questões da folha de atividade. (Anexo) Na conclusão da atividade procuramos despertar nos alunos o interesse em compreender o lado mágico da química e suas inúmeras aplicações. RECURSOS MATERIAIS ü Cartazes; ü Reportagens; ü Embalagens de produto que identifica seu pH; ü Papel indicador universal; ü Tubos de ensaio e suporte; ü Folha da atividade; ü Vinagre; ü Sabão em pó; ü Leite; 68 ü Água; ü Suco de limão; ü Óleo; ü Sabão. AVALIAÇÃO A avaliação nesta etapa ocorreu de acordo com a participação dos alunos, levantando e concluindo suas hipóteses através da realização de experiências onde foram possíveis os alunos construírem conceitos, os contextualizado com ações de sua vida diária. 3ª ETAPA CONTEUDO: Osmose. OBJETIVOS ESPECIFICOS ü Compreender como ocorre o processo da osmose nas células vegetais; ü Distinguir os fenômenos osmóticos verificados nas células vegetais e em outros tipos de célula; ü Relacionar o processo da osmose com a desidratação humana e conservação dos alimentos; ü Compreender a sobrevivência de seres vivos através de processos osmóticos. METODOLOGIA Para iniciar mais uma etapa do projeto, pedimos para que os alunos analisassem que muitas vezes as pessoas praticam certos atos no nosso cotidiano, sem saber a explicação cientifica do mesmo, usam apenas de seu senso comum para explicar os fatos, como por exemplo, uma dona de casa somente coloca os temperos na salada minutos antes de ser servida, pois, costuma dizer apenas que a salada murcha, entrando em contato com os temperos. Será que isso tem algo a ver com a nossa ciência? Para isso, realizamos uma experiência onde os alunos verificaram como ocorre o processo da osmose nas células vegetais. Para isso, seguiram os itens descritos no procedimento. (anexo H) 69 Enquanto esperamos o resultado real da experiência, estimulamos os alunos a um questionamento, observação e levantamento de hipóteses sobre o possível resultado da experiência. Assim, verificamos as diferentes definições das equipes, sendo direcionada a turma para se chegar a um ponto comum, para a conclusão do experimento. Os alunos receberam uma folha de atividades (Anexo), para preenchimento de quadro e perguntas mediante observação e analise sobre a experiência. Os quadros e perguntas analisavam o aspecto do pimentão e o motivo pelo qual apresentou referido aspecto. Em menos de 30 minutos foi possível observar as diferentes curvaturas dos filetes de pimentão, que indicaram a entrada ou saída de água nas células do pimentão. Após a observação do resultado obtido, os alunos verificaram se suas analises estavam corretas ou não. Posteriormente a conclusão do aspecto do pimentão, sendo reconhecido o processo da osmose, apresentamos cartazes para melhor entendimento e preenchimento de novos quadros e perguntas (Anexo). Apresentamos aos alunos novos materiais como cenoura, batata, ameixa seca, para novas observações. Do mesmo modo da atividade anterior, analisamos a permeabilidade de certas membranas (pimentão, cenoura, tomate). Os alunos tiveram questões a responder, concluindo de fato o processo da osmose, através da investigação e experimentação, reconhecendo os fenômenos osmóticos, a turgescência, plasmólise e de plasmólise. Em uma segunda experiência, preparamos o “soro caseiro” (Anexo). Por meio de questionamentos, os alunos analisaram a relação existente entre a desidratação e o processo da osmose. A desidratação é quando uma pessoa perde muito liquido, tornando-se grave, caso não receba tratamento de modo adequado. Portanto, para diminuir os casos de desidratação, utiliza-se o soro que repõe as quantidades de liquido e de sais perdidos pelo organismo. Também comparamos o processo da osmose em peixes marinhos e de água doce, identificando seus comportamentos diante dos fenômenos osmóticos. E também como conseqüência do processo da osmose, esta a conservação dos alimentos, sendo explicada nas compotas e carnes salgadas. RECURSOS MATERIAIS ü Placas de petri; 70 ü Pimentão; ü Sal de cozinha (NaCl); ü Água destilada; ü Gilete; ü Açúcar branco; ü Cenoura; ü Ameixa seca; ü Batata; ü Folhas de atividades; ü Cartazes. AVALIAÇÃO Nesta etapa estimulamos os alunos a fazer questionamentos, levantamento de hipóteses e observações mediante as experiências realizadas, analisando se houve assimilação do conteúdo através da participação nas experiências e conclusão das atividades propostas. 4ª ETAPA CONTEUDO ü Oxidação nos alimentos; OBJETIVOS ESPECIFICOS ü Identificar reações ocorridas quando se prepara uma salada de frutas; ü Verificar a oxidação ocorrida em certas frutas; ü Compreender a ação de alguns ácidos que agem no processo da conservação dos alimentos. METODOLOGIA Ao decorrer desta etapa, falamos sobre algumas reações que ocorrem quando a dona de casa prepara uma salada de frutas. Estimulamos os componentes da sala a participarem, relatando quais frutas que a maioria das pessoas utiliza, e qual a maneira de se fazer uma salada de frutas. Para que se possa fazer analises mais concreta, criar hipóteses e definir conceitos realizamos alguns passos costumeiros que a dona de casa executa 71 durante a preparação da mesma, realizando a experiência: “escurecimento da maçã.” (Anexo) Enquanto esperamos o resultado da experiência, os alunos fizeram previsões sobre o aspecto da maçã e o resultado da experiência, sendo anotadas as hipóteses no quadro negro, sobre o que ira acontecer com a placa n° 01 que contem maçã e vitamina C, e o que acontecera na placa n° 02 com maçã pura. Após alguns minutos foi possível verificar o resultado da experiência, fazendo uma avaliação das hipóteses levantadas, descartando as incoerentes e enfatizando as corretas. Sendo que estas auxiliaram na resolução das atividades e conclusões, pois, os alunos receberam uma folha de atividades (anexo) para uma melhor fixação da experiência realizada. Concluíram que na placa n° 01, a maçã ficou com o mesmo aspecto inicial, não teve a cor alterada, enquanto que a placa n° 02, a maçã ficou com aspecto escuro, pois a maçã e outras frutas mudam de cor quando são descascadas expostas ao ar, ocorrendo a oxidação dos alimentos. Sendo que, a vitamina C, houve comentários sobre oxidação dos alimentos, função de alguns ácidos e sua utilização. RECURSOS MATERIAIS ü Maçã; ü Tablete de vitamina C; ü Faca ou estilete; ü Placas de Petri; ü Béquer; ü Folha de atividades; ü Cartaz. AVALIAÇÃO A avaliação nessa etapa iniciou quando os alunos relataram seus conhecimentos prévios, dando continuidade nas realizações das atividades através de relatos individuais, coletivos, e participação, seguindo para uma conclusão da experiência realizada. 5ª ETAPA 72 CONTEUDO ü Conservação dos alimentos; ü Métodos de conservação; ü Processo da pasteurização. OBJETIVOS ESPECIFICOS ü Compreender com surgiu à necessidade de conservar alimentos; ü Analisar porque os alimentos estragam; ü Identificar que os alimentos podem ser decompostos por microorganismos; ü Reconhecer condições favoráveis para o desenvolvimento de microorganismos em alimentos; ü Reconhecer processos de conservação de alimentos. METODOLOGIA Iniciamos essa atividade enfatizando que o homem, ao longo de sua historia, sentiu a necessidade de conservar os alimentos por mais tempo. A partir desta necessidade, ele criou condições que favoreciam o retardamento da deterioração dos alimentos, utilizando dessa forma vários processos de conservação, que hoje estão mais sofisticados. Questionamos os alunos sobre quais eram essas necessidades e quais os métodos e conservação utilizados, explicando posteriormente que hoje há diferentes processos de conservação de alimentos: defumação, desidratação, adição de sal ou açúcar, uso do calor (secagem, pasteurização, esterilização), uso do frio (refrigeração e congelamento), irradiação e uso de aditivos alimentares. Sendo isso apresentado em cartaz para melhor assimilação. Deixamos claro aos alunos que seriam estudados detalhadamente somente alguns dos processos de conservação. Questionamos os alunos sobre o que é a deterioração dos alimentos e qual a sua causa, estimulando as equipes a chegarem a um ponto comum sobre as alterações que são provocadas por bactérias, fungos e enzimas, que fazem os alimentos se deteriorarem. Depois de verificado com a turma o que faz um alimento estragar, anotamos no quaro negro, com base nas respostas dos alunos, as condições favoráveis e desfavoráveis para que um alimento venha a se decompor. Dando ênfase, nesta etapa, a questão da temperatura e presença de água liquida e de ar, como fatores 73 que influenciam na decomposição. Explicamos sobre cada fator e chamamos a atenção dos alunos, para a tabela de temperatura mostrada em cartaz, onde verificamos que os microorganismos se multiplicam mais ou menos conforme a temperatura. Para questionamentos e análises mais amplas sobre o assunto, cada equipe recebeu uma questão para ser discutida no grupo e depois lida e explicada para as outras equipes. As perguntas foram: • Por que a carne em uma geladeira a 7°C se estraga mais depressa do que a carne congelada? • Suponha dois alimentos, isentos de microorganismos, um deles embalado a vácuo e o outro não. Qual se conservara por menos tempo? Por quê? • Por que o leite em pó, desidratado, é mais durável que o leite comum? • Que alimento pode ser ingerido com maior segurança: um bife frito ou um quibe cru? Por quê? Chamamos a atenção dos alunos para os processos vistos muitas vezes não são suficientes ou adequadas para conservar, por muito tempo, vários tipos de alimentos. Nesses casos é necessário utilizar substancias químicas denominadas aditivos alimentares, dentre eles os conservantes, acidulantes, antioxidante, estabilizantes, etc. relembrando a vitamina C (acido ascórbico) de etapas anteriores sendo estes ácidos usados como antioxidante. Após essas explanações, demos seqüência, dando ênfase a pasteurização do leite, relembrando os alunos da necessidade de conservar os alimentos, sendo necessário para isso destruir os microorganismo que os contaminam. Mas para certos tipos de alimentos os processos de conservação, vistos anteriormente, não são adequados, como por exemplo, para o leite e outros líquidos que tem valor e composição alterados pela fervura ou adição de substâncias químicas. Assim é comum o uso do processo de pasteurização. Explicamos aos alunos o que é pasteurização, retomando a tabela de temperatura. Laçamos novamente algumas questões orais aos alunos: • Por que a pasteurização conserva o leite? • Por que, na pasteurização, o resfriamento é brusco e não lento? • O que é mais seguro: tomar leite pasteurizado ou leite recém tirado da vaca? Por quê? 74 Após esses questionamentos, entregamos aos alunos uma folha de atividades (anexo K) para conclusão do conteúdo e sendo nesta apresentada uma situação problema e algumas questões e justificativas. RECURSOS MATERIAIS • Cartazes; • Folhas de atividades. AVALIAÇÃO Nessa etapa a avaliação ocorreu de acordo com a interação de conhecimentos entre alunos e professores (estagiários), quanto aos questionamentos e relatos orais, sendo comprovada posteriormente por uma avaliação escrita. 6ª ETAPA CONTEUDO ü Conservação de alimentos; ü Temperatura e atividade enzimática. OBJETIVOS ESPECIFICOS ü Conferir reações químicas promovidas por enzimas; ü Compreender como ocorre a decomposição da água oxigenada; ü Identificar a conservação de alimentos pelo processo de desnaturação de enzimas. METODOLOGIA Retomamos nesta etapa mais um dos fatores pelo qual um alimento se estraga; por ação das enzimas, sendo reações químicas promovidas por enzimas. Para melhor analise realizamos uma experiência, onde o aluno verificou a alteração que enzimas provocam na velocidade de decomposição da água oxigenada, e de que maneira a temperatura interfere na ação de certas enzimas. Para isso foi realizada a experiência descrita no procedimento (anexo L). Após a realização da experiência, discutimos com os alunos o porquê das diferentes velocidades ocorridas com o fígado e a batata, tendo os alunos 75 preenchidos a tabela de dados. Direcionamos a turma a analisarem por meio de questionamentos, que a reação estudada nesta atividade é a decomposição da água oxigenada, ela se decompõe em água e gás oxigênio. Sendo que nas condições ambientes á decomposição é lenta, mas, na presença de certas substancias, a água oxigenada se decompõe rapidamente. Uma das substancias é uma enzima, a catalise, presente em animais e vegetais. Nesta atividade foi possível verificar a alteração que a catalise provoca na velocidade de decomposição da água oxigenada, e de que maneira a temperatura interfere na ação da catalise. Depois das hipóteses e analises do resultado da experiência, distribuímos aos alunos uma folha de atividades (Anexo), para uma geral interpretação sobre a experiência. RECURSOS MATERIAIS ü Água oxigenada (10 volumes); ü Tubos de ensaio; ü Suporte para tubos de ensaio; ü Pedaços de batata; ü Etiquetas; ü Cartaz; ü Folha de atividades. AVALIAÇÃO Avaliamos os alunos analisando se houve o desenvolvimento da capacidade de observação, propondo situações que os motivem a buscar os detalhes de determinados objetos e posteriormente seguindo uma discussão dos resultados de experimentação, construindo hipóteses, analises e conclusões, com assimilação do conteúdo. 7ª ETAPA CONTEUDO ü Fungos; ü Conservação dos alimentos. OBJETIVOS ESPECIFICOS 76 ü Identificar por meio de cultura dos fungos, em que condições ocorre o desenvolvimento dos mesmos; ü Distinguir os diversos tipos de fungos; ü Relacionar a conservação dos alimentos com as alterações provocadas pelos fungos. METODOLOGIA Dando seqüência ao estudo de conservação dos alimentos, verificamos nessa etapa que os fungos e as bactérias (vistas anteriormente), são responsáveis pela deterioração de alimentos não convenientemente armazenados. Enquanto as bactérias são seres microscópicos, os fungos vivem em colônias e são visíveis a olho nu. Para maiores analises do que são os fungos e porque eles se formam, fizemos uma experiência, elaborando um meio de cultura de fungos, observando as condições em que ocorre o seu desenvolvimento. Para se chegar ao resultado final dessa experiência seria necessária uma semana. Portanto, os alunos somente observaram as experiências prontas e analisaram o porquê dos componentes diferentes em vários aspectos. Para a realização desta experiência seguem-se os itens descritos no procedimento, (Anexo). Após explicação de como foi realizado a experiência, os alunos começaram a observar a experiência pronta, analisando porque os 5 copinhos estão com diferentes aspectos e qual o motivo que fez com que aparecessem os fungos. Anotamos no quadro negro as hipóteses levantadas pelos alunos, para que, posteriormente, quando explicarmos o resultado da experiência, possamos verificar as hipóteses corretas ou não. Para melhor compreensão do que aconteceu nos 5 copinhos, os alunos responderam algumas questões (Anexo), para facilitar a assimilação do conteúdo. Para encerrar esta etapa ressaltamos, com auxilio dos alunos, que os métodos de conservação de alimentos procuram não só eliminar os microorganismos, mas também retardar o desenvolvimento e multiplicação dos sobreviventes, para isso, criam-se condições que dificultam esses processos. Locais com bastante alimento, umidade e acidez moderada favorecem o desenvolvimento dos microorganismos a temperatura ambiente. O frio, o aumento de acidez ou não-contato do alimento com o meio ambiente é, portanto, processos que podem auxiliar a conservação. 77 Para finalizar o projeto: ”o fantástico mundo da química”, pedimos para que cada aluno escrevesse sobre a visão que tem da química, a partir das práticas realizadas na sala e relacionadas com o dia-a-dia. Ressaltamos para os alunos que a ciência é explicada por meio de observações, experiências e interpretações, principalmente sobre assuntos polêmicos e interessantes ligados à química. E que, para desenvolver o senso critico a capacidade de questionar e refletir sobre hábitos e fenômenos químicos é preciso aprofundar nossos conhecimentos através de pesquisas e experiências, pois, a química e outras ciências não estão limitadas somente as pesquisas de laboratório e a produção industrial; no nosso cotidiano ocorrem complexas reações que podem ser utilizadas pelo professor como subsídios para o desenvolvimento de uma aula dinâmica, com grande valor pedagógico. AVALIAÇÃO A avaliação é um processo continuo, sendo necessário para o professor e o aluno, pois possibilita ao aluno a realização de uma analise das alterações ocorridas durante sua interação com o que lhe foi transmitido, e ao professor verificar se ocorreu a assimilação do conteúdo por parte do aluno. A avaliação deve reintegrar o aluno no processo de aprendizagem, abrindo espaço para o aluno repensar o conteúdo, para descobrir os seus erros e construir seus próprios conhecimentos. Então avaliamos os alunos quanto a capacidade de observação, participação dos alunos quanto aos questionamentos, hipóteses levantadas, e elaboração de conceitos. Também verificamos se houve assimilação do conteúdo com atividades e praticas desenvolvida pelos mesmos. 78 RESULTADOS E DISCUSSÕES Em nosso trabalho abordamos encontrar com mais ênfase o local que a Química esta presente em nosso cotidiano. Assim, como Lopes ( 2003), relata que as disciplinas, de uma forma geral, compreendem saberes com bases epistemológicas mais ou menos explícitas, porém não são essas bases epistemológicas que definem a concepção de disciplina escolar. Trabalho com quatro princípios teórico-metodológicos que se interconectam e se sustentam mutuamente, configurando o entendimento de que disciplinas escolares são diferentes de disciplinas científicas e acadêmicas. De acordo com esses quatro princípios, a disciplina escolar é: 1) uma construção sócio-histórica; 2) uma tecnologia de organização curricular; 3) um produto da recontextualização de discursos; 4) um híbrido de discursos curriculares. A avaliação é um processo contínuo, sendo imprescindível para o professor e o aluno, pois possibilita ao aluno a análise das alterações ocorridas durante sua interação com o que lhe foi transmitido; e ao professor verificar se ocorreu a assimilação do conteúdo por parte do aluno. A avaliação deve reintegrar o aluno no processo de aprendizagem, abrindo um espaço onde o educando possa repensar o conteúdo, descobrir seus erros e construir seus próprios conhecimentos. Avaliamos os alunos quanto à capacidade de observação, participação quanto aos questionamentos, hipóteses levantadas e elaboração de conceitos. Também foi verificado se houve assimilação do conteúdo com as atividades e práticas desenvolvida pelos mesmos. Assim, ainda podemos refletir positivamente com Rosa e Tosta (2005) p. 260 em relação ao ensino da Química: Parece-nos que, nessas manifestações, a química é tão ampla que a palavra “tudo”, por si só, dá conta de dizer sobre a importância do seu lugar. Pensar que ela está em tudo também pode contribuir para o fortalecimento de uma visão poderosa da química, de um conjunto de conhecimentos, fenômenos e coisas que constituem o real, considerado na sua totalidade. Essa concepção está presente nos discursos de muitos educadores químicos que colocam a química em tudo para consolidar sua relevância. 79 CONSIDERAÇÕES FINAIS Sem sombra de dúvidas a idealização, construção e apresentação de um projeto de estagio é uma das etapas mais importantes do curso que estamos concluindo. Em se tratando de ciências, a expectativa tornou-se ainda maior, pois desde o ano anterior, quando apresentamos em metodologia e prática de ensino e estagio supervisionado em ciências; o projeto “Experiências e descobertas na cozinha”, já tínhamos pretensões e objetivos para nossa apresentação de estagio junto aos alunos do Ensino Fundamental, neste ano. Convém ressaltar que foram realizadas mudanças significativas no projeto anterior. Tinha-se a idéia de desenvolver um tema mais abrangente, pois como havia o monitoramento da professora de estagio, surgiu a idéia de também trabalhar a química do charme, cosméticos. No primeiro momento houve um certo receio do trabalho não ser bem aceito pelos alunos do Ensino Fundamental, mas a partir do momento em que existiu o aprofundamento nas leituras sobre este assunto, percebeu-se o quão estimulante era o tema, que permitiria realizar um trabalho instigante e contextualizado. Antes da apresentação do projeto assistimos quatro aulas na 2ª serie B, onde fora possível estabelecer um prévio conhecimento da turma. A primeira impressão que tivemos foi a de que o ambiente era favorável para o desenvolvimento dos conteúdos e para alcançar os objetivos almejados. Logo no primeiro dia do desenvolvimento do projeto a turma nos surpreendeu com sua participação; acreditamos que a aula teve tanto êxito por estarmos trabalhando com substâncias comuns da vida de cada um, e partindo das próprias experiências dos alunos procurávamos incentivá-los a construir conhecimentos sobre a química, sempre relacionando estes conhecimentos com suas ações diárias. Uma de nossas preocupações era de ter quebras de conteúdos durante as aulas, mas tudo transcorreu tão bem que no primeiro dia trabalhamos reações com cosméticos, produtos de higiene e no segundo dia desenvolvemos assuntos relacionados a alimentação, conservação etc. Ao findarmos o segundo dia do projeto estávamos realizados com a excelente participação da turma, onde percebemos a satisfação de cada um de ter construído conhecimentos, partindo de ações tão simples de sua vida cotidiana. 80 Além disso, como relata Nóbrega et al (2005) p. 5: O aprendizado de Química pelos alunos de Ensino Médio deve possibilitar aos mesmos a compreensão tanto dos processos químicos em si quanto da construção de um conhecimento científico em estreita relação com as aplicações tecnológicas e suas implicações ambientais, sociais, políticas e econômicas. Como já dissemos, este projeto superou todas as expectativas e, sem dúvida nenhuma, foi uma experiência de suma importância para o crescimento como educador. 81 REFERÊNCIAS BIBLIOGRÁFICAS Anuário Guia corpo e corpo de qualidade de vida, [S.I.]: Globo, 1992. p. 52; 137138. CAMARGO, Geraldo de Carvalho. Química moderna 1., São Paulo: Ática, 2002. p. 175-176 e 194 a 211. ____. Química moderna 2. 1. ed., São Paulo: Scipione, 1995. p. 249-253; 261264. ____. Química moderna 3. , São Paulo: Ática, 2002. p. 420-422. Ciência hoje na Escola. Química dia-a-dia. Rio de Janeiro: Global, 1997. p. 2021; 69. FONSECA, Albino. Biologia – segundo grau e vestibulares. 34. Ed. São Paulo: Ática, 1992. p. 89-90; 142. JOLY, Ayrton Brandão. Botânica – introdução à taxonomia vegetal. 12. Ed. São Paulo: companhia Editora Nacional, 1998. p. 69-70. JUNIOR, César da Silva; SASSON, Sezar. Biologia 2 – seres vivos, estrutura e função. São Paulo: Atual, 2006. LOPES, A. R. C. Hibridismo de discursos curriculares na disciplina escolar química. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE QUÍMICA, 26., 2003, Poços de Caldas. Workshop: A pesquisa em educação química no Brasil: abordagens teórico-metodológicas. Poços de Caldas: [s.n.], 2003. 82 LUTFI, Mansur. Cotidiano e Educação em Química. [S. I.]: Livraria Unijuí, 1988. P. 98-125. NÓBREGA, O. S., et al. Química – Volume Único. 1° Edição. São Paulo: Ática, 2005. PERUZZO, F. M., CANTO, E. L. Química na abordagem do cotidiano. Volume Único, 3° Edição. São Paulo: Moderna, 2007. SOARES, José Luis. Biologia Básica. 9. ed.; São Paulo: Spione, 2004. p. 37-42; 121; 124; 343-345. Revista Super Interessante. Ano 11. N° 1, Janeiro, 1997. Editora Abril. p. 38-45. Revista Globo Ciências. Ano 6, n° 66. Janeiro, 1997. Editora Globo. p. 23 a 31. SILVA, Eduardo Roberto da; HASCHIMOTO, Ruth Rumiko. Conservação de Alimentos. São Paulo: Scipione, 2001. p. 5-23, 53-56. ROSA, Maria Inês Petrucci; TOSTA, Andréa Helena. O lugar da química na escola: movimentos constitutivos da disciplina no cotidiano escolar. Ciênc. educ. (Bauru), Bauru, v. 11, n. 2, ago. 2005 . Disponível em <http://www.scielo. br/scielo.php?script=sci_arttext&pid=S15162005000200008&lng=pt&nrm=iso>. Acesso em 10 nov. 2009. USBERCO, João; SALVADOR, Edgard. Química Geral 1. 12. Ed. São Paulo: Saraiva, 2006. p. 267-272; 326-240. ____. Química Geral 2. 7. Ed., São Paulo: Saraiva, 2005. p. 339-446, 351-353, 425-429. ____. Química Geral 3. 1. Ed., Sã Paulo: Saraiva, 1995. p. 394-395. 83 ANEXOS ANEXO “A” Experiência: “Reconhecendo ácidos e bases” Material: ü Tubos de ensaio; ü Estante para tubos de ensaio; ü Suco e laranja; ü Sabonete (dissolvido em água); ü Creme dental (dissolvido em água); ü Vinagre; ü Detergente; ü Conta-gotas; ü Tornassol; ü Fenolftaleina; ü Hidróxido de sódio; ü Acido clorídrico. PROCEDIMENTO 1: Observe as soluções contidas em cada tubo de ensaio. No tubo de ensaio contendo a solução de acido clorídrico goteje 2 a 3 gotas de fenolftaleina, faça o mesmo no tubo de hidróxido de sódio e observe o que aconteceu. Classifique as outras substancias em acido ou base de acordo com seus conhecimentos. Em seguida goteje 2 ou 3 gotas de fenolftaleina em cada uma das soluções contidas nos tubos de ensaio, observe a cor adquirida, anote na tabela e classifique 84 as soluções em acido ou base, corrigindo alguma duvida da fase de levantamento de hipóteses. Soluções Antes da experiência Cor adquirida (acido ou base) indicador pelo Após a experiência (acido ou base) Suco de laranja Sabonete Creme dental Vinagre Detergente Limão Responda: 1. A azia é normalmente provocada por uma produção excessiva de determinado acido. Qual é o nome desse acido? R: _________________________________________________________________ 2. Qual o nome do produto de uso doméstico que contem acido acético? R: _________________________________________________________________ 3. Quais as características dos ácidos? R: _________________________________________________________________ 4. Dê exemplos de ácidos que encontramos no nosso dia-a-dia? R: _________________________________________________________________ 5. Um produto utilizado como antiácido estomacal é base ou acido. Qual o nome deste produto? R: _________________________________________________________________ 85 ANEXO “B” Experiência: “Descobrimos a pH das soluções” Material: ü Tubos de ensaio com suporte; ü Papel indicador universal; ü Vinagre; ü Sabão em pó; ü Leite; ü Coca-cola; ü Leite de magnésia; ü Água; ü Suco de limão. Procedimento: Mergulhe uma tira de papel indicador universal em cada solução. Em seguida observe a coloração que o papel adquiriu, comparando-o com a barra de cores padrão, afirmando quanto vale o pH de cada solução. Responda: 1. Através da experiência podemos afirmar que o pH ________________________ 2. Complete: Quanto mais acida for à solução _________________________________________ Quanto mais básica for à solução ________________________________________ Soluções com pH igual a 7 é uma solução _________________________________ 3. Anote na tabela abaixo quanto vale o pH de cada solução: Soluções Vinagre pH Acido, base ou neutro. 86 Sabão em pó Leite Coca-cola Leite de magnésia Água Suco de limão 4. Leia a reportagem e faça uma síntese. ___________________________________________________________________ 87 ANEXO “C” DENTES MAIS FORTE As bactérias da boca são boêmias, aproveitam a noitada para devorarem restos de alimentos entre os dentes. A festa é facilitada pela diminuição da saliva na madrugada, afinal esse liquido vive expulsando algumas bactérias goela abaixo. Os restos de comida se depositam nos dentes compartilham a famosa placa bacteriana que deixa a saliva acida que é péssimo para os dentes. A saliva e o esmalte do dente compartilham dois minerais, o cálcio e o fosfato cuja tendência é passar do lugar mais alcalino para o mais acido. Desse modo, quando pH da saliva fica inferior a 5,5 ela começa a roubar cálcio e fosfato dos dentes. Quando os dentes mais perdem do que ganham cálcio e fosfato ocorre a desmineralização do esmalte e a carie aparece. Para reverter este processo é recomendável o flúor, ele deve estar presente nos cremes dentais. A função do flúor é construir uma barreira de minerais. Assim a saliva, quando estiver acida, passa a retirar cálcio e fosfato dessa barreira em vez de retirá-los do próprio dente. Alem disso o flúor deixa a saliva supersaturada de cálcio e fosfato, acelerando a remineralização do esmalte. Contudo, há flúor e flúor. Algumas formas químicas da substancia reagem com o? Chamado abrasivo, que é um silício que serve para retirar mecanicamente a sujeira ao ser esfregado no dente. A reação cria um flúor inativo que não serve para nada. Como o xampu e o sabonete, a pasta de dente também possui ácidos graxos na forma de detergente para amolecer a placa bacteriana e os restos de alimentos. “Esse detergente não pode fazer espuma se não a pessoa engasgaria”. Mas não podemos esquecer que também devemos utilizar boas escovas de dente, pois são elas que fazem o serviço pesado. RISCOS QUE OS ROTULOS PODEM ESCONDER: CREME DENTAL: ü Conservantes (quaternium 15, formaldeido) causam inchaço e irritação das gengivas. 88 ANEXO “D” CABELOS LIMPOS... Você molha a cabeça, espalha o xampu, massageia deixar formar bastante espuma, enxágua; passa o condicionador, enxágua novamente e pronto. ONDE ESTA A QUÍMICA? Segundo estudiosos, cada um dos 300.000 fios de uma cabeleira são revestidos por células transparentes chamadas de cutícula, elas ficam sobrepostas como telhas de uma casa. Ao escorregar o fio abaixo, o sebo secretado pelo couro cabeludo não fica apenas na cutícula, mas entra nas frestas entre as células. Graças a sua carga elétrica o xampu ergue essas células também chamadas de escamas e retiram o sebo acumulado entre elas. Quem acabou de lavar a cabeça esta com as células que revestem os fios abertas umas esbarrando nas outras. Resultado: o atrito tem efeito certo, seus cabelos estão embaraçados. ... E FÁCEIS DE PENTEAR. Se os cabelos opacos e difíceis de pentear são sintomas de cutícula capilar aberta, então a receita de brilho e maciez é simples: basta fechar as células, neste instante entra em cena o condicionador, que alem de conter doses de ácidos graxos para repor a oleosidade perdida com a lavagem, o condicionador possui carga elétrica oposta a do xampu, ou seja, positiva. Portanto o condicionador fecha as escamas e deposita nutrientes para os fios. RISCOS QUE OS ROTULOS PODEM ESCONDER: XAMPU: ü Essências podem provocar reações alérgicas e respiratórias; ü Conservantes do tipo e detergente podem provocar reações alérgicas cutâneas caracterizadas por vermelhidão e ardência. 89 ANEXO “E” A QUIMICA DO CHARME Com seus aromas insinuantes, suas cores magnéticas e sua virtude de mudar as aparências, os cosméticos sempre foi uma arma dotada de poder e mistérios. Os cosméticos são classificados em dois grupos: as loções que tem pequenas gotas de óleo dispersam em água e os cremes que tem pequenas gotas de água dispersam em óleo. Esse componente oleoso forma uma fina película protetora sobre a parte exterior da pele, a epiderme-camada celular superficial, sem irrigação sanguínea, composta em sua face exterior por células mortas e placas córneas. Essas placas são formadas por uma proteína insolúvel, fibrosa e dura chamada queratina. Sua função especifica é proteger a pele das ações do vento, frio, água e luz, mantendo sua umidade. É sobre essa camada córnea, que os cosméticos agem, impedindo a perda da umidade produzida pelas glândulas sebáceas ou removendo seus excessos. Nenhum cosmético poderá rejuvenescer a pele. Cremes e loções podem no máximo, retarda a ação do tempo, diminuindo os efeitos da ação do sol, do vento e da água, que ressecam a pele e aceleram o envelhecimento. COMO POR EXEMPLO... Se os espelhos mostrassem o que realmente acontece com a pele, a imagem seria a de um bombardeio. Há substancias que tentam reconstruir a pele arrasada. Elas agem na área intermediaria a derme, e por isso são remédios. Pois, os cosméticos têm somente atuação limitada aos 06 milímetros superficial, a epiderme. Quando os cremes atingem só a superfície, as células já estão no final do seu ciclo de vida e ai resta pouco fazer. Por isso os cremes vãos cada vez mais fundos dentro de seus limites, para que ajam na ultima camada da epiderme, onde as células nascem. A pele envelhece em função do sol e dos poluentes. Ao queimarem nutrientes, as células produzem o seu próprio lixo. São toxinas e radicais livres. Com o ataque do sol e da poluição, o lixo celular aumenta ainda mais, corroendo as fibras de colágeno. Sem boa sustentação, as camadas da pele saem de lugar, criando vales e montanhas. Os vales são rugas. Os novos cremes usam mono cápsulas tão pequenas que escorregam nos vãos entre as células. Quanto mais descem, mais 90 estreitos se tornam os corredores intercelulares. Apertadas, as cápsulas estouram. Ou são destruídas por enzimas. Assim, liberam vitaminas e outras substancias para reparar danos. RISCOS QUE OS ROTULOS PODEM ESCONDER ü Veiculo pode provocar acne e dermatites. ü Conservantes podem causar irritação cutânea. 91 ANEXO “F” HORA DO BANHO Depois de um longo dia de atividades, encontramos depositados em nossa pele uma mistura de suor, com uma película oleosa e poeira. Esta mistura forma uma película protetora, pois como o suor é acido ele dificulta a sobrevivência de microorganismos nocivos; já o sebo reveste certas brechas que serviriam de entrada para germes. Esta camada faz com que a pele fique cada vez mais pegajosa, o melhor remédio é o BANHO. Em pleno banho ocorre uma reação onde se formam moléculas com dois pólos, uma solúvel em água outra em gordura. Essas moléculas de sabão ficam cravadas em cada gota de água, deixando para fora a sua outra metade capaz de se ligar a outra, que é a gordura do corpo. As moléculas do sabão (sabonete) são alcalinas e atraem aquele sebo que é acido com pH em torno de 4,5. Quanto mais alcalino é um sabonete mais gordura ele consegue retirar. Sabonetes são sempre alcalinos; alias se fosse possível fabricar um sabão neutro ele não ofereceria vantagens, porque não limparia direito. 92 ANEXO “G” EXPERIENCIA: “DESCOBRINDO A FUNÇÃO DO SABÃO” MATERIAL: ü Béquer com água; ü Óleo de cozinha; ü Pedaços de sabão; ü Palito de sorvete. PROCEDIMENTO: a) Pegue o béquer com água acrescente algumas gotas de óleo e observe o ocorrido. b) Adicione pedaços de sabão e mexa com o palito de sorvete a solução. RESPONDA: 1) O que ocorreu quando se acrescentou óleo na água? R: _________________________________________________________________ 2) Estabeleça relações entre esta experiência, com o fato de não tomarmos banho com água? R: _________________________________________________________________ 3) O que você pode observar quando se acrescentou o sabão? R: _________________________________________________________________ 4) Por que o sabão remove sujeiras e gorduras? R: _________________________________________________________________ 93 ANEXO “H” EXPERIENCIA: “OSMOSE EM CELULAS VEGETAIS” MATERIAL: ü Gilete; ü Três placas de Petri (ou pires); ü Um pimentão; ü Sal de cozinha; ü Água. PROCEDIMENTO: a. Com a gilete, corte nove filetes de pimentão, retos, do tamanho equivalente a um palito de fósforo. b. Coloque três filetes em cada placa (ou pires), com água filtrada. No 1° pires não acrescente nada, no 2° pires, coloque uma pitada de sal e no 3° pires, duas pitadas. c. Observe o que aconteceu nos três pires. RESPONDA: 1. O que acontecera no 1° pires? R: _________________________________________________________________ ________________________________________________________________ 2. O que acontecera no 2° pires? R: _________________________________________________________________ ________________________________________________________________ 3. O que acontecera no 3° pires? R: _________________________________________________________________ _________________________________________________________________ OBSERVE O RESULTADO DA EXPERIENCIA E RESPONDA: 1. O que aconteceu: § No 1° pires: ____________________________________________ § No 2° pires: ____________________________________________ § No 3° pires: ____________________________________________ 2. No 1° pires, o solvente fluiu para dentro ou para fora do pimentão? Por quê? R: ______________________________________________________________ 3. No 3° pires, o solvente fluiu para dentro ou para fora do pimentão? Por quê? 94 R: ______________________________________________________________ 4. Explique os termos: § Turgescência: ___________________________________________ § Plasmólise: _____________________________________________ § Deplasmólise: ___________________________________________ 95 ANEXO “I” SORO CASEIRO MATERIAL: ü Uma colher de chá rasa de sal de cozinha; ü Quatro colheres de sopa cheias de açúcar; ü Um litro de água fervida e já fria. PROCEDIMENTO: a) Dissolva o sal e o açúcar no água. O soro deve ser usado dentro de 24 horas, consumido em pequenas quantidades. Há também envelopes com ingredientes do soro, nas secretarias de Saúde. RESPONDA: 1) Qual a importância do soro caseiro para diminuir a desidratação? R: _________________________________________________________________ OSMORREGULAÇÃO NOS PEIXES Os peixes exercem a osmorregulação por meio de mecanismos diversos. Os peixes de água doce são hipertônicos em relação à água dos rios e lagos. Por isso sofrem intensa entrada de água nas suas células. Como os peixes se comportam para evitar a turgescência? R: ___________________________________________________________________ ___________________________________________________________________ 96 ANEXO “J” EXPERIENCIA: “ESCURECIMENTO DA MAÇÔ MATERIAL: ü Uma maçã ü Um comprimido efervescente vitamina C; ü Uma faca ou estilete; ü Um béquer; ü Água; ü Duas placas de petri (ou pires). PROCEDIMENTO: ü Divida a maçã ao meio, retirando sua casca, coloque cada metade, cortada em cubos em uma placa de petri. ü Depois de divida e separada nas duas placas, acrescente na placa n° 1, um comprimido efervescente de vitamina C, diluído em água e na outra placa, não acrescente nada. ü Aguarde mais ou menos 10 minutos e observe o que aconteceu. 1) Analisando a experiência realizada, responda: a) O que acontece com a maçã e outras frutas, quando descascadas e expostas ao ar? b) Qual a função da vitamina C? (acido ascórbico) 97 ANEXO “K” 1) Compare o tratamento dado ao leite por três pessoas, após comprarem leite pasteurizado e mantido em geladeira. Pessoa 1: ferve o leite e o deixa esfriar a temperatura ambiente (em torno de 25ºC) antes de toma-lo. Pessoa 2: coloca o leite gelado em uma leiteira e o deixa atingir a temperatura ambiente (em torno de 27ºC) antes de toma-lo. Pessoa 3: mantém o leite na geladeira e o toma gelado. a) Qual dessas pessoas corre menos risco de ingerir microorganismos causadores de doenças? R: _________________________________________________________________ b) Por que as outras pessoas correm maior risco? R: _________________________________________________________________ 2) Justifique a frase que geralmente vem impressa na embalagem do leite pasteurizado. “Não precisa ser fervido, guarde em geladeira”. R: _________________________________________________________________ 98 ANEXO “L” EXPERIENCIA: “TEMPERATURA E ATIVIDADES ENZIMATICA” MATERIAL: ü Água oxigenada (10 volumes); ü Seis tubos de ensaio; ü Suporte para tubos de ensaio; ü Três pedaços de fígado (um cru e á temperatura ambiente, um cru e congelado, e outro cozido); ü Três pedaços de batata (nas mesmas condições que os de fígados); ü Seis etiquetas. PROCEDIMENTO: 1. Numere os tubos de ensaio de 1 a 6. Adicione a cada um deles água oxigenada até cerca de 2 cm de altura. 2. Adicione nos tubos 1, 2 e 3 o pedaço de fígado cru congelado, o de fígado cru a temperatura ambiente e o fígado cozido, respectivamente. 3. Compare a velocidade com que o oxigênio sai dos tubos de ensaio. Anote suas observações na tabela de dados, utilizando as legendas: XXX: saída do oxigênio muito pronunciada XX: saída de oxigênio moderada X: não se percebe a saída de oxigênio. 4. Repita os procedimentos 2 e 3, substituindo os tubos 1, 2 e 3 pelos tubos 4, 5 e 6, utilizando os pedaços de batata. 1) Com bases nas observações feitas sobre a experiência, preencha a tabela de dados. Tubo Material Velocidade relativa da saída de oxigênio 01 Fígado cru congelado 02 Fígado cru a temperatura ambiente 03 Fígado cozido 04 Batata crua congelada 05 Batata crua a temperatura ambiente 06 Batata cozida 2) Houve decomposição de água oxigenada em todos os testes realizados? R: _________________________________________________________________ 3) Em que condições experimentais a catalise decompõe mais rapidamente a água oxigenada? Em que condições decompõem mais lentamente? R: _________________________________________________________________ 99 4) Quando um alimento é cozido, sua temperatura atinge aproximadamente 100ºC. Qual o efeito causado por essa temperatura a atividade enzimática? R: _________________________________________________________________ 100 ANEXO “M” EXPERIENCIA: “OBSERVANDO O CRESCIMENTO DE FUNGOS” MATERIAL: ü Cinco copinhos plásticos, numerados de 1 a 5; ü Saco plástico; maisena; ü Óleo; ü Colher de sopa; ü Panela pequena; ü Copo de vidro; ü Vinagre; ü Água. PROCEDIMENTO: 1) Coloque duas colheres (de sopa) de maisena e um copo de água numa panela e misture. 2) Leve a panela ao fogo para engrossar a mistura, mexendo até que ela adquira a consistência de papa. 3) Despeje a papa de maisena até a metade dos cinco copinhos plásticos. 4) Cada copo deve receber o seguinte tratamento; Copo n° 01: deixar aberto Copo n° 02: cobrir imediatamente com plástico, vedando por completo. Copo n° 03: cobrir a papa com uma camada de óleo. Copo n° 04: cobrir a papa com uma camada de vinagre. Copo n° 05: deixar aberto. Manter os copos 1 a 4 no ambiente, e o 5 na geladeira. 5) Durante uma semana, observe diariamente os copos. ANOTE SUAS OBSERVAÇÕES. 1. Com base nas observações feitas sobre a experiência, preencha o quadro. Copo Como ficou? Por quê? N°01 N°02 N°03 N°04 N°05 2. Em que copo o aparecimento de fungos foi mais rápido? E em qual foi mais lento? R: _________________________________________________________________ 3. Com base nas suas observações, indique as condições mais favoráveis ao desenvolvimento de fungos? R: _________________________________________________________________ 101 “ANEXO N” LISTA DE ALUNOS DA 2° SÉRIE DO ENSINO MÉDIO DA E.E. MARIA JOSÉ 2009 1. Alex Luiz de Oliveira. 2. Alex Sandro Chott da Silva. 3. Amanda Izaura Dias. 4. Ariane Aparecida Olgado Folc. 5. Bruna Letícia da Silva. 6. Bruno Kioshi Oda da Silva. 7. Daisy Vieira da Silva. 8. Danielle Andrade. 9. Denise Octaviano. 10. Diego Aparecido de Oliveira. 11. Edvandro de Souza Figueiredo. 12. Everton Saturnino Lessenko. 13. Fábio Henrique Milani. 14. Fernanda Graziele Ferreir. 15. Franciele Cristina Alves. 16. Franciele Milani Coutinho. 17. Hermelina de Carvalho. 18. Jaidson de Jesus Silva. 19. Juliana Ramos fraga. 20. Lais Carla Gandorfo. 21. Leandro Alves. 22. Leandro Ricardo da Silva. 23. Nayara da Silva Barbero. 24. Nayara Martins. 25. Pâmela Aparecida Júlio. 26. Patrícia Pereira de Mello. 27. Priscila Fabrício dos Santos. 28. Rafael Henrique Kusiak. 29. Simone Aparecida Júlio. 30. Thaiara Camila Chiaratto Gar
Baixar