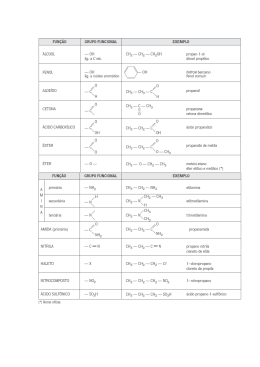
Cursinho Pré-Universitário Popular Capítulo 1 – Introdução à Química Orgânica Prof.: Maria Patrícia Química 4 Nitrogênio(N): é trivalente e suas ligações podem ser representadas por ― N ―, = N ― e Conceito: │ É o ramo da química que estuda os compostos do carbono. Como estes compostos são encontrados nos seres vivos, a Química Orgânica ficou sendo conhecida como “a química da vida.” ≡ N. Oxigênio(O): é bivalente, ― O ― e O =. Halogênios: flúor (F), cloro(Cl), bromo(Br) e iodo (I), são todos monovalentes, F ―, Cl ―, Br ― e O Carbono: No sáculo XIX, Kekulé percebeu que o átomo de carbono apresentava certas propriedades que o diferenciava de outros átomos. Essas propriedades são: a) O carbono é tetravalente: Como o carbono apresenta 4 elétrons na última camada eletrônica, quando se liga a outro átomo compartilha esses 4 elétrons formando portanto 4 ligações covalentes. b) O carbono forma cadeias: O átomo de carbono pode ligar-se a outros átomos de carbono, formando cadeias com várias disposições e tamanhos. Essa propriedade é a principal responsável pela existência de milhares de compostos orgânicos. c) As 4 ligações sigma (σ) de um carbono são iguais. I ―. Enxofre(S): é bivalente: ― S ― e S =. Representação dos compostos orgânicos: Os compostos orgânicos possuem uma variedade de fórmulas utilizadas para representálos. São elas: Estrutural: H H │ │ H―C―C―H │ │ H H Condensada: H3C – CH3 Molecular: C2H6 Compostos orgânicos: Nos compostos orgânicos, a presença do carbono (C) é obrigatória. Suas ligações podem ser representadas das seguintes maneiras: │ ― C ―, = C =, ≡ C ― e = C ―. │ │ Atualmente, a representação mais simplificada seria a de zigue-zague. As pontas correspondem a CH3, a junção de dois traços ao grupo CH2, a junção de três traços ao grupo CH e a junção de quatro traços a um carbono quaternário. Em inglês essa nomenclatura é dita Bond Line Formula. Exemplos: Além do carbono são encontrados outros elementos como: Hidrogênio(H): é monovalente, efetua uma única ligação que é representada por H ―. 108 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 CH2 – CH3 H 4- Carbono quaternário: Está ligado diretamente a apenas átomos de carbono. Cadeias carbônicas: As cadeias carbônicas possuem classificações de acordo com características. algumas algumas a) Classificação do carbono na cadeia: H CH3 │ │ H ― C ― C* ― CH2 – CH3 Os átomos de carbono numa cadeia podem ser classificadas de acordo com o número de átomos de carbono ligados diretamente a eles. │ │ CH2 – CH3 H 1- Carbono primário: É aquele ligado a no máximo um átomo de carbono diretamente. H H │ │ 5- Classificação das cadeias carbônicas: H―C―C―H │ │ H H As cadeias carbônicas podem classificadas segundo 3 critérios: ser 1- Disposição carbono: de I) 2- Carbono secundário: É aquele ligado diretamente a dois átomos de carbono. H │ CH3 H ― C ― C* ― H │ H H 3- Carbono terciário: átomos Cadeia aberta, acíclica ou alifática: Apresenta pelo menos duas extremidades e nenhum ciclo ou anel. Se divide em: │ │ dos Normal, reta ou linear: Apresenta apenas carbonos primários e secundários. │ │ │ │ -C–C–C–C– │ │ │ │ Ramificada: Apresenta carbonos secundários. terciários e Está ligado a três átomos de carbono. H CH3 │ │ H ― C ― C* ― H │ │ II) Cadeia fechada ou cíclica: Não apresenta extremidades e os átomos apresentam um ou mais ciclos. 109 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia 2- Tipo de ligação entre os átomos de carbono: Se divide em: I) Aromática: Apresenta benzênico. Química 4 pelo menos um anel Saturada: Apresenta somente ligações simples entre os átomos de carbono na cadeia. │ -C│ │ │ │ -C–C–C–C│ │ │ │ Anel ou núcleo benzênico é uma das cadeias mais importantes da Química Orgânica. Esse nome é derivado do composto mais simples que apresenta esse núcleo, o benzeno (C6H6). Esse anel forma os compostos aromáticos que se subdividem em: Compostos aromáticos mononucleares ou mononucleados: contêm um único anel benzênico. Compostos aromáticos polinucleares ou polinucleados: contêm mais de um anel benzênico. Pode ser: Polinuclear isolado: quando os anéis não contêm átomos de carbono em comum. E polinuclear condensado: quando os anéis contêm átomos de carbono em comum. Alicíclica, não-aromática ou cicloalifática: Não apresentam o núcleo aromático ou anel benzênico. II) Insaturada: Apresenta pelo menos uma dupla ou tripla ligação entre átomos de carbono na cadeia. │ │ │ -C–C=C=C│ │ 3- Natureza dos átomos que compõe a cadeia: I) Homogênea: É constituída apenas de átomos de carbono. │ -C│ │ │ │ -C–C–C–C│ │ │ │ 110 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 2) Um quimioterápico utilizado no tratamento do câncer é a sarcomicina, cuja fórmula estrutural pode ser representada por: II) Heterogênea: Apresenta pelo menos um heteroátomo na cadeia. │ - C│ │ │ │ -C–C-O-C–C│ │ │ │ O = heteroátomo OBS.: Heteroátomo: átomo diferente de carbono que esteja posicionado entre dois átomos de carbono. Escreva sua fórmula molecular e indique o número de carbonos secundários presentes na estrutura. 3) Determine número de carbonos primários, secundários, terciários e quaternários existentes em cada uma das estruturas a seguir e escreva suas fórmulas moleculares: Exercícios: 1) Identifique quais são os carbonos primários, secundários e terciários nos compostos a seguir: 4) A cadeia abaixo é: a) Aberta, heterogênea, saturada e normal; b) Acíclica, homogênea, insaturada e normal; c) Aromática, homogênea, insaturada e ramificada; d) Alifática, homogênea, insaturada e ramificada; e) Cíclica e aromática. 5) Identifique a cadeia carbônica ramificada, homogênea e saturada: 111 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 Prefixo: Indica o número de átomos de carbono. Infixo: Indica o tipo de ligação entre carbonos. Sufixo: Indica o grupo funcional. Radicais monovalentes hidrocarbonetos: derivados de 6) Um grupo de compostos, denominados ácidos graxos, constitui a mais importante fonte de energia na dieta do Homem. Um exemplo destes é o ácido linoleico, presente no leite humano. A sua fórmula estrutural simplificada é: CH3(CH2)4(CH)2CH2(CH)2(CH2)7COOH Sua cadeia carbônica é classificada como: a) Aberta, normal, saturada e homogênea; b) Aberta, normal, insaturada e heterogênea; c) Aberta, ramificada, insaturada e heterogênea; d) Aberta, ramificada, saturada e homogênea; e) Aberta, normal, insaturada e homogênea. Prefixos: 1 C: met 7 C: hept 2 C: et 8 C: oct 3 C: prop 9 C: non 4 C: but 10 C: dec 5 C: pent 11 C: undec 6 C: hex 12 C: dodec, etc. Gabarito: 4-d; 5- b;6- e. Capítulo 2 – Hidrocarbonetos: São compostos formados apenas de carbono e hidrogênio. Fórmula geral: CXHY. Nomenclatura: I) II) Cada composto orgânico deve ter um nome diferente. A partir do nome deve ser possível escrever a fórmula do composto orgânico e vice-versa. a) Alcanos: São hidrocarbonetos acíclicos e saturados, ou seja, possuem cadeias abertas e ligações simples entre os carbonos. As três partes do nome: O nome dos compostos orgânicos de cadeia normal e não-aromáticos é dividido em três partes. Fórmula geral: CnH2n+2. OBS.: n = número de carbonos. 112 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 Nomenclatura: Prefixo indicativo ao número de carbonos + an +o. Ramificação: Escolhe-se a cadeia principal (a maior sequência de carbonos), entre duas ou mais possibilidades escolhe-se a cadeia mais ramificada; Para numerá-los parte-se de uma das extremidades de forma que as ramificações possuam os menores números; Os radicais precedem o nome da cadeia principal e seguem a ordem de complexidade ou em caso de igual complexidade, a ordem alfabética. b) Alcenos: Fórmula geral: CnH2n-2. Nomenclatura: Prefixo indicativo ao número de carbonos + in + o. Ramificação: A nomenclatura da alcinos ramificados é semelhante a de alcenos ramificados. d) Alcadienos: São hidrocarbonetos acíclicos com duas duplas ligações. São hidrocarbonetos acíclicos que possui uma única dupla ligação. Fórmula geral: CnH2n-2. Fórmula geral: CnH2n. Nomenclatura: Prefixo indicativo ao número de carbonos + en + o. Ramificação: A cadeia principal é a maior sequência de carbonos que contenha a dupla ligação; A sua numeração começa da extremidade mais próxima da dupla ligação; Os radicais devem ser colocados em ordem de complexidade. c) Alcinos: Nomenclatura: Prefixo indicativo ao número de carbonos + a + DIENO. Ramificação: A cadeia principal é aquela que possui a maior sequência de carbonos e que contenha as duas duplas ligações; A sua numeração começa da extremidade mais próxima das duas duplas ligações. e) Ciclanos: São hidrocarbonetos cíclicos contendo apenas ligações simples entre os carbonos da cadeia. São hidrocarbonetos acíclicos, contendo uma única tripla ligação. Fórmula geral: CnH2n. 113 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 Nomenclatura: Palavra CICLO + prefixo indicativo ao número de carbonos do ciclo + an + o. Ramificação: f) A numeração começa pelo carbono que possui o menor radical no sentido horário e anti-horário; Os radicais ficam com os menores números. Classificação: 1) Aromáticos mononucleares monocíclicos: Hidrocarbonetos que possuem um único anel benzênico. Se divide em: Benzênicos ou com ramificações saturadas: Fórmula geral: CnH2n-6 com n ≥ 6. Com ramificações insaturadas (contêm ligação dupla ou tripla). 2) Aromáticos polinucleares ou policíclicos: Ciclenos: São hidrocarbonetos cíclicos contendo uma ligação dupla. Fórmula geral: CnH2n-2. Nomenclatura: Palavra CICLO + prefixo indicativo ao número de carbonos do ciclo + en + o. Hidrocarbonetos que possuem mais de um anel benzênico. Núcleos isolados: Núcleos condensados: Ramificação: Coloca-se a dupla ligação entre os números 1 e 2 e faz a numeração no sentido horário e anti-horário; Os radicais ficam com os menores números. g) Hidrocarbonetos aromáticos: São hidrocarbonetos que possuem pelo menos um anel benzênico. ou Nomenclatura: Ramificação: Citar os nomes das ramificações e terminar com a palavra benzeno. A numeração parte da ramificação mais simples e segue o sentido que dê os menores números possíveis. Exercícios: 1) Os hidrocarbonetos são os principais constituintes do petróleo. A respeito dos hidrocarbonetos, cujos nomes estão relacionados a seguir: I – ciclopenteno II – 2-buteno III – propadieno IV – hexano V – 3 – heptino 114 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia VI – ciclobutano Química 4 apresentam em sua constituição os elementos químicos: Indique a fórmula estrutural plana que se encaixa o composto. 2) (UFSC) Um alcano encontrado nas folhas de repolho contém em sua fórmula 64 átomos de Hidrogênio. O número de átomos de Carbono na fórmula é: (A)29 (B)32 (C)30 (D)33 (E)31 a) hidrogênio, carbono e oxigênio. b) Hidrogênio, carbono e nitrogênio. c) Hidrogênio e carbono. d) Hidrogênio, carbono, oxigênio e nitrogênio. e) Hidrogênio, carbono, oxigênio, enxofre e nitrogênio 3) Dê o nome e a fórmula molecular dos seguintes ciclos: 6) (RRN) Um composto orgânico cuja fórmula geral é representada por C nH2n pertence à classe do: a) Alceno ou cicloalceno. b) Alcano ou cicloalcano. a) b) c) c) Alceno ou cicloparafina. 4) (FAFI-MG) d) Alcino ou alcadieno. e) Alcino ou aromático. I 7) Escreva a fórmula estrutural de um hidrocarboneto que apresenta as seguintes características: II a) Possui 4 C, 1 dupla ligação e 1 ramificação. Sobre o benzeno, C6H6, estão corretas as seguintes afirmações, exceto: a) Possui três pares de elétrons deslocalizados. b) É uma molécula plana, com forma de hexágono regular, confirmada por estudos espectroscópicos e de cristalografia por raios X. c) Todos os ângulos de ligação valem 120° devido à equivalência de todas as ligações carbono-carbono. d) O benzeno não apresenta estrutura de ressonância. e) Os seis elétrons p estão espalhados igualmente nos seis carbonos e não localizados entre os pares de átomos de carbono 5) (OSEC-SP) Os compostos classificados como hidrocarbonetos fazem parte de misturas que compõem alguns combustíveis. Esses compostos b) Possui 6 C, 2 duplas ligações e 2 ramificações. Gabarito: 2- e; 4- d; 5- c. Capítulo 3 – Funções Orgânicas: Função orgânica é um conjunto de substâncias que ap.resentam semelhanças em suas propriedades químicas, chamadas propriedades funcionais. Decorrido o fato de possuírem a mesma fórmula estrutural. O átomo ou grupo de átomos responsáveis por essas propriedades, ou seja, que caracteriza a fórmula estrutural é chamado grupo funcional. a) Álcoois: São compostos orgânicos que contêm um ou mais grupos hidroxila (OH) ligados diretamente a um carbono saturado. Fórmula geral: R – OH. 115 Cursinho Pré-Universitário Popular Nomenclatura: I.U.P.A.C.: Prefixo indicativo ao número de carbonos + an, en ou in + ol. USUAL: Palavra ÁLCOOL + prefixo indicativo ao número de carbonos + ÍLICO. Ramificação: A cadeia principal é a maior sequência de carbonos que contenha o carbono ligado a hidroxila (OH); A numeração começa pela extremidade mais próxima a hidroxila (OH). Exemplo: Prof.: Maria Patrícia Química 4 Os álcoois podem ser classificados segundo alguns critérios: 1 – número de hidroxilas: Monoálcool ou monol: possui uma hidroxila. Diálcool ou diol: possui duas hidroxilas. Triálcool ou triol: possui três hidroxilas. E assim por diante. 2 – Posição da hidroxila: Álcool primário: hidroxila ligada a carbono primário. Álcool secundário: hidroxila ligada a carbono secundário. Álcool terciário: hidroxila ligada a carbono terciário. b) Fenóis: São compostos orgânicos que possuem a hidroxila (OH) ligada diretamente ao anel aromático. Obs.:Quando um álcool apresentar mais do que dois átomos de carbono, indicamos a posição do OH numerando a cadeia a partir da extremidade mais próxima do carbono que contém a hidroxila. Fórmula geral: Ar – OH. Nomenclatura: Palavra HIDROXI + nome do aromático correspondente. Ramificação: A numeração começa pela hidroxila no sentido em que os radicais fiquem com os menores números. Exemplo: Obs.: Os alcoóis são constituídos por radicais de hidrocarbonetos ligados a uma ou mais hidroxilas. Entretanto, nunca podem ser considerados bases de Arrhenius (pois não liberam essa hidroxila em meio aquoso). Classificação: 116 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 A numeração começa por esse grupo de forma que os radicais fiquem com os menores números. Exemplo: c) Éteres: São compostos em que o oxigênio está posicionado entre dois carbonos. Fórmula geral: R – O – R1. Nomenclatura: I.U.P.A.C.: Prefixo indicativo ao menor número de carbonos + OXI + nome do hidrocarboneto correspondente ao maior número de carbonos. USUAL: Palavra ÉTER + nome do menor grupo + nome do maior grupo + ICO. Exemplo: e) Cetonas: São compostos que possuem o grupo funcional ou – CO – entre carbonos. Fórmula geral: R – CO – R1. Nomenclatura: d) Aldeídos: São compostos orgânicos que apresentam o grupo carbonilo. I.U.P.A.C.: Prefixo indicativo ao número de carbonos + an ou en + ona. USUAL: Nome do menor radical + nome do maior radical + CETONA. Grupo carbonilo: Ramificação: Semelhante a nomenclatura de aldeídos, substituindo o grupo – CHO pelo grupo – CO - . ou – CHO. Fórmula geral: R – CHO. Nomenclatura: Prefixo indicativo número de carbonos + an ou en + al. Exemplo: ao Ramificação: A cadeia principal é a maior sequência de carbonos que possui o carbono com o grupo – CHO. 117 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 g) Ésteres: São compostos orgânicos derivados de ácidos carboxílicos pela substituição do hidrogênio do grupo OH por um radical orgânico (R). f) Ácidos carboxílicos: São compostos que possuem o grupo carboxila. Grupo carboxila: Fórmula geral: ou - COOH. Fórmula geral: R – COOH. Nomenclatura: Palavra ÁCIDO + prefixo indicativo ao número de carbonos + an, en, ou in + ÓICO. Nomenclatura: Nome do ácido carboxílico – ICO + ATO + DE + nome do radical com terminação A. Exemplo: Ramificação: Semelhante a dos aldeídos ramificados. Exemplo: Flavorizantes são substâncias que apresentam sabor e aroma característicos, geralmente agradáveis. Muitos flavorizantes pertencem à função éster. Segue abaixo de 2 ésteres empregados como essências em vários produtos alimentícios. Exemplos: 118 Cursinho Pré-Universitário Popular h) Aminas: São compostos derivados da amônia (NH3) pela substituição de um, dois ou três hidrogênios por radicais. Fórmula geral: Prof.: Maria Patrícia Química 4 Exercícios: 1) (Univ). S. Judas Tadeu - (SP) O manitol é um tipo de açúcar utilizado na fabricação de condensadores de eletrólitos secos, que são utilizados em rádios, videocassetes e televisores; por isso, em tais aparelhos, podem aparecer alguns insetos, principalmente formigas. Se a fórmula estrutural é: Exemplos: Qual o nome oficial desse açúcar? (A) Hexanol (B) Hexanol-1,6 (C) 1,2,3-Hexanotriol Nomenclatura: Nome dos radicais em ordem de complexidade + AMINA. (D) 1,2,3,4-tetra-Hidróxi-Hexano (E) 1,2,3,4,5,6-Hexanohexol i) Amidas: Compostos com o grupo funcional: Nomenclatura: Nome do hidrocarboneto que lhe deu origem – óico + AMIDA. Exemplos: 2) A fórmula abaixo se refere a um composto que pertence à função: a) cetona b) aldeído c) ácido d) éster e) éter. 3) (PUCRS/1-2000) 9) Considerando a estrutura do ácido salicílico, usado na preparação do salicilato de sódio, analgésico e antipirético, selecione a alternativa que apresenta as palavras 119 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 que completam corretamente as lacunas no texto a seguir. O ácido salicílico pode ser considerado uma molécula de ________ com um grupo ________. funções orgânicas I e II, circuladas na estrutura do citrato de sildenafil, são (A) cetona e amina. (B) cetona e amida. (C) éter e amina. A) aldeído fenólico (D) éter e amida. B) cetona carbonila (E) éster e amida. C) fenol carboxila D) álcool E) éster 4) (PUCRS/2-2001) A cerveja é fabricada a partir dos grãos de cevada. Seu sabor amargo deve-se à adição das folhas de lúpulo, que contêm uma substância chamada mirceno, de fórmula 6) O aspartame, estrutura representada a seguir, é uma substância que tem sabor doce ao paladar. Pequenas quantidades dessa substância são suficientes para causar a doçura aos alimentos preparados, já que esta é cerca de duzentas vezes mais doce do que a sacarose. Essa substância pode ser classificada como A) álcool. B) ácido carboxílico. As funções orgânicas presentes na molécula desse adoçante são, apenas, C) aminoácido. (A) éter, amida, amina e cetona. D) hidrocarboneto. (B) éter, amida, amina e ácido carboxílico. E) aldeído. (C) aldeído, amida, amina e ácido carboxílico. 5) Em 1998, o lançamento de um remédio para disfunção erétil causou revolução no tratamento para impotência. O medicamento em questão era o Viagra®. O princípio ativo dessa droga é o (D) éster, amida, amina e cetona. A aspoxicilina, abaixo representada, é uma citrato de sildenafil, cuja estrutura é representada na figura: (E) éster, amida, amina e ácido carboxílico. 7) substância utilizada no tratamento de infecções bacterianas. As funções 1, 2, 3 e 4 marcadas na estrutura são, respectivamente: 120 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 As funções orgânicas, presentes na fórmula estrutural do ácido mencionado, são: (A) cetona e álcool (A) amida, fenol, amina, ácido carboxílico. (B) amida, amina, álcool, éster. (C) amina, fenol, amida, aldeído. (D) amina, álcool, nitrila, ácido carboxílico. (E) amida, nitrila, fenol, éster. (B) álcool e aldeído (C) ácido carboxílico e álcool (D) ácido carboxílico e aldeído (E) cetona e éster 10) Observe a estrutura da muscona: 8) O composto antibacteriano ácido oxalínico é representado pela fórmula estrutural: e apresenta as seguintes funções: (A) éster, cetona, amina e éter (B) éter, cetona, amina e ácido carboxílico (C) éster, amida, amina e ácido carboxílico (D) éster, amina, fenol e cetona (E) éter, amida, éster e amina 9) Os xampus, muito utilizados para limpar e embelezar os cabelos, de modo geral, contêm em sua constituição, no mínimo, as seguintes substâncias: detergente, corante, bactericida, essência e ácido cítrico (regula o pH). Esta substância é utilizada em indústrias farmacêuticas, alimentícias e cosméticas, tendo sua maior aplicação em perfumaria. É o princípio ativo de uma secreção glandular externa produzida por uma espécie de veado que habita a Ásia Central: os almiscareiros . Os machos dessa espécie produzem a muscona (almíscar), com a finalidade de atrair as fêmeas na época do acasalamento. Em perfumaria, a sua principal aplicação é como fixador de essências. Marque a alternativa que corresponde à função orgânica que caracteriza a muscona: (A) Ácido carboxílico (B) Aldeído (C) Cetona (D) Éter (E) Fenol 11) O acebutolol pertence a uma classe de fármacos utilizada no tratamento da hipertensão. Estão 121 Cursinho Pré-Universitário Popular presentes na estrutura do acebutolol as seguintes funções: Prof.: Maria Patrícia Química 4 Capítulo 4 – Isomeria: Isômeros são dois ou mais compostos de mesma fórmula molecular mas diferentes fórmulas estruturais. O fenômeno da isomeria causa diferença nas propriedades dos compostos isômeros. A isomeria pode ser dividida em isomeria plana e espacial. a) Isomeria Plana: (A) éster, álcool, amina, amida, alqueno. (B) amida, alqueno, álcool, amina, fenol. (C) amina, fenol, aldeído, éter, álcool. (D) cetona, álcool, amida, amina, alqueno. (E) amida, cetona, éter, álcool, amina. 12) Associe os nomes comerciais de alguns compostos orgânicos e suas fórmulas condensadas na coluna de cima com os nomes oficiais na coluna de baixo. Ocorre quando os isômeros podem ser diferenciados pelas fórmulas estruturais planas. São cinco os casos mais comuns. 1) Isomeria de cadeia ou núcleo: Os isômeros pertencem a mesma função, mas possuem cadeias carbônicas diferentes. I. Formol (CH2O) II. Acetileno III. Vinagre (CH3 – COOH) IV. Glicerina (CH2OH – CHOH – CH2OH) (P) Propanotriol (Q) Ácido etanóico 2) Isomeria de posição: Os isômeros pertencem à mesma função química, possuem a mesma cadeia carbônica, mas diferem pela posição de uma ramificação ou instauração. (R) Metanal (S) Fenil amina (T) Etino A associação correta entre as duas colunas é (A) I-P, II-T, II-Q, IV-R (B) I-Q, II-R, II-T, IV-P (C) I-Q, II-T, III-P, IV-R (D) I-R, II-T, III-Q, IV-P (E) I-S, II-R, III-P, IV-Q 3) Isomeria de compensação ou metameria: Os isômeros pertencem a mesma função química, possuem a mesma cadeia carbônica, mas diferem pela posição de um Gabarito: 1- e; 2- e; 3- c; 4- d; 5- c; 6- e; 7- a; 8b; 9- c; 10- c; 11- e; 12- d. 122 Cursinho Pré-Universitário Popular heteroátomo Prof.: Maria Patrícia Química 4 Se divide em geométrica e óptica. 1) Isomeria geométrica ou cis-trans: Ocorre em dois casos. 1.1) Em compostos com ligações duplas: 1.2) Em compostos cíclicos: 4) Isomeria de função: Os isômeros pertencem a funções químicas diferentes. 2) Isomeria óptica: 5) Tautomeria: É um caso particular da isomeria funcional. Os dois isômeros ficam em equilíbrio químico dinâmico. Os casos mais comuns ocorrem entre: Aldeído e enol: Cetona e enol: Todos os isômeros possuem propriedades físicas diferentes, tais como PF, PE e densidade, mas os isômeros ópticos não possuem esta diferença, ou seja, as propriedades físicas dos isômeros ópticos são as mesmas. Então o que faz eles serem diferentes? É possível diferenciálos? Sim, é possível diferenciá-los, mas quando eles estão frente à luz polarizada. Luz polarizada é um conjunto de ondas eletromagnéticas que se propagam em apenas uma direção. Uma lâmpada incandescente é um exemplo de fonte de luz não polarizada, pois a luz é emitida em todas as direções. É possível polarizar luz não polarizada, bastando utilizar um polarizador, que terá função de direcionar apenas uma direção da luz. b) Isomeria Espacial: Também chamada de estereoisomeria, ocorre quando as diferenças entre os isômeros só podem ser explicadas pelas fórmulas estruturais espaciais. (As fórmulas estruturais planas são as mesmas). 123 Cursinho Pré-Universitário Popular Esta seta de duas pontas significa a propagação da onda eletromagnética (luz polarizada) vista de frente. Isômeros ópticos: Enantiômeros: Os isômeros ópticos são capazes de desviar a luz polarizada. Caso o isômero óptico provoque um giro da luz polarizada para a direita, o enantiômero é denominado dextrógiro (d, +). Caso o enantiômero provoque o giro da luz polarizada para a esquerda, o composto é chamado levógiro (l, -). É necessário atenção pois os enantiômeros não são superponíveis, assim como o levógiro não se superpõe ao dextrógiro. O fato de um composto provocar o giro da luz polarizada, faz com que ele possua atividade óptica. Atividade óptica só é possível em moléculas assimétricas, ou seja, moléculas que possuem carbono quiral (ou estereocentro). Prof.: Maria Patrícia Química 4 Temos que o isômero dextrógiro desviará o plano da luz de +a, enquanto o isômero levógiro desviará o plano daluz de –a. Temos ainda a mistura racêmica (d + l = +a-a= 0) que é opticamente inativa. 2.2) Isomeria com 2 carbonos assimétricos iguais: 2.3) Isomeria com 2 carbonos assimétricos diferentes: 2.1) Isomeria óptica com 1 carbono assimétrico ou quiral: Obs.: Van’t Hoff formula que moléculas com n n carbonos assimétricos possuem 2 n isômeros dextrógiros e 2 isômeros n-1 levógiros. E ainda, 2 misturas racêmicas. Compostos enantioméricos, um é imagem especular do outro, ou seja, um é imagem refletida do outro. No entanto, eles não são superponíveis. Um exemplo disso, são as mãos, direita e esquerda. Uma é a imagem da outra, mas não são superponíveis. Tente verificar este fato com suas mãos, coloque uma na frente da outra. (Uma será imagem da outra). 124 Cursinho Pré-Universitário Popular Agora tente colocar umasobre a outra. (As mãos não são superponíveis, ou seja, os dedos polegares não ficam um sobre o outro). Considere isto como um exemplo para entender o fato da assimetria molecular. Mistura racêmica é uma mistura de isômeros ópticos, ou seja, é uma mistura de 50% de levógiro e de 50% de dextrógiro. Prof.: Maria Patrícia Química 4 Os terpenos são o resultado da união de duas ou mais unidades do isopreno, como se pode ver a seguir: Exercícios: Em relação ao isopreno, podemos afirmar que 1) A respeito dos seguintes compostos, pode-se afirmar que (A) a nomenclatura do isopreno, segundo a IUPAC, é 2-metil-1-buteno. (B) o isopreno insaturados. não apresenta carbonos (C) o isopreno é isômero de cadeia do 4-metil-2pentino. (A) são isômeros de posição. (B) são metâmeros. (C) são isômeros funcionais. (D) ambos são ácidos carboxílicos. (E) o composto I é um ácido carboxílico, e o composto II é um éter. 2) As substâncias A, B e C têm a mesma fórmula molecular (C3H8O). O componente A tem apenas um hidrogênio ligado a um carbono secundário e é isômero de posição de C. Tanto A quanto C são isômeros de função de B. As substâncias A, B e C são, respectivamente, (A) 1-propanol, 2-propanol e metoxietano. (B) etoxietano, 2-propanol e metoxietano. (C) isopropanol, 1-propanol e metoxietano. (D) metoxietano, isopropanol e 1-propanol. (E) 2-propanol, metoxietano e 1-propanol. 3) O odor de muitos vegetais, como o louro, a cânfora, o cedro, a losna, e a cor de outros, como a cenoura e o tomate, são devidos à presença de terpenoides (terpenos). (D) segundo a IUPAC (União Internacional de Química Pura e Aplicada), a nomenclatura do isopreno é 2-metil-1,3-butadieno. (E) o isopreno pode apresentar isômeros de cadeia, funcionais e tautômeros. 4) O butanoato de etila é um líquido incolor, empregado como essência artificial em algumas frutas, como, por exemplo, o abacaxi e a banana, sendo isômero do ácido hexanoico. O tipo de isomeria plana presente entre o butanoato de etila e o ácido hexanoico é de (A) cadeia. (B) posição. (C) função. (D) metameria. (E) tautomeria. 5) Com a fórmula molecular C7H8O existem vários compostos aromáticos, como, por exemplo, Considerando os compostos acima, afirma-se que: I. "X" pertence à função química éter. 125 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia II. "Y" apresenta cadeia carbônica heterogênea. (A) I e II; posição III. "Z" apresenta isômeros de posição. (B) I e III; cadeia IV. "X", "Y" e "Z" apresentam em comum o grupo benzila. (C) II e III; função Pela análise das afirmativas, conclui-se que somente estão corretas (A) I e II Química 4 (D) II e IV; cadeia (E) I, III e IV; cadeia 8) Em uma aula de química orgânica, o professor escreveu no quadro a fórmula C4H8O e perguntou a quatro alunos que composto tal fórmula poderia representar. As respostas foram (B) I e III (C) II e IV (D) I, III e IV (E) II, III e IV 6) Assinale a alternativa que relaciona corretamente o par de isômeros dados com o tipo de isomeria que apresenta. O professor considerou certas as respostas dadas pelos alunos (A) 1 e 2 (B) 1 e 3 (C) 2 e 4 (D) 3 e 4 (E) 1, 2 e 3 9) Para responder à questão, analise as afirmativas a seguir. 7) Considerando os compostos numerados de I a IV orgânicos I. Propanal é um isômero do ácido propanoico. II. Ácido propanoico é um isômero do etanoato de metila. III. Etil-metil-éter é um isômero do 2-propanol. IV. Propanal é um isômero do 1-propanol. Pela análise das afirmativas, conclui-se que somente estão corretas (A) I e III (B) II e III (C) II e IV NÃO é correto afirmar que _________ são isômeros de __________. (D) I, II e III 126 Cursinho Pré-Universitário Popular (E) II, III e IV 10) A proteína do leite apresenta uma composição variada em aminoácidos essenciais, isto é, aminoácidos que o organismo necessita na sua dieta, por não ter capacidade de sintetizar a partir de outras estruturas orgânicas. A tabela a seguir apresenta a composição em aminoácidos essenciais no leite de vaca. Dos aminoácidos relacionados, podemos afirmar que (A) isoleucina e valina são isômeros de cadeia e, por apresentarem carbono assimétrico ambos são opticamente ativos. (B) leucina e isoleucina são isômeros de posição e, por terem carbono assimétrico, apresentam isomeria óptica. (C) leucina e valina são isômeros de função e, por apresentarem carbono assimétrico, ambos têm um par de enantiomeros. Prof.: Maria Patrícia Química 4 os alcoóis. As principais bases orgânicas são as aminas. a) Ácidos carboxílicos: São ácidos de Arrhenius, e ao se dissolverem em água ionizam-se, formando íons carboxilato. Os ácidos orgânicos são ácidos fracos, ou seja, apresentam pequeno grau de ionização.É interessante notar que o efeito indutivo pode facilitar ou dificultar a ionização do ácido, tornando-o mais forte ou mais fraco, respectivamente. Os grupos elétron-repelentes ligados à carboxila empurram elétrons, aumentando a densidade eletrônica do oxigênio da hidroxila. Isto favorece a manutenção da ligação elétron do hidrogênio (situação que ocorre + na ionização). Assim a formação do H é dificultada e a força do átomo diminui. Os grupos elétron-atraentes retiram elétrons da carboxila, diminuindo a densidade eletrônica do oxigênio da hidroxila. Isso dificulta a manutenção da ligação O-H, tornando-a mais fraca, porque o oxigênio precisa retirar o elétron do hidrogênio. A força do ácido aumenta. Podemos ainda, analisar a natureza, a posição e a quantidade desses substituintes.O-H, tornando-a mais forte, porque o oxigênio não precisa retirar o elétron do hidrogênio. A força do ácido aumenta. Podemos ainda, analisar a natureza, a posição e a quantidade desses substituintes. (D) leucina e isoleucina são isômeros de função e não são opticamente ativos. (E) valina e isoleucina são isômeros de cadeia, porém somente a valina é opticamente ativa. Gabarito: 1- c; 2- e; 3- d; 4- c; 5- b; 6- c; 7- c; 8- b; 9- b; 10- b. Os grupos CH3 e CH2CH3 são elétronrepelentes. O ácido metanóico é mais forte que o etanóico; este é mais forte que o propanóico e assim por diante. Capítulo 5 – Ácidos e bases orgânicos: Os ácidos e as bases constituem duas classes muito importantes e compostos químicos, inclusive porque reagem facilmente entre si. Na química orgânica existem várias funções com caráter ácido mais ou menos acentuados; as principais são os ácidos carboxílicos, os fenóis e 127 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 Como qualquer efeito elétrico, o efeito indutivo diminui com o aumento da distância. O ácido 4-cloro-butanóico é o mais fraco da série. Quanto mais afastado do grupo substituinte, menor a influência sobre a acidez. Os efeitos são aditivos, quanto maior a quantidade de grupos substituintes, mais forte a influência sobre a acidez. b) Fenóis: Também Arrhenius. são ácidos de Como o grupo alquila apresenta efeito indutivo positivo, que diminui a acidez, podemos dizer que: Ál.3º<Ál.2º<Ál.1º<Metanol d) Aminas: São bases de Lewis, pois Da mesma forma que nos ácidos carboxílicos, o efeito indutivo pode aumentar ou diminuir a força ácida. Obs.: Efeito indutivo negativo (I-) ⇒ atração de elétrons em uma ligação sigma. Diminui a densidade eletrônica da cadeia.Os principais átomos e grupos que promovem esse efeito nas moléculas orgânicas são , em ordem decrescente de intensidade: -F > -Cl > -Br > -I > -OR > -NH2 Os principais grupos que promovem efeito indutivo positivo são os grupos alquilas. Obs: ● A intensidade do efeito indutivo diminui ao longo da cadeia, à medida que aumenta a distância do átomo do átomo que o provoca. c) Alcoóis: São compostos anfóteros. Quanto maior a polarização da ligação COH na direção de OH, maior a capacidade de -. formar OH Quanto maior a quantidade de radicais ligados ao carbono do grupo funcional, maior a sua densidade eletrônica, maior a polarização da ligação C-OH sobre a hidroxila. apresentam um par de elétrons não compartilhado no átomo de Nitrogênio. As condições que enriquecem o nitrogênio em elétrons provocam um aumento de basicidade. Como os grupos alquila têm exatamente esse efeito, notamos que as aminas primárias são bases mais fortes que a amônia. As aminas secundárias apresentam dois grupos R doadores de elétrons e, por isso, são bases mais fortes que as aminas primárias. As aminas terciárias possuem três grupos R, o que poderia nos levar a concluir serem estas as mais básicas. Isto porém não ocorre. A existência de três grupos alquila R, muito maiores que o hidrogênio, em volta do nitrogênio, deixa “pouco espaço” livre para aproximação de um ácido de Lewis e formação de ligação dativa característica. Este fenômeno é conhecido pelo nome de impedimento espacial ou impedimento estérico. Assim, para aminas alifáticas temos: Am.3ª<Amônia<Am.1ª<Am.2ª As aminas aromáticas são bases fraquíssimas (ainda mais fracas que as aminas alifáticas terciárias). Como sabemos, o par de elétrons não compartilhado do nitrogênio é o responsável pela basicidade. Capítulo 6 – Reações Orgânicas: Cisão ou ruptura das ligações: Uma ligação covalente sempre é formada por um par de elétrons. Se essa ligação for desfeita, esses elétrons podem apresentar destinos diferentes, 128 Cursinho Pré-Universitário Popular dependendo dos elementos que se ligam e de agentes como calor, luz, solventes, etc. Cisão homolítica ou homólise: A ruptura ocorre de modo que os elétrons da ligação são igualmente repartidos entre os átomos ligantes. Os resultantes de uma homólise denominam-se radicais livres. Esses radicais têm carga elétrica nula e, por apresentarem elétron desemparelhado, são muito instáveis e reativos. Cisão heterolítica ou heterólise: A ruptura ocorre de modo que os elétrons da ligação ficam com apenas um dos átomos ligantes. Os resultantes de uma heterólise são cátions e ânions. Esses íons formados podem ser estáveis ou muito instáveis, sendo que maior instabilidade significa maior capacidade de reação. Prof.: Maria Patrícia a) Reações de substituição: Um átomo ou grupo de átomos de uma molécula orgânica é substituído por outro átomo ou grupo de átomos. 1) Alcanos: Os alcanos possuem baixa tendência de reagir, mas sob condições vigororsas (luz e calor), eles sofrem reações de substituição. Ordem de reatividade: F2 > Cl2 > Br2 > I2 Os halogênios utilizados nas reações de substituição devem ser o cloro (Cl) e o bromo (Br). Reações com flúor (F) são muito perigosas devido a alta reatividade deste elemento e com o iodo (I) as reçoes tornam-se muito lentas. Os reagentes que se combinam com os compostos orgânicos podem ser classificados como eletrofílicos ou nucleofílicos, conforme sua capacidade de utilizar ou fornecer elétrons para o reagente orgânico. Reagente Eletrófilo: É um reagente que se apresenta com deficiência de elétrons e que, por isso, procura ligar-se a um átomo capaz de oferecer-lhe elétrons. O reagente eletrófilo é um reagente que procura elétrons. Neste processo, um hidrogênio (H) é substituído por um halogênio. CH4 + Cl2 → CH3 – Cl + HCl CH3 – CH3 + Br2 →CH3 – CH2 – Br + HBr O composto orgânico que recebe o reagente é normalmente denominado substrato (S). Quando um reagente eletrófilo combina-se com um substrato, temos uma reação eletrofílica. Reagente nucleófilo: É um reagente que apresenta um par de elétrons disponível para efetuar uma ligação e que, por isso, procura ligar-se a um átomo capaz de aceitar esses elétrons. O reagente nucleofílico é um reagente que cede elétrons. Existem na natureza milhões de substâncias orgânicas. A quantidade de reações químicas que podem ocorrer com estas substâncias é enorme. Halogenação: É a reação entre um alcano e um halogênio. Classificação dos reagentes: Química 4 Nitração: Reação entre um alcano e o ácido nítrico (HNO3). Neste processo, um hidrogênio (H) é substituído por um grupo – NO2. CH4 +HO – NO2 → H3C – NO2 + HOH Sulfonação: É a reação entre um alcano e o ácido sulfúrico (H2SO4). CH4 + HO – SO3H → H3C – SO3H + HOH Facilidade de substituição: Cterciário > Csecundário > Cprimário 129 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Também podemos chamar esta reação de reação de Sabatier-Senderens. 2) Aromáticos: Na indústria química de alimentos é muito conhecida. Serve de base para a produção de margarinas a partir de óleos vegetais. Halogenação: É catalisada por AlCl3 ou FeBr3. Os óleos vegetais possuem ligações duplas. A reação de adição, hidrogenação catalítica, transforma esses óleos, que são líquidos em gorduras, que é sólida. Nitração: É catalisada por H2SO4 concentrado. Sulfonação: Alceno: É catalisada por H2SO4 fumegante, ou seja contem SO3 dissolvido. Um hidrogênio é substituído por um grupo Alquilação de Friedel-Crafts: Um hidrogênio é substituído por um grupo A alquilação e a acilação de Friadel-Crafts foram descobertas em 1877 pelo francês Charles Friedel e pelo americano James Crafts. E nos dois casos, o AlCl3 são usados como catalisadores. Dirigência aromáticos: da HC ≡ CH + H – H → H2C = CH2 (proporção de 1:1) H2C = CH2 + H – H → H3C – CH3 (proporção de 1:2) alquila. H2C = CH2 + H – H → H3C – CH3 Alcino: Pode sofrer uma ou duas ligações, dependendo da quantidade de reagente. Acilação de Friedel-Crafts: acila. substituição Halogenação: Adição de halogênio (Cl2 ou Br2) ao alceno, alcadieno ou alcino. Alceno: H2C = CH2 + Cl – Cl → H2C - CH2 nos Alguns grupos ligados ao anel aromático dirigem a substituição para que o produto formado seja uma mistura dos isômeros orto e para ou para a produção de um produto na posição meta. Ocorrem quando um átomo proveniente de uma substância orgânica ou inorgânica se adiciona à uma substância orgânica. São caracterizadas ligações duplas e triplas. pela quebra das Hidrogenação catalítica: Ocorre em alcenos e alcinos. O gás hidrogênio (H2) é adicionado com a ajuda de um catalisador. Pode ser usado o metal níquel (Ni) ou platina (Pt). │ │ Cl Cl Alcino: HC ≡ CH + Br – Br → HC = CH b) Reações de adição: Química 4 │ │ Br Br Segue os mesmos moldes da hidrogenação catalítica. Alcadieno: H2C = C = CH2 + Cl – Cl → H2C - C = CH2 │ │ Cl Cl 130 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Cl Cl Química 4 o produto formado um enol, que por ser instável se transforma em aldeído ou cetona. │ │ HC ≡ CH + H – OH → HC = CH H2C = C = CH2 + 2 Cl – Cl → H2C - C - CH2 │ │ │ │ H OH Cl Cl Regra de Markovnikov: Adição de haletos de hidrogênio (HX): Adição de HCl, HBr ou HI. Os + próprios íons H liberados pelo haleto de hidrogênio são usados como catalisadores. ”Nas reações de adição, o hidrogênio é adicionado ao carbono mais hidrogenado da ligação dupla.” Alcenos: Esta regra serve somente para o cloro. ``Para o bromo, serve a regra Antimarkovnikov, que é o inverso da Markovnikov. H2C = CH2 + H – Cl → H2C - CH2 Markovnikov: │ H H3C – CH = CH2 + H – Cl → H3C – CH - CH2 │ Cl Alcinos: │ H Cl H2C = C = CH2 + H – Cl → H2C - C = CH2 H │ │ │ H Br Esta regra também é válida para alcinos. c) Reações de eliminação: São as reações onde alguns átomos ou grupo de átomos são eliminados da molécula orgânica. H Cl Cl H3C – CH = CH2 + H – Br → H3C – CH - CH2 Alcadienos: │ │ Antimarkovnikov: HC ≡ CH + H – Cl → HC = CH │ │ Adição de água: É o inverso das reações de adição. Têm grande importância para a indústria química, na produção de polietileno que é a matéria-prima para a obtenção de plásticos. Também chamada de hidratação. Esta + reação é catalisada por ácido (H ). Alceno: H2C = CH2 + H – OH→ H2C - CH2 │ H │ OH Alcino: Não acontece a segunda adição, nem mesmo utilizando excesso de água. Devido o fato de ser Eliminação de Desidrogenação Hidrogênio ou A partir de alcano é possível obter um alceno, catalisado por calor. Exemplo: 131 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 1 molécula álcool = desidratação intramolecular = alceno 2 moléculas álcool = desidratação intermolecular = éter Eliminação de Halogenação Halogênio ou De- Di-haletos vicinais regindo com zinco catalisado por um álcool formam alcenos. A Reação de saponificação também é conhecida como hidrólise alcalina, através dela é que se torna possível o feitio do sabão. Falando quimicamente, seria a mistura de um éster (proveniente de um ácido graxo) e uma base (hidróxido de sódio) para se obter sabão (sal orgânico). Exemplo: A equação abaixo demonstra este processo: Éster + base forte → sabão + glicerol Praticamente todos os ésteres são retirados de óleos e gorduras, daí o porquê das donas de casa usarem o óleo comestível para o feitio do sabão caseiro. Eliminação de Halogenidretos Equação genérica da hidrólise alcalina: Halogenidretos, como HCl, HBr e HI podem ser eliminados a partir de um haleto de alquila, catalisado por uma base, que pode ser o KOH e um álcool. Exemplo: Eliminação de Água A desidratação intramolecular de álcool catalisada por ácido sulfúrico concentrado e calor (170°C) ocorre com a eliminação de água e alceno. A equação acima representa a hidrólise alcalina de um óleo (glicerídeo). Dizemos que é uma hidrólise em razão da presença de água (H2O) e que é alcalina pela presença da base NaOH (soda cáustica). O símbolo ∆ indica que houve aquecimento durante o processo. Produtos da reação de Saponificação: sabão e glicerol (álcool). Reação de esterificação A reação de esterificação é considerada uma reação reversível de álcool junto com um ácido orgânico ou inorgânico, produzindo éster e água. Já quando areação é inversa, ela é denominada hidrólise do éster. Outra desidratação que pode ocorrer é a intermolecular de dois álcoois formando éter e eliminando água. A reação deve ser catalisada por ácido sulfúrico concentrado e calor (140°C). Então: O equilíbrio pode ser deslocado para o lado do éster, quando se ajunta com o desidratante. Durante o experimento ficou comprovado que na reação de esterificação o oxigênio do grupo OH do álcool continua na 132 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia molécula do éster e o oxigênio do grupo OH do ácido é eliminado sob a forma de H2O (água), produzindo a reação de um álcool marcado: Química 4 Oxidação energética de alcenos: Reação com um agente oxidante que seja capaz de quebrar a molécula na ligação dupla. Ligação dupla no meio da cadeia: H3C – C = CH – CH3 → H3C – C = O │ Com ácido, observa-se a forma do éster marcado, e não água, contendo assim O – 18. │ CH3 CH3 + O = C – CH3 │ OH Para acelerar a reação, usa-se o ácido como catalisador. Forma-se ácido carboxílico e cetona. Ligação dupla na ponta da cadeia: H3C – H2C – CH = CH2 → H3C – H2C – CH =O │ OH + O = C – OH → CO2 + H2O │ Há basicamente dois tipos de hidrólise de ésteres: ácida e básica. A hidrólise ácida ocorre em meio ácido e é um processo reversível, gerando um álcool e um ácido carboxílico: R-COO-R1 + HOH R-COOH + HO-R1 A hidrólise básica, ou saponificação, é realizada em meio básico. Trata-se de um processo irreversível, gerando álcool e um sal de ácido carboxílico: - OH Forma-se ácido carboxílico e o CH2 se transforma em ácido carbônico que é instável e por sua vez se transforma em CO2 + H2O. Oxidação branda do alceno: O agente oxidante causa uma adição a ligação dupla, há entrada de uma hidroxila em cada um dos carbonos da dupla ligação. OH OH │ + │ R-COO-R1 + BOH(aq) → R-COO B + HO-R1 H3C – C = CH – CH3 → H3C – C – CH – CH3 Onde BOH é uma base, por exemplo, KOH │ d) Reações de oxidação: As reações de oxidação substâncias orgânicas devem catalisadas por um agente oxidante. │ CH3 das ser CH3 Ozonólise: Há quebre da ligação dupla causada pelo ozônio (O3). Necessita de pó de zinco e deve ser 133 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia feita em meio aquoso. Um átomo de hidrogênio é adicionado a cada lado da dupla ligação. Química 4 Exercícios: 1) Das ligações abaixo, qual terá maior tendência a sofrer ruptura heterolítica? a) CH3 – H. H3C – C = CH – CH3 → → H3C – C = O │ CH3 b) CH3 – CH3. │ c) CH3 – NO2. CH3 d) CH3 – NH2. + + O = C – CH3 + H2O2 e) CH3 – F. │ 2) Indique, eletrofílico: entre os reagentes abaixo, o H a) NH3. Forma-se cetona e aldeído. b) HCN. Oxidação de álcoois primários: + c) H3O . Os álcoois primários se oxidam com agentes oxidantes energéticos, como o permanganato de potássio e o dicromato de potássio, em meio sulfúrico. O produto desta oxidação é um aldeído. Com mais quantidade de agente oxidante, obtemos um ácido carboxílico. Esta reação explica porque o vinho fica com gosto de vinagre quando deixamos muito tempo em contato com o ar (oxigênio). O álcool sofre uma oxidação e transforma-se em vinagre, que é um ácido carboxílico. H H OH │ │ │ H3C – C – H → H3C – C = O → H3C – C = O e) H2O. 3) Entre as afirmativas citadas abaixo a única falsa é: a) Radicais livres são átomos ou grupos de átomos que possuem pelo menos um elétron livre. b) Cisão homolítica (ou homólise) corresponde a uma quebra de ligação, em que cada átomo fica com seus elétrons, formando radicais livres. c) Um carbono carregado negativamente é chamado de carboânion ou íon carbânion. d) Na cisão heterolítica o átomo mais eletronegativo fica com o par de elétrons antes compartilhado, formando-se assim íons. │ OH d) ROH. Oxidação de álcoois secundários: Obtêm como produtos as cetonas. OH CH3 │ │ H3C – C – CH3 → H3C – C = O → Não reage. e) Reagente eletrófilo é toda espécie química que, cedendo um par de elétrons, é capaz de formar uma nova ligação. 4) A monocloração de um alcano, em presença de luz ultravioleta, produziu os compostos 1-cloro2-metil-propano e 2-cloro-2-metil-propano. O nome do alcano é: │ a) isopropano. OH b) metil-butano. 134 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia Química 4 c) metano. d) desidratação d) butano. e) hidrogenação e) metil-propano. 9) Na hidrogenação catalítica do propeno, obtémse: 5) Das alternativas a seguir, a que contém somente grupos orientadores META é: a) propino, cuja fórmula geral é CnH2n – 2. a) NO2, Cl, Br. b) ciclopropano. b) CH3, NO2, COOH. c) propano. c) CHO, NH2, CH3. d) propadieno. d) SO3H, NO2, COOH. e) 2-propanol. e) CH3, Cl, NH2. 10) Com respeito à equação: 6) (UFSE) A mononitração do tolueno (metilbenzeno) produz, além de água: X + HBr → C6H13Br a) somente o-nitrotolueno. b) somente m-nitrotolueno. c) somente p-nitrotolueno. d) mistura de o-nitrotolueno e p-nitrotolueno. e) mistura de o-nitrotolueno e m-nitrotolueno. Pode-se afirmar que X é um: a) alcano e a reação é de adição. b) alceno e a reação de substituição. c) alceno e a reação é de adição eletrofílica. d) alcano e a reação é de substituição eletrofílica. e) alceno e a reação é de substituição. 7) O grupo amino (– NH2), ligado ao anel benzênico, nas reações de substituição aromática é orientador: 11) A adição do brometo de hidrogênio ao 3,4dimetil-2-penteno forma o composto: a) apenas orto. a) 2-bromo-4-metil-hexano. b) meta e para. b) 2-bromo-3-etil-pentano. c) apenas meta. c) 3-bromo-2,3-dimetil-pentano. d) orto e meta. d) 3-bromo-3-metil-hexano. e) orto e para. e) 3-bromo-3,4-dimetil-pentano. 8) Os lipídeos podem ser classificados como óleos ou gorduras: nos óleos predominam cadeias insaturadas e nas gorduras predominam cadeias saturadas. Com base nessa afirmação, um óleo é transformado em gordura, respectivamente, através de um processo, no qual ocorre reação de: 12) (Fuvest-SP) Dois hidrocarbonetos insaturados, que são isômeros, foram submetidos, separadamente, à hidrogenação catalítica. Cada um deles reagiu com H2 na proporção, em mols, de 1:1, obtendo-se, em cada caso, um hidrocarboneto de fórmula C4H10. Os hidrocarbonetos que foram hidrogenados poderiam ser: a) saponificação b) hidrólise ácida c) esterificação a) 1-butino e 1-buteno. b) 1,3-butadieno e ciclobutano. c) 2-buteno e 2-metil-propeno. 135 Cursinho Pré-Universitário Popular Prof.: Maria Patrícia d) 2-butino e 1-buteno. a) aldeído. e) 2-buteno e 2-metil-propano. b) ácido carboxílico. 13) Na desidratação intramolecular do etanol obtém-se: c) álcool terciário. Química 4 d) álcool secundário. a) eteno. e) álcool primário. b) propeno. c) etoxietano (éter dietílico). 16) A reação de ozonólise dos alcenos produzirá como produto moléculas de: d) metoximetano (éter dimetílico). a) diálcoois ou ácidos carboxílicos. e) 2-buteno. b) álcoois ou fenóis. 14) (Covest-2002) Álcoois não são utilizados somente como combustíveis, mas também na produção de derivados do petróleo, como, por exemplo, alquenos. Qual dos álcoois abaixo produzirá propeno a partir da desidratação em meio ácido? c) cetonas ou aldeídos. a) 2-metil-2-propanol. b) etanol. c) 2-propanol. d) 2-butanol. e) 2-metil-1-propanol. 15) (Unitau-SP) Para que a oxidação de uma substância orgânica com “n” átomos de carbono por molécula forneça uma cetona com igual número de átomos de carbono, essa substância pode ser um: d) cetonas ou ácidos carboxílicos. e) álcoois ou ácidos carboxílicos. 17) O reativo de Baeyer é utilizado para diferenciar ciclanos de: a) alcano. b) alceno. c) ácido carboxílico. d) éter. e) éster. Gabarito: 1-e; 2- c; 3- e; 4- a; 5- d; 6- d; 7- c; 8- e; 9- c; 10- c; 11- e; 12- c; 13- a; 14- c; 15- d; 16- c; 17-b;18-a. Bibliografia: Feltre, R; Fundamentos da química; volume único; 3ª edição revista e ampliada; editora Moderna; São Paulo; S.P.; 2001. Solomons, T.W.G; Química orgânica I; volume 1; 7ª edição; editora LTC; Rio de Janeiro; R.J.; 2000. Apostila do curso pré-vestibular do Colégio Imaculada Conceição – 2007. http: // www.brasilescola.com Tito e Canto; Química na abordagem do cotidiano; 2ª edição; volume 3; editora Moderna. Feltre; Química Orgânica; 5ª edição; volume 3; editora Moderna. 136
Download