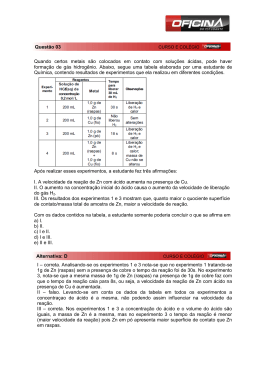
Materiais e Experimentos no Ensino de Química Brasília-DF, 2011. Elaboração: Marcus Vinicius Ribeiro Ferreira Produção: Materiais e Experimentos no Ensino de Química Equipe Técnica de Avaliação, Revisão Linguística e Editoração 2 Apresentação........................................................................................................................................ 4 Organização do Caderno de Estudos e Pesquisa ................................................................................ 5 Organização da Disciplina ................................................................................................................... 6 Introdução ............................................................................................................................................ 7 Unidade I – O Ensino em Ciências ....................................................................................................... 9 Capítulo 1 – O Papel da Internet no Ensino de Química ............................................................. 9 Unidade II – O Estudo da Química: A Teoria e a sua Contextualização ............................................ 13 Capítulo 2 – As Normas de Segurança Laboratoriais ................................................................. 13 Capítulo 3 – O Uso de Materiais mais Acessíveis no Ensino de Química nos Laboratórios .......... 28 Capítulo 4 – A Contextualização das Aulas com a Prática Laboratorial...................................... 45 Para (não) finalizar .............................................................................................................................. 66 Referências ........................................................................................................................................... 67 Pós-Graduação a Distância Sumário 3 Apresentação Caro aluno, Bem-vindo ao estudo da disciplina Materiais e Experimentos no Ensino de Química. Este é o nosso Caderno de Estudos e Pesquisa, material elaborado com o objetivo de contribuir para a realização e o desenvolvimento de seus estudos, assim como para a ampliação de seus conhecimentos. Para que você se informe sobre o conteúdo a ser estudado nas próximas semanas, conheça os objetivos da disciplina, a organização dos temas e o número aproximado de horas de estudo que devem ser dedicadas a cada unidade. A carga horária desta disciplina é de 60 (sessenta) horas, cabendo a você administrar o tempo conforme a sua disponibilidade. Mas, lembre-se, há um prazo para a conclusão da disciplina, incluindo a apresentação ao seu tutor das atividades avaliativas indicadas. Os conteúdos foram organizados em unidades de estudo, subdivididas em capítulos, de forma didática, objetiva e coerente. Eles serão abordados por meio de textos básicos, com questões para reflexão, que farão parte das atividades avaliativas do curso; serão indicadas, também, fontes de consulta para aprofundar os estudos com leituras e pesquisas complementares. Desejamos a você um trabalho proveitoso sobre os temas abordados nesta disciplina. Lembre-se de que, apesar de distantes, podemos estar muito próximos. Materiais e Experimentos no Ensino de Química A Coordenação 4 Organização do Caderno de Estudos e Pesquisa Apresentação: Mensagem da Coordenação. Organização da Disciplina: Apresentação dos objetivos e da carga horária das unidades. Introdução: Contextualização do estudo a ser desenvolvido por você na disciplina, indicando a importância desta para sua formação acadêmica. Ícones utilizados no material didático Provocação: Pensamentos inseridos no material didático para provocar a reflexão sobre sua prática e seus sentimentos ao desenvolver os estudos em cada disciplina. Para refletir: Questões inseridas durante o estudo da disciplina para estimulá-lo a pensar a respeito do assunto proposto. Registre sua visão sem se preocupar com o conteúdo do texto. O importante é verificar seus conhecimentos, suas experiências e seus sentimentos. É fundamental que você reflita sobre as questões propostas. Elas são o ponto de partida de nosso trabalho. Textos para leitura complementar: Novos textos, trechos de textos referenciais, conceitos de dicionários, exemplos e sugestões, para lhe apresentar novas visões sobre o tema abordado no texto básico. Sintetizando e enriquecendo nossas informações: Espaço para você fazer uma síntese dos textos e enriquecê-los com sua contribuição pessoal. Sugestão de leituras, filmes, sites e pesquisas: Aprofundamento das discussões. Para (não) finalizar: Texto, ao final do Caderno, com a intenção de instigá-lo a prosseguir com a reflexão. Referências: Bibliografia consultada na elaboração da disciplina. Pós-Graduação a Distância Praticando: Atividades sugeridas, no decorrer das leituras, com o objetivo pedagógico de fortalecer o processo de aprendizagem. 5 Organização da Disciplina Ementa: Avaliação dos recursos didáticos utilizados no ensino médio. Fatores que motivem os alunos a se entusiasmarem pela disciplina. Experimentos realizados em sala de aula com as vidrarias e reagentes adequados. Proposta metodológica para o ensino de Química. Prática de ensino com os materiais em disponibilidade nas escolas para estimular os estudantes. Objetivos: • Compreender a necessidade de ensinar Ciência nas escolas através da experimentação. • Identificar os diversos problemas de ensino de Química. • Mostrar como as aulas de laboratório são feitas atualmente e apresentar uma abordagem mais prática e lógica para realização dos experimentos nas escolas. • Apresentar aos professores a nova metodologia para capacitá-los a lidar com os materiais e ideias em sala de aula de forma a estimular os alunos. Unidade I – O Ensino em Ciências Carga horária: 10 horas Conteúdo O Papel da Internet no Ensino de Química Capítulo 1 Unidade II – O Estudo da Química: A Teoria e a sua Contextualização Carga horária: 50 horas Materiais e Experimentos no Ensino de Química Conteúdo As Normas de Segurança Laboratoriais O Uso de Materiais mais Acessíveis no Ensino de Química nos Laboratórios A Contextualização das Aulas com a Prática Laboratorial 6 Capítulo 2 3 4 Introdução O ensino hoje exige a contextualização. É necessário que o aluno aprenda a teoria em sala de aula e a relacione com a sua experiência pessoal e a sua realidade. Essa é uma nova maneira de ensinar que exige do professor muita leitura para conseguir unir diferentes conceitos e práticas. Os ramos principais da ciência como a Biologia, a Química, a Física e as Geociências sempre estiveram presentes e muitas soluções que temos para problemas ambientais ou da indústria vêm desta interdisciplinaridade, eliminando assim a tradicional forma de estudo no Ensino Médio. As novas teorias científicas oferecem diversos modelos para criarmos modelos de estudo que devem orientar as investigações em aulas e projetos de Ciências. Quando o aluno participa efetivamente e o professor se responsabiliza pela sua tutoria, o rendimento do estudante é maior. O nosso cérebro não armazena informações de maneira dissociada. Ela precisa obrigatoriamente estar acompanhada de um segundo elemento. A participação ativa do aluno é esse segundo fator. Agindo assim é muito difícil esquecer algo aprendido e aplicado. É praticamente impossível esquecer o que se aprendeu. Segundo as orientações dos Parâmetros Curriculares Nacionais para Ciências Naturais de 2000, os alunos já possuem ideias a respeito de seu corpo, dos fenômenos naturais. Cabe ao professor intervir no processo de confrontar um determinado fenômeno com outras explicações diferentes de modo a instigar o aluno a perceber a necessidade de novas informações, ampliando os conhecimentos prévios. Este Caderno foi confeccionado com o objetivo de apresentar a forma atual de ensino da Química nas escolas e nos laboratórios e os seus diversos problemas, além de sugerir uma abordagem mais econômica para incluir o ensino desta fascinante disciplina nos materiais de uso cotidiano. Pós-Graduação a Distância Isso é possível, pois tudo é constituído de átomos, que se agrupam em moléculas e essas em infinitas combinações, que constroem o mundo em nossa volta. Essa é uma visão lógica e prática, pois nem sempre o Estado dá condições para que sejam comprados para os alunos os reagentes e as vidrarias adequadas. 7 Unidade I O Ensino em Ciências Unidade I O Ensino em Ciências Capítulo 1 – O Papel da Internet no Ensino de Química No final do século XIX e início do século XX, ocorreram muitas transformações educacionais no mundo e no Brasil. Vivenciamos o desenvolvimento de todas as ciências como a Biologia, a Química e a Matemática que nos presentearam com diversos avanços como, por exemplo, os chips, os computadores e hoje, com menos de vinte anos de existência, – a internet. Antes do aparecimento da rede mundial de computadores, o ensino era baseado apenas nos livros e/ou indicações (artigos científicos, notas de aula) fornecidas pelo professor da disciplina, que dominava as técnicas laboratoriais e de aprendizado teórico. Ele era, naquele momento, pleno detentor do conhecimento. Quando efetivamente a internet foi implantada no Brasil, especialmente nas universidades, em 1994, verificamos um fenômeno já observado nos Estados Unidos. A velocidade da busca de informações baseadas no uso dos computadores tornou obsoleto o modelo de ensino. O acesso à internet é vital hoje como era saber ler e escrever na década de 1960. Ela obrigou os novos profissionais formados nas universidades públicas e privadas a ganharem mais agilidade na busca e disseminação do conhecimento para que conseguissem, por exemplo, se manter no mercado de trabalho ou mesmo evitar que publicassem artigos com os mesmos títulos já publicados em outras revistas de divulgação científica. O Brasil tem um programa destinado a fomentar o uso de computadores e, assim, promover o uso pedagógico da informática na rede pública de ensino fundamental e médio. É o Programa Nacional de Tecnologia Educacional (ProInfo). Ele foi criado pela Portaria no 522, de 9 de abril de 1997, do Ministério da Educação, e desenvolvido pela Secretaria de Educação a Distância (SEED), por meio do Departamento de Infraestrutura Tecnológica (DITEC). Esse programa possibilitou a muitas escolas públicas o acesso a essa nova tecnologia, a internet, e com isso houve uma melhora na qualidade de ensino nas escolas municipais e estaduais, pois essas escolas têm se comunicado e trocado experiências. Essa nova tecnologia afetou o currículo tradicional das disciplinas, que normalmente não enfocavam, no conteúdo teórico em sala de aula, a contextualização dos problemas modernos. Isso é claramente visto na forma como os vestibulares cobravam o conhecimento adquirido no 1o e 2o graus. Temos o exemplo da Universidade de Brasília (UnB) que contextualizou o seu vestibular no fim dos anos 1990 como resultado dessa busca pelo futuro profissional , que hoje é mais valorizado pela busca de soluções do que pela mera apresentação de problemas. Pós-Graduação a Distância Em parceria com as Secretarias de Educação Estaduais e Municipais, ele contribui na introdução do uso de tecnologias de informação e comunicação nas escolas da rede pública, além de articular as atividades desenvolvidas sob sua jurisdição, em especial as ações dos Núcleos de Tecnologia Educacional (NTEs) (Sítio do Proinfo, acesso em dez. de 2008). 9 O Ensino em Ciências Unidade I Vários professores, inclusive eu, como aluno, e mais tarde, como professor, percebemos que o ensino das Ciências estava se distanciando dos alunos e dos problemas observados globalmente. Acredito que a forma de abordar o ensino seja a integração do conhecimento teórico com os acontecimentos do cotidiano. O mundo pode ser estudado pela Química. Através dos computadores ligados à rede mundial, é possível adquirir novas habilidades e competências que permitem fazer uma releitura da química e consequentemente buscar soluções de forma mais rápida e criativa. Para que isso ocorra de modo mais eficiente, é preciso focar sempre na busca de informações com o objetivo de enriquecer o currículo do ensino de ciências. Essa busca deve ser baseada, por exemplo, nas questões que envolvem o meio ambiente e a ética e até em questões socioculturais. Dessa forma a resolução dos problemas poderá ser considerada em suas diversas facetas. Essa quantidade de informação, entretanto, deve ser filtrada. O volume de informações disponíveis na internet é enorme, e cresce a taxas exponenciais. Por isso, buscar qualidade em materiais para as aulas práticas, nos periódicos necessários é essencial. Nem todos os sítios de acesso aos artigos são livres de pagamento e normalmente o custo das revistas científicas é elevado para os padrões dos estudantes brasileiros. Vários sítios têm disponibilizado os trabalhos dos pesquisadores como o PubMed. Ele é mantido pelo National Center for Biotechnology Information, (NCBI) e pela National Library of Medicine. Esse sítio contém, aproximadamente, 18 milhões de artigos. (BUTLER. D, 2006; PUBMED, 2008). Os programas de busca da internet hoje conseguem filtrar perto de 30% dos artigos científicos, com alto fator de impacto, encontrados por essas ferramentas de busca. (WREN J. D. 2005). No Brasil, o sítio – Portal Periódico – reuniu cerca de 10 mil artigos em várias áreas do conhecimento e criou também uma lista de periódicos de acesso livre. Esse sítio oferece diversos outros que se dividem em “textos completos”, “resumos” e “patentes, estatísticas, livros e outras fontes”. Entre eles, o sítio de acesso aos resumos traz importantes bases de dados para a pesquisa científica. Materiais e Experimentos no Ensino de Química Hoje, aproximadamente, 180 instituições pertencentes a vários estados do País possuem acesso on-line aos serviços promovidos pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), através do sítio chamado Portal Periódico <http:// www.periodicos.capes.gov.br/>. 10 (acesso ao portal Capes, em dezembro de 2008). Nota: As barras escuras representam a busca por referências e as claras, os artigos completos. Figura 1 – Volume de acessos no período de janeiro a dezembro de 2007 Fonte: PORTAL CAPES O Ensino em Ciências Unidade I O Directory of Open Access Journal (DOAJ, URL,<http://www.doaj.org> é um outro importante sitio de busca de artigos. Ele é mantido em atividade pela Biblioteca Real da Suécia <http://www.kb.se> e tem o suporte da Information Program of the Open Society Institute <http://www.osi.hu/infoprogram/>, da Scholarly Publishing and Academic Resources Coalition (SPARC http://www.arl.org/sparc). São 495 periódicos científicos de texto completo e acesso aberto, e 55 desse total são da área de ciência da informação. (MORENO; LETE; ARELLANO, 2006). Outro importante portal é o SciELO (Scientific Electronic Library Online), que é o produto da cooperação entre a FAPESP (http://www.fapesp.br) – Fundação de Amparo à Pesquisa do Estado de São Paulo, BIREME <http://www. bireme.br> – Centro Latino-Americano e do Caribe de Informação em Ciências da Saúde, instituições nacionais e internacionais relacionadas com a comunicação científica e editores científicos. (portal ECA). Essa biblioteca eletrônica contém uma boa coleção de periódicos em diversas línguas, incluindo o português. São mais de 450 títulos de periódicos com certificação e, aproximadamente, 130 mil artigos em textos completos online, incluindo artigos científicos originais, de revisão, editoriais e outros tipos de comunicações. (“Evento Scielo 10 anos”, 2007). Pós-Graduação a Distância Outra ferramenta que possibilita o acesso aos artigos, teses, dissertações, anais de congressos é o COMUT (Comutação Bibliográfica). O COMUT é utilizado, após o cadastramento via internet. O usurário deve então comprar os “bônus Comut”, que são adquiridos e pagos via boleto bancário. Esse pagamento viabiliza a cópia e o envio do material. 11 O Ensino em Ciências Unidade I Apesar das teorias descreverem e explicarem a estrutura do átomo, é interessante pensar que existem outras formas de apresentar os conceitos de Química. É possível, por exemplo, estudar Química pela a internet assistindo a vídeos e outras animações. Um vídeo que explica a tabela periódica pode ser acessado no “Teacher Tube”. Outros programas oferecem softwares para ensinar a Química abordando aspectos como poluição ambiental. Um dos programas é o “Carbópolis”. Ele foi desenvolvido pela Área de Educação Química/UFRGS com o auxílio do PET (Programa de Educação Tutorial) – Informática/ UFRGS (Universidade Federal do Rio Grande do Sul). De acordo com seus criadores, esse programa, desenvolvido para alunos e professores dos diferentes níveis de ensino, busca simular problemas sobre poluição ambiental que devem ser resolvidos pelos alunos. Dessa forma muitos conceitos da química e do meio ambiente relacionados à poluição do ar e à chuva ácida são levados aos estudantes de maneira lúdica. Utilizando as ferramentas descritas acima, faça uma busca na rede pelos seguintes termos: chuva ácida, estequiometria, pH e crie um pequeno texto e um experimento simples para ser aplicado em sala de aula. Materiais e Experimentos no Ensino de Química Use o espaço a seguir: 12 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Unidade II O Estudo da Química: A Teoria e a sua Contextualização Capítulo 2 – As Normas de Segurança Laboratoriais É preciso conhecer antes de tudo alguns conceitos importantes ao trabalho para a obtenção dos dados em um laboratório. Alguns conceitos são muito importantes como: a validação dos experimentos, a confiabilidade e os algarismos significativos. A validação dos experimentos é resultado de um conjunto de ações para que seja verificada a presteza do método. Alguns parâmetros pertinentes precisam estar presentes: • a condição dos reagentes. As formas como eles são estocados determina a sua durabilidade e confiança no uso. Muitos reagentes precisam ficar estocados a -20ºC e outros a temperatura ambiente na presença de sílica-gel, um agente dessecador; • ensaio de seletividade/especificidade; • determinação dos limites de detecção; • linearidade; • realização de ensaios que permitam a repetitividade e a reprodutividade. A confiabilidade resulta de um conjunto de resultados obtidos, que englobam a validação do método, onde o mesmo experimento é realizado por outros pesquisadores, os recursos materiais e humanos, que são caracterizados pela estrutura geral do laboratório, pelas pessoas que ali trabalham, pela qualidade de quem executa o experimento, entre outros. Os algarismos significativos são dígitos isentos de dúvidas, mais o primeiro algarismo duvidoso. Os números obtidos por cálculos realizados no laboratório ou através dos experimentos podem ser grandes ou pequenos. Vamos ver algumas pequenas regras para entender como devemos tratar os nossos dados. Podemos representá-los através da notação científica (valor vezes potência de 10). Exemplos: • 653.000.000 = 6,53 x 108 (0,653 x 109) • 0,0000064 = 6,4 x 10-6 (0,64 x 10-5) Pós-Graduação a Distância Todos os tópicos que estão relacionados ao bom trabalho laboratorial são importantes, e entender o que são números significativos vai ajudar muito a dar confiabilidade aos dados. Um professor, muito amigo, me disse uma vez que “os dados valem ouro”. E valem mesmo. Eles acabam sendo o produto de horas de planejamento e análise. Então tratemos deles com carinho. 13 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Os dígitos diferentes de zero são os algarismos significativos. A contagem sempre é feita da esquerda até o último dígito diferente de zero à direita. Isso, se não houver uma vírgula decimal, ou até o último dígito (zero ou não) caso haja uma vírgula decimal. Exemplos: • 6400 ou 6,4 x 103 (2 algarismos significativos) • 8200, ou 8,200 x 103 (4 algarismos significativos) • 9300,0 ou 9,3000 x 103 (5 algarismos significativos) • 0,06400 ou 6,400 x 102 (4 algarismos significativos) Todos os dígitos diferentes de zero são significativos. (ex.: 6,4; 54 e 730 possuem 2 algarismos significativos). Os zeros entre dígitos diferentes de zero são significativos (ex.: 504 e 5,06 possuem 3 algarismos significativos). Se existir uma vírgula decimal, todos os zeros à direita da vírgula decimal são significativos (ex.: 8,000 e 44,50 possuem 4 algarismos significativos). Uma observação importante: quanto mais algarismos significativos maiores as incertezas da sua notação. Essa regra aplica-se apenas a valores medidos ou calculados. Outras regras importantes são: • O arrendamento não deve ser feito em cascata, apenas no fim do cálculo. • Se a direita do último algarismo significativo tiver um algarismo maior que 5, some 1. Ex.: 5,88 5,9. • Se a direita do último algarismo significativo tiver um algarismo menor que 5, some 1. Ex.: 5,84 5,8. • Se a direita do último algarismo significativo tiver um algarismo igual a 5, use a regra do par/ímpar. Último número significativo par: Ex.: 5,85 Último número significativo ímpar: Ex.: 5,75 5,9. 5,9. Materiais e Experimentos no Ensino de Química Observe os exercícios a seguir e faça o que se pede: 14 1. Indique o número de algarismos significativos de cada número abaixo: a) 7,4 b) 0,0007 c) 0,034 d) 7,40 2. Um aluno da Química quis medir o comprimento de seu laboratório. Como não achou a régua, ele utilizou o seu toco de lápis como padrão de comprimento. Após alguns minutos (vários minutos), verificou que o comprimento da mesa equivalia ao de 40,5 tocos de lápis. Quando ele conseguiu uma régua, mediu o toco em 9cm. Qual seria o comprimento da mesa? Expresse esse valor da forma mais precisa possível. Lembre-se dos algarismos significativos. . O Estudo da Química: A Teoria e a sua Contextualização Unidade II As expressões e grandezas são formas de grafia estabelecidas pelo SI (Sistema Internacional de Unidades). Elas devem ser usadas para expressar corretamente os nossos dados. Segue a relação de alguns símbolos: Prefixos das unidades SI NOME SÍMBOLO FATOR DE MULTIPLICAÇÃO DE UNIDADE yotta Y 10 = 1 000 000 000 000 000 000 000 000 zetta Z 1021 = 1 000 000 000 000 000 000 000 exa E 1018 = 1 000 000 000 000 000 000 peta P 1015 = 1 000 000 000 000 000 tera T 1012 = 1 000 000 000 000 giga G 109 = 1 000 000 000 mega M 106 = 1 000 000 quilo k 103 = 1 000 hecto h 102 = 100 deca da 10 deci d 10-1 = 0,1 centi c 10-2 = 0,01 mili m 10-3 = 0,001 micro μ 10-6 = 0,000 001 nano n 10-9 = 0,000 000 001 pico p 10-12 = 0,000 000 000 001 femto f 10-15 = 0,000 000 000 000 001 atto a 10-18 = 0,000 000 000 000 000 001 zepto z 10-21 = 0,000 000 000 000 000 000 001 yocto y 10-24 = 0,000 000 000 000 000 000 000 001 24 Fonte: Inmetro A – Para formar o múltiplo ou submúltiplo de uma unidade, basta colocar o nome do prefixo desejado na frente do nome dessa unidade. O mesmo se dá com o símbolo. Exemplo: Para multiplicar e dividir a unidade volt por mil quilo + volt = quilovolt ; k + V = kV mili + volt = milivolt ; m + V = mV B – Os prefixos SI também podem ser empregados com unidades fora do SI. milibar; quilocaloria; megatonelada; hectolitro C – Por motivos históricos, o nome da unidade SI de massa contém um prefixo: quilograma. Por isso, os múltiplos e submúltiplos dessa unidade são formados a partir do grama. Fonte: Inmetro Pós-Graduação a Distância Exemplo: 15 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Curiosidade A necessidade de medir é muito antiga e remonta à origem das civilizações. Por longo tempo, cada país, cada região teve o seu próprio sistema de medidas, baseado em unidades arbitrárias e imprecisas, como, por exemplo, aquelas baseadas no corpo humano: palmo, pé, polegada, braça, côvado. Isso criava muitos problemas para o comércio, porque as pessoas de uma região não estavam familiarizadas com o sistema de medida das outras regiões. Imagine a dificuldade em comprar ou vender produtos cujas quantidades eram expressas em unidades de medida diferentes e que não tinham correspondência entre si. Em 1789, numa tentativa de resolver o problema, o Governo Republicano Francês pediu à Academia de Ciências da França que criasse um sistema de medidas baseado numa “constante natural”. Assim foi criado o Sistema Métrico Decimal. Posteriormente, muitos outros países adotaram o sistema, inclusive o Brasil, aderindo à “Convenção do Metro”. O Sistema Métrico Decimal adotou, inicialmente, três unidades básicas de medida: o metro, o litro e o quilograma. Entretanto, o desenvolvimento científico e tecnológico passou a exigir medições cada vez mais precisas e diversificadas. Por isso, em 1960, o sistema métrico decimal foi substituído pelo Sistema Internacional de Unidades – SI, mais complexo e sofisticado, adotado também pelo Brasil, em 1962, e ratificado pela Resolução no 12 de 1988, do Conselho Nacional de Metrologia, Normalização e Qualidade Industrial – Conmetro, tornando-se de uso obrigatório em todo o território nacional. Fonte: Inmetro O laboratório é o local onde realizamos os experimentos que possam comprovar as nossas hipóteses e teorias ou para servir de base para aprofundar e fixar os conhecimentos teóricos apresentados em sala de aula pelos professores. É o melhor lugar para se praticar e entender os fenômenos químicos. Deveria ser um ambiente silencioso e calmo, onde os pesquisadores e estudantes pudessem se concentrar para ensinar e aprender. Nem sempre é assim. Principalmente quando nos deparamos com turmas de trinta, cinquenta alunos. Para minimizar os problemas que podem aparecer por trabalhar em um ambiente que muitas vezes contém substâncias tóxicas como as carcinogênicas, as irritantes do sistema respiratório, da pele e dos olhos, é necessário seguir um conjunto de normas que aumentem a segurança dos usuários do laboratório e o bom funcionamento dos equipamentos. A acuricidade deve ser o objetivo de qualquer bom laboratório, pois isso é que leva a resposta precisa sobre a os fenômenos biológicos investigados. Materiais e Experimentos no Ensino de Química Essas normas englobam desde o uso de vidrarias, equipamentos e postura, até a lavagem, descarte e procedimentos de primeiros socorros. Todos que já trabalham com pesquisa ou ensino e já usaram os laboratórios conhecem pelo menos uma história, onde a falta de cuidado ou de estrutura resultou em acidente, tenha sido ele grave ou não. Uma apostila, muitas vezes, necessita ser impessoal e técnica. Porém gostaria de compartilhar a história de um grave acidente ocorrido na Universidade de Brasília (UnB), na época da minha graduação. Eu não estava na UnB naquele dia, mas fiquei sabendo do ocorrido rapidamente. O problema aconteceu quando uma colega fazia a extração de glicogênio hepático para quantificar a glicose no tecido. O glicogênio é uma longa molécula ramificada composta apenas por subunidades repetidas de glicose, que são unidas por um tipo de ligação chamada o-glicosídica. A seguir, temos o glicogênio unido através das ligações glicosídicas. (STRYER, 2006) 16 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Para romper essa ligação é necessário utilizar certas condições fisiológicas e químicas, a fim de extrair o máximo de glicose para quantificação. Uma dessas condições exige o uso de ácido sulfúrico (H2SO4) aquecido a 100oC. Neste dia, para realizar o experimento, um béquer de grande volume contendo o ácido aquecido estava apoiado em um tripé que deixava o frasco em uma posição um pouco acima dos olhos. Desconheço o que houve exatamente no momento do acidente, mas sei que o frasco cheio com o ácido caiu muito quente sobre a aluna. Para agravar a situação o chuveiro de emergência do laboratório não funcionou. Não havia água naquele momento. Esses problemas agravaram a situação. Os braços e o rosto da aluna sofreram sérias queimaduras de 1o, 2o e 3o graus. Ela foi submetida a diversas cirurgias para reconstrução dos tecidos atingidos. Esse processo lento de recuperação durou uns dois anos. A UnB foi processada e, antes disso, mudou os procedimentos que deviam tornar os laboratórios mais seguros, incluindo maior fiscalização. A figura a seguir mostra diferentes graus de queimadura. Hoje os laboratórios estão mais seguros. Se tais exigências de segurança tivessem sido adotadas, seguidas rigorosamente, se houvesse mais fiscalização teríamos evitado esse e vários outros pequenos acidentes, que muito provavelmente não vieram ao conhecimento da comunidade universitária. A novidade é que a construção do novo prédio para o Instituto de Química (IQ) e o Instituto de Biologia (IB) teve o seu projeto feito sob rígidas regras de segurança. Que regras seriam essas? Como trabalhar no laboratório de forma segura? Nesta apostila, vamos detalhar algumas dessas normas para que sejam seguidas durante o trabalho em laboratório de universidades ou escolas públicas e particulares. As regras gerais de segurança num laboratório químico, descritas nesse Caderno, foram extraídas, e parcialmente modificadas, do manual da Universidade Federal do Rio Grande do Sul. Pós-Graduação a Distância Não sou especialista em segurança de laboratório, mas durante os 11 anos em que estive envolvido com a pesquisa, o bom senso e alguns acidentes, que felizmente não levaram a consequências graves, mostraram-me a importância de seguir as regras de uso de um laboratório. Isso evitou muitos problemas na minha vida acadêmica. 17 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Fonte:www.ci.esapl.pt/lab/ REGRAS GERAIS DE SEGURANÇA TÓPICOS A – Incêndio. B – Alimentos. C – Normas básicas para uso de equipamentos elétricos. D – Cuidados a serem tomados no trabalho com as substâncias químicas no laboratório. Materiais e Experimentos no Ensino de Química E – Trabalho com gases sob alta pressão. 18 F – Instrumentos. A – INCÊNDIO 1. CUIDADOS PARA EVITAR INCÊNDIOS • Assegurar o bom estado dos quadros da rede elétrica. • Assegurar o uso adequado das tomadas conforme recomendações especificadas no capítulo “Normas básicas para uso de equipamento elétrico”. • Armazenamento dos bujões de gás em local bem ventilado fora do prédio. Tolera-se o uso de bujões de até 13kg no interior do prédio em áreas seguras. • Solventes químicos não podem ser armazenados próximos a fornos, estufas e locais aquecidos. • Os laboratórios devem ser fechados adequadamente, porém permitindo o acesso à Brigada de Incêndio, visto que o incêndio pode se alastrar e ameaçar a instituição como um todo. O Estudo da Química: A Teoria e a sua Contextualização Unidade II 2. EQUIPAMENTOS PARA CONTROLAR INCÊNDIOS • Extintores de incêndio para produtos químicos (extintores PQS de pó), eletricidade (extintores de CO2) e para papéis (extintores de água pressurizada) devem estar à disposição. • Em instalações que utilizam muito equipamento elétrico, deve-se ter um maior número de extintores para eletricidade; em locais que contenham muitos produtos químicos, deverá haver mais extintores PQS. Os dois podem ser utilizados em ambos os casos, porém procurando sempre utilizar o mais adequado. • Os extintores devem estar dentro do prazo de validade e fixados em locais de fácil acesso, como, por exemplo, nos corredores. Em locais de maior periculosidade, recomenda-se que haja um extintor a cada 10m. Também se recomenda a colocação de um extintor dentro dos laboratórios que contenham muitos solventes ou equipamentos elétricos. 3. COMO PROCEDER EM CASO DE INCÊNDIO • Se forem percebidos indícios de incêndios (fumaça, cheiro de queimado, estalidos), aproxime-se a uma distância segura para ver o que está queimando e a extensão do fogo. • Dê o alarme pelo meio disponível aos responsáveis. • Se não souber combater o fogo, ou não puder dominá-lo, saia do local, fechando todas as portas e janelas atrás de si, mas sem trancá-las, desligando a eletricidade, alertando os demais ocupantes do andar e informando os laboratórios vizinhos da ocorrência do incêndio. • Não perca tempo tentando salvar objetos, salve sua vida. Mantenha-se vestido, pois a roupa protege o corpo contra o calor e a desidratação. • Procure alcançar o térreo ou as saídas de emergência do prédio, sem correr. • Jamais use o elevador, pois a energia é normalmente cortada, e ele poderá ficar parado, sem contar que existe o risco dele abrir justamente no andar em chamas. • É da responsabilidade de cada chefe de laboratório conhecer os disjuntores de suas instalações. Classes de Incêndios: • Classe “A”: materiais que queimam em superfície e em profundidade. Exemplos: madeira, papel, tecido. • Classe “B”: os líquidos inflamáveis queimam na superfície. Exemplos: álcool, gasolina, querosene. • Classe “C”: equipamentos elétricos e eletrônicos energizados. Exemplos: computadores, televisores, motores. Procure controlar as chamas com o extintor de incêndio adequado. Tipos de extintores: • Água pressurizada-gás: Indicado com ótimo resultado para incêndios de classe “A”. Contraindicado para as classes “B” e “C”. No momento do uso, rompa o lacre e aperte o gatilho, dirigindo o jato para a base do fogo. • Água-gás: Pós-Graduação a Distância • Classe “D”: materiais que requerem agentes extintores específicos. Exemplos: pó de zinco, sódio, magnésio. 19 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Esse tipo possui uma pequena ampola de ar comprimido. Abra o registro da ampola de gás e dirija o jato para a base do fogo. Processo de extinção: resfriamento. • Extintor de espuma: Indicado com ótimo resultado para incêndios de classe “B” e com bom resultado para a classe “A”. Contraindicado para a Classe “C”. Aproxime-se com segurança do líquido em chamas, inverta a posição do extintor (posicione-o de cabeça para baixo) e dirija o jato para um anteparo, de modo que a espuma gerada cubra o líquido como uma manta. Processo de extinção: abafamento. Um processo secundário é o resfriamento (umidificação). • Extintor de pó químico seco: Indicado com ótimo resultado para incêndios de Classe “C” e sem grande eficiência para a classe “A”. Não possui contraindicação. Modo de usar: Rompa o lacre e aperte o gatilho, dirigindo o jato para base do fogo. Processo de extinção: abafamento. • Extintor de gás carbônico: Indicado para incêndios de classe “C” e sem grande eficiência para a classe “A”. Não possui contraindicação. Modo de usar: rompa o lacre e aperte o gatilho, dirigindo o difusor para a base do fogo. Não toque no difusor, pois com a passagem de gás por ele, poderá gelar e agarrar a pele ao ser tocado. Processo de extinção: abafamento. Obs.: Incêndios de Classe “D” requerem extintores específicos podendo, em alguns casos, ser utilizado o de gás carbônico (CO2) ou pó químico seco (PQS). Materiais e Experimentos no Ensino de Química ATENÇÃO! 20 Vapores podem ser fontes de explosões e incêndios. Por exemplo, éter (utilizado para anestesiar e sacrificar animais) libera vapores potencialmente explosivos. Em laboratórios que costumam guardar, na geladeira, carcaças de animais em formol, podem também ocorrer explosões, como consequência de faíscas geradas dentro da geladeira fechada. Fumaça inalada pode causar problemas graves e até fatais. Produtos de laboratório são, em muitos casos, inflamáveis e/ou explosivos. Eles podem agravar um incêndio de origem elétrica, tanto ao espalhar as chamas quanto ao provocar ferimentos por estilhaços. Incêndios podem ser gerados por reações químicas como, por exemplo, a neutralização de ácidos fortes por bases fortes. Recomenda-se que materiais passíveis de reagirem entre si sejam guardados em armários separados. B – ALIMENTOS Norma básica de segurança: “É proibido comer ou beber nos laboratórios químicos“. As refeições devem ser tomadas em refeitórios ou em espaços do laboratório em que não se trabalhe com material químico. Sugere-se que seja reservada uma geladeira especialmente para a guarda de alimentos e que essa se situe em local afastado de reagentes químicos e gases. O Estudo da Química: A Teoria e a sua Contextualização Unidade II É PROIBIDO GUARDAR, JUNTOS, ALIMENTOS COM REAGENTES OU MATERIAL QUÍMICO NA GELADEIRA. C – NORMAS BÁSICAS PARA USO DE EQUIPAMENTOS ELÉTRICOS Você não sabe qual tensão do equipamento? 110 ou 220V? 50 ou 60Hz? Verifique sempre a tensão da tomada em que deseja ligar o seu equipamento, bem como a voltagem e frequência em que o aparelho deve operar. Para evitar problemas, é necessário que todas as tomadas estejam identificadas com as voltagens, em locais visíveis, por exemplo, sinalizadas com as cores amarelo para 110V e laranja para 220V. Está funcionando? Antes de ligar, veja se o equipamento está realmente em condições de uso. Pode ser que ele esteja danificado. Caso ocorra alguma anomalia enquanto estiver usando-o, comunique imediatamente ao responsável e/ou coloque um aviso, em local visível, para servir de alerta a outros usuários do equipamento. Como funciona? Em caso de dúvida quanto ao funcionamento de um equipamento, procure o responsável por ele. Não tente adivinhar como funciona. Tenha sempre em mãos os procedimentos básicos de operação do aparelho. De preferência fixe um lembrete, junto a ele, com as instruções necessárias para uma perfeita utilização. A rede suporta a tensão gerada pelos equipamentos? Toda instalação elétrica tem um limite de capacidade em função do quadro de força e do tipo de fiação. A luz é de graça? O que hoje é desperdício, amanhã pode significar falta. Ao término do expediente verifique se todos os equipamentos foram desligados, inclusive luzes e aparelhos de ar condicionado. Deixe ligado somente o que for realmente necessário. Lembre-se: Em caso de dúvida ou anormalidade deve-se procurar o responsável pelo equipamento. A prevenção é sempre a melhor forma de evitar acidentes. D – CUIDADOS A SEREM TOMADOS COM AS SUBSTÂNCIAS QUÍMICAS UTILIZADAS NO TRABALHO DE LABORATÓRIO • Todo o laboratório que faz uso de produtos químicos potencialmente tóxicos deve dispor de uma coletânea das respectivas fichas de emergências, MSD (Material Safety Data). Essas fichas de emergência geralmente acompanham o fornecimento dos produtos, porém podem ser requisitadas junto à empresa fornecedora se necessário. • O uso de óculos de segurança é obrigatório no caso de não existir outro anteparo durante as operações com pequenas quantidades de material potencialmente explosivo e em situações onde possa ocorrer projeção de pó, líquidos e fragmentos sólidos. • A proteção facial através de máscara rígida de acrílico, ou outro tipo de anteparo, é aconselhado quando se tratar de trabalhos com possibilidade de acidentes de maior proporção. Pós-Graduação a Distância Proteção Pessoal 21 O Estudo da Química: A Teoria e a sua Contextualização Unidade II • Evitar o uso de lentes de contato em operações químicas. Em casos de líquidos, ou fragmentos atingirem o olho, a retirada das lentes de contato, pela sua morosidade, pode levar a lesões irreversíveis. • Quando se faz pesagem de produtos em forma de pó, como, por exemplo, a sílica, deve-se utilizar máscaras absorventes. • Usar luvas isolantes e recipientes apropriados para o transporte de nitrogênio líquido. Fonte:http://www.ci.esapl.pt/lab/template2_files/image016.png Cuidados a serem tomados no laboratório • Não armazenar produtos químicos próximos a fontes de calor como, por exemplo, autoclaves, fornos e estufas. • Quando se tratar de solventes orgânicos ou produtos facilmente inflamáveis recomenda-se que eles sejam cuidadosamente fechados e mantidos a uma certa distância dos quadros de força. • Ácidos e bases não devem ser estocados juntos. Às vezes, torna-se necessária a instalação de exaustores. • A abertura de frascos com produtos de alta volatilidade deve ser feita só em capela. • Bancada organizada diminui muito os riscos de acidentes. Materiais e Experimentos no Ensino de Química • Só armazenar cilindros de gases sob pressão, fixados por meios de correntes às paredes. 22 • Não manusear os cilindros usando as válvulas como apoio. Para transportá-los, usar carro apropriado. Em caso de acidentes • Em caso de vazamento, isole imediatamente a área. Elimine qualquer fonte de ignição; não toque no produto sem luvas adequadas; absorva o material com areia ou outro material absorvente não combustível. • Se houver vapores, pode ser utilizado, em muitos casos, neblina de água. Nessas situações utilize proteção individual para o manuseio incluindo máscaras para proteção respiratória. • Se houver fogo, utilize de preferência os extintores de pó químico. Os extintores de CO2 e, com menos eficiência, os de água, também podem ser utilizados. • Se houver vítima, remova-a imediatamente do local. Se necessário faça respiração artificial. Em casos de contato do produto com o corpo, remova a roupa contaminada, lave a pele e os olhos com água corrente durante 15 minutos e chame o médico. O Estudo da Química: A Teoria e a sua Contextualização Unidade II • Em caso de escapamento de gases no laboratório, controlar o vazamento abrindo as janelas e portas para a eliminação desses gases, tendo o cuidado de evitar qualquer forma de ignição. Considere a opinião de alguém de fora do laboratório na identificação de escapamento de algum gás, pois após 2 minutos o olfato humano se acostuma com o cheiro. ATENÇÃO! Há produtos altamente tóxicos que somente algumas pessoas conseguem perceber pelo olfato, como o cianeto. Nunca se devem ignorar as reclamações de cheiros estranhos apenas com base no fato de que nem todos sentiram o cheiro. O olfato é, na realidade, um dos sentidos que menos se enganam: não deixe de investigar a origem de qualquer odor incomum ou vapor nocivo. Remoção de feridos e noções básicas de primeiros socorros A ocorrência de ferimentos em laboratório é intrínseca às tarefas que realizamos. Mesmo diante de um plano bem elaborado de trabalho é possível que ocorra um acidente que pode levar a ferimentos de todo o tipo. O mais importante em relação aos primeiros socorros é saber o que não se deve fazer. Veremos alguns casos mais comuns de acidentes possíveis de ocorrer. Queimaduras: deixe o exame do grau de queimadura para um médico, concentre-se em evitar o agravamento da lesão. As queimaduras podem ser de dois tipos: Queimaduras químicas: quando provocadas por ação cáustica de bases, ácidos, sais, normalmente são resolvidas, inicialmente, com lavagem abundante em água corrente. Dependendo do grau da lesão, pode ser necessário atendimento médico que deve ser o mais rápido possível. Procure auxílio do pessoal de emergência ou do seu professor. Queimaduras por calor: podem ser por contato direto, quando tocamos ou somos atingidos por material aquecido, por imersão ou projeção de líquidos aquecidos. Também nesses casos lave com bastante água corrente e mantenha limpo o local. Caso seja necessário use o chuveiro de emergência. Choques Elétricos: duas ocorrências são possíveis em choques elétricos: trauma e parada cardio-respiratória. Trauma pode ser uma queimadura normalmente de terceiro grau com destruição de tecido ou lesões provocadas por arremesso da vítima pela descarga elétrica. Ao socorrista existe uma recomendação, enquanto houver a mais remota hipótese de a vítima estar energizada, não toque em nenhuma parte de seu corpo. Desligue a energia ou afaste os fios elétricos usando um material não condutor, somente assim inicie o socorro ao acidentado. Em todos os casos examine a vítima atentamente, verifique as condições do local e descubra o máximo de informações possíveis sobre o acidente. Verifique se o acidentado respira, se está consciente e seu grau de consciência (se está confuso ou lúcido). Pós-Graduação a Distância ATENÇÃO! A presteza no atendimento inicial é fundamental para a restauração dos tecidos humanos. Lembre-se do acidente ocorrido na UnB relatado anteriormente. 23 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Observe os riscos que você e o acidentado podem estar expostos no cenário do acidente e somente então pense em remover a vítima. Todos esses passos, você não vai dar sozinho. Procure auxílio. Não tente transportar uma vítima inconsciente sem ajuda. Rejeitos químicos: existe um serviço que tem por objetivo eliminar todos os rejeitos classificados como de alta e média toxicidade e que não podem ser descartados no lixo e esgoto comuns. As substâncias com alta solubilidade podem ser descartadas dentro de certos limites estabelecidos pelo IBAMA. As concentrações de descarte de produtos de baixa solubilidade são muito menores. Entre esses produtos situam-se muitos solventes orgânicos. Devem ser separados os rejeitos líquidos dos sólidos e os orgânicos dos metais pesados inorgânicos. É importante considerar estas diferenças para que não se produzam mais rejeitos do que o estritamente necessário, pois os custos de queima são altos. Os rejeitos devem ser coletados de acordo com as regras próprias a esse serviço, em recipientes adequados, levandose em consideração a incompatibilidade dos recipientes com a natureza química do rejeito. Todos os frascos devem ser acondicionados em caixas de papelão. Certifique-se de que não há incompatibilidade química entre os componentes. Todo material a ser descartado deve ter um rótulo contendo nome da unidade, departamento, nome do laboratório, nome do responsável, composição química qualitativa e data do armazenamento. Quando atingir determinados volumes, o material será transportado para o setor de rejeitos químicos. E – TRABALHANDO COM GASES SOB ALTA PRESSÃO • Com toda a certeza em algum momento do curso você vai lidar com gases sob alta pressão, seja sob forma de: a) gás combustível (por exemplo: hidrogênio, metano); b) gás comburente (por exemplo: oxigênio); ou c) gás inerte (por exemplo: nitrogênio, argônio). O cuidado deve ser o mesmo. • Não transporte o cilindro usando as mãos (rolando); use sempre o carro adequado. Nunca transporte o cilindro sem a proteção da válvula, pois uma queda poderá quebrar a válvula dele e o gás deslocará violentamente o cilindro arremessando-o com sérias consequências. Materiais e Experimentos no Ensino de Química • Cada fabricante adota um tipo de conector, que pode ser de: a) rosca interna; b) rosca externa, sem ou com vedação (plana ou semiesférica). Não improvise. Use a válvula reguladora recomendada para cada gás. Alguns gases absorvem calor ao expandir e podem congelar a válvula, outros não podem entrar em contato com peças de cobre (por exemplo: gás acetileno) e outros não devem entrar em contato com grafite, óleos ou graxas (como, por exemplo: gás oxigênio), lembre-se: NÃO IMPROVISE! 24 • Atente para o tipo de material utilizado no experimento, pois deve ser considerada com muito cuidado a INCOMPATIBILIDADE QUÍMICA entre o gás e a tubulação e demais materiais. (Vide tabelas específicas disponibilizadas pelas empresas fornecedoras de gases especiais). • JAMAIS LUBRIFIQUE UMA VÁLVULA DE QUALQUER GÁS. Caso ocorra um problema, recorra ao professor ou aos técnicos do instituto, pois eles estão aptos e dispostos a auxiliá-lo. • As válvulas reguladoras de pressão dos gases inflamáveis são conectadas ao cilindro por meio de uma rosca esquerda, ou seja, a rosca deve ser usada girando no sentido contrário aos ponteiros do relógio (anti-horário) para aperto. As porcas de aperto possuem um pequeno vinco entre as faces sextavadas (número de faces da porca), significando que são de rosca esquerda. • Sempre que instalar um cilindro, prenda-o com uma corrente bem resistente e use ganchos de metal que estejam firmes na parede ou bancadas. • Caso haja necessidade de utilização de gás combustível tipo GLP através da Central de Gás, procure identificar a válvula geral de cada laboratório, bem como as válvulas de cada bico de gás, procurando evitar vazamentos. Cuidar o direcionamento da chama, e evitar a proximidade de solventes inflamáveis junto aos bicos de gás. • Ao concluir o experimento, verifique o completo fechamento de todos os registros e válvulas de gás. O Estudo da Química: A Teoria e a sua Contextualização Unidade II F – INSTRUMENTOS • Almofariz e Pistilo: aparelho usado na trituração e pulverização de sólidos. • Anel ou Argola: suporte do funil de filtração simples ou do funil de separação de líquidos imiscíveis. • Balão de destilação ou de Engler: balão de fundo chato com saída lateral para passagem dos vapores durante uma destilação. • Balão de fundo chato: empregado para aquecimento ou armazenamento de líquidos ou solução. • Balão de fundo redondo: usado para aquecimento de líquidos e reações com desprendimento gasoso. • Balão volumétrico: usado para preparação de soluções, mas não deve ser aquecido. • Bastão de vidro ou Bagueta: bastão maciço de vidro que serve para agitar e facilitar as dissoluções, mantendo as massas líquidas em constante movimento. Também auxilia na filtração. • Bico de Bunsen: fonte de aquecimento mais usado no laboratório. • Bureta: serve para dar escoamento a volumes variáveis de líquidos. Não deve ser aquecida. É constituída de tubo de vidro uniformemente calibrado, graduado em décimos de mililitro e provida de um dispositivo que permite o fácil controle de escoamento. • Cadinho: usado para calcinação (aquecimento a seco muito intenso) de substâncias. Pode ser aquecido diretamente a chama do bico de Bunsen, apoiado sobre triângulo de porcelana, platina, amianto, etc. • Coluna de Vigreaux: utilizada na destilação fracionada. • Cápsula de porcelana: peça de porcelana utilizada em sublimações ou evaporações de líquidos e soluções. • Condensador: utilizado em destilações, tem por finalidade condensar os vapores dos líquidos. • Copo de Béquer: serve para dissolver substâncias, efetuar reações químicas. Pode ser aquecido sobre o tripé com tela de amianto. • Dessecador: usado para resfriamento de substâncias em atmosfera, contém baixo teor de umidade. • Erlenmeyer: utilizado para titulações, aquecimento de líquidos, dissolução de substâncias e realização de reações químicas. Pode ser aquecido sobre o tripé com tela de amianto. • Espátula: material de aço ou porcelana, usado para transferência de substâncias sólidas. Deve ser lavada e enxugada após cada transferência. • Estante para tubos de ensaio. • Funil comum: usado para transferência de líquidos. • Funil analítico: usado para filtração para retenção de partículas sólidas. Deve conter em seu interior um filtro que pode ser de papel, lã de vidro, algodão vegetal, dependendo do material a ser filtrado. O funil não deve ser aquecido. • Funil de Buchner: usado na filtração a vácuo. • Funil de decantação ou de separação: usado para separação de líquidos imiscíveis. Pós-Graduação a Distância • Suporte para tubos de ensaio. 25 O Estudo da Química: A Teoria e a sua Contextualização Unidade II • Furador de rolhas: usado para furar rolhas de cortiça ou de borracha. • Garra de condensador: usada para prender o condensador à haste do suporte ou outras peças como balões, elenmeyer, etc. • Kitassato: usado em conjunto com o funil de Buchner na filtração a vácuo. • Mariotte: frasco utilizado para armazenamento de água destilada em laboratório. • Mufa: suporte para a garra de condensador. • Picnômetro: usado para determinar a densidade de líquidos. É um material de vidro de grande precisão, por isso não pode ser secado por aquecimento. • Pera de segurança: usada para pipetar soluções. • Pinça de madeira: usada para prender tubos de ensaio durante o aquecimento direto no bico de Bunsen. • Pinça metálica ou tenaz de aço: usada para manipular materiais aquecidos, como cadinhos, béqueres, etc. • Pinças de Mohr e de Hoffman: usadas para impedir ou reduzir a passagem de gases ou líquidos através de tubos flexíveis. • Pipeta graduada: tubo de vidro estreito geralmente graduado em 0,1mL. É usada para medir pequenos volumes líquidos. Encontra pouca aplicação sempre que se deseja medir volumes líquidos com maior precisão. Não deve ser aquecida. • Pipeta volumétrica: tubo de vidro com um bulbo na parte central. O traço de referência é gravado na parte do tubo acima do bulbo. É usada para medir volumes de líquidos com elevada precisão. Não deve ser aquecida. • Pisseta: usada para lavagem de materiais ou recipientes através de jatos de água destilada, álcool ou outros solventes. • Proveta ou cilindro graduado: recipiente de vidro ou plástico utilizado para medir e transferir volumes de líquidos. Não deve ser aquecida. Materiais e Experimentos no Ensino de Química • Suporte universal: utilizado em várias operações como: filtrações, suporte para condensador, sustentação de peças, etc. 26 • Tela de amianto: usada para distribuir uniformemente o calor recebido pela chama do bico de Bunsen. • Termômetro: usado para medir a temperatura durante o aquecimento em operações como: destilação simples, fracionada, etc. • Triângulo de porcelana: suporte para cadinhos em aquecimento direto no bico de Bunsen. • Tripé de ferro: suporte para tela de amianto ou triângulo de porcelana, usado em aquecimento. • Trompa de água: utilizada para provocar o vácuo. • Tubo de ensaio: empregado para fazer reações em pequena escala, notadamente em teste de reações. Pode ser aquecido, com cuidado, diretamente sobre a chama do bico de Bunsen. • Tubo de Thielle: usado na determinação do ponto de fusão. • Vareta de vidro: cilindro de vidro, oco, de baixo ponto de fusão. Serve para interligar balões, condensadores, ou fabricação de pipetas e capilares. O Estudo da Química: A Teoria e a sua Contextualização Unidade II • Vidro de relógio: peça de vidro de forma côncava. É usado para cobrir béqueres, em evaporações, pesagens de diversos fins. Não pode ser aquecido diretamente na chama do bico de Bunsen. A seguir, temos as imagens das vidrarias e de alguns equipamentos usados nas aulas práticas e nos laboratórios de Química. Veja a lista e observe as figuras. Você consegue discriminá-los? Existem vários tipos de lixo. O principal poluente do lixo que afeta a qualidade da água dos mananciais de superfície e subterrâneos é o chorume, líquido resultante da lavagem dos lixões pelas águas das chuvas; é um dos maiores poluentes conhecidos, comparando-se ao vinhoto, resultante da indústria sucroalcoeira. O lixo lançado nos córregos serve de substrato para as larvas de mosquitos e impedem o fluxo da água, sendo uma das principais causas das enchentes urbanas. Pós-Graduação a Distância O lixo é um problema ambiental interessante. Como destinar 56k de lixo produzidos por um cidadão comum em uma cidade como São Paulo, que possui um total de 18 milhões de habitantes? Esse assunto tem preocupado ambientalistas, governos e cidadãos. 27 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Capítulo 3 – O Uso de Materiais mais Acessíveis no Ensino de Química nos Laboratórios A Química é a ciência experimental que estuda a composição, as propriedades e as transformações da matéria e o seu envolvimento energético, visando à compreensão de sua natureza e comportamento e, quando possível, o seu aproveitamento pelo homem. (FALJONI-ALARIO, 1998). Tudo a nossa volta sofre o impacto da Química. O desenvolvimento de nossa civilização ocorreu pelo domínio de diversos processos. O uso dos minerais em metais, por exemplo, deu origem a ferramentas que propiciaram o desenvolvimento acelerado da agricultura e a criação de armas, como as espadas, mais resistentes. A fermentação do pão, descoberta pelos egípcios e aprimorada pelos romanos, o processo de destilação deu mais poder sobre o ambiente. Os eventos que marcaram o início de nossa civilização não teriam ocorrido sem a Química. Materiais e Experimentos no Ensino de Química A descoberta do aço teve um profundo impacto no desenvolvimento da química na nossa sociedade, pois levou a Revolução Industrial. A força dos músculos deu lugar ao uso de máquinas a vapor. As relações comerciais foram alteradas com a criação de navios movidos a vapor, o que aumentou de forma impressionante o comércio no mundo. Nada disso teria acontecido sem a Química. 28 <http://www.historiadomundo.com.br/imagens/idademoderna_industrial2.gif> A nossa civilização cresceu e ocupou espaços em nosso planeta como nenhuma outra espécie o fez. Após o século XIX passamos de um bilhão de pessoas. Demoramos muitos séculos para chegar a esse número. Hoje somos mais de seis bilhões em todo o planeta e esse processo durou menos de 100 anos. O desenvolvimento da Química teve grande responsabilidade nesse processo, que desencadeou o aumento da população. Por isso é natural que devamos estudar mais Química, divulgando-a com mais clareza e de forma mais interessante, para que seja possível buscar as respostas para os diversos problemas que nos atingem, como aqueles ligados ao meio ambiente, à produção de alimentos e à cura de doenças. Por tudo isso a sua contextualização é a chave desta nova forma de aprender e tornar essa disciplina mais interessante aos alunos. Veja o caso dos radicais livres (RLs). Nos últimos anos eles têm sido amplamente investigados, quanto à sua origem, estrutura, mecanismos de ação celular. A compreensão da interação química dos RLs aumenta as possibilidades de cura, de melhoras da qualidade e do tempo de vida das pessoas. O tema tem recebido ampla divulgação pelos meios de comunicação, tendo se tornado, rapidamente, de domínio público. (YOKAICHIYA; GALEMBERG; BAYADO, 2000; HALLIWELL; GUTTERIDGE, 2000). O Estudo da Química: A Teoria e a sua Contextualização Unidade II O que são essas moléculas? Os RLs podem ser definidos como moléculas que possuem elétrons desemparelhados na última camada. Exemplos de radicais livres são: radical hidroxil (OH.), ânion superóxido (O2-), radical peroxil (ROO.), radical alcoxil (RO.) e óxido nítrico. (NO.) (HALLIWELL & GUTTERIDGE, 2000). A sua origem ocorre em algumas organelas no organismo como as mitocôndrias e o retículo endoplasmático. Ambas as estruturas estão envolvidos na geração de RLs, e também são suscetíveis ao estresse oxidativo (LENZ, 1998) e os danos a essas moléculas ocasionam a geração de várias patologias, que possuem um papel crítico na manutenção da vida. (INOUE et al., 2003). Como dito anteriormente, os esforços em estudá-los são devido ao fato de que essas moléculas são responsáveis por danos biológicos sérios. Devida a sua instabilidade química elas podem reagir com várias classes de moléculas biológicas como proteínas, carboidratos, DNA, lipídeos de membrana. (HALLIWELL & GUTTERIDGE, 2000). A interação desses radicais livres com vários os grupos de macromoléculas biológicas (DNA, RNA, açúcares, proteínas) podem resultar em graves danos celulares. Os radicais livres são comuns nos sistemas biológicos e de fato essenciais para a manutenção da vida. (SIES 1997, BALASSUBRANIAM et al., 1998; HALLIWELL & GUTTERIDGE, 2000). Não apenas a célula é fonte de radicais livres. A poluição, a radiação solar, o estresse e outrso compostos químicos são fontes da produção deles. Algumas dessas fontes são mostradas a seguir: Figura 1 – Fontes de produção dos oxiradicais Fonte: Halliwell; Gutteridge O processo de peroxidação lipídica pode ser dividido em três eventos: iniciação, propagação e terminação. Na iniciação temos a reação dos Rls com os lipídios de membrana (representados por L) de onde retiram um átomo de hidrogênio de grupos metileno [6]. O radical L• pode reagir com O2 levando à formação do radical peroxil [7]. Esse é responsável pela propagação da peroxidação lipídica, porque consegue abstrair um hidrogênio de outra molécula lipídica adjacente [8] (AHMAD, 1995). • OH + LH L• + O2 LOO• + LH L• + H2O LOO• LOOH [6] [7] [8] Pós-Graduação a Distância Como mostrar ao aluno em sala de aula o papel dos radicais livres na peroxidação lipídica, por exemplo? Em plantas e animais a peroxidação lipídica é resultante da ação de RLs em lipídeos de baixa densidade na membrana, onde são oxidados a peróxidos lipídicos. A oxidação desses lipídios nos seres humanos está associada com a etiologia da arteriosclerose (KALYANARAMAN, 1995) e com outras patologias associadas aos processos pós-isquêmicos. (HALLIWELL; GUTTERIDGE, 2000). 29 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Depois da etapa de iniciação e propagação, segue-se a terminação quando os radicais podem ser neutralizados pelas defesas antioxidantes não enzimáticas como, por exemplo, a vitamina E, os carotenóides e as antocianinas (AHMAD, 1995; HALLIWELL; GUTTERIDGE, 2000). Então uma das formas de combater os RLs é através das defesas antioxidantes. Observe um jardim ou as frutas e verduras em um supermercado e veja as suas cores. Mais do que atrair os polinizadores, ou indicar a sua toxicidade elas servem como indicadores de que ali existem substâncias antioxidantes. Os pigmentos que fornecem as cores (rosa, azul, vermelho e suas variações) encontradas na maioria das espécies são conhecidos por antocianinas. Essa palavra vem do grego (anthos: flor; kyanéos/cyan: azul) e essas substâncias são classificada como flavonóides. Uma de suas principais propriedades é proteger as plantas contra a radiação solar, pois ela é uma das fontes de produção dos radicais livres. Para mostrar aos alunos o papel dos radicais livres e das defesas antioxidantes elabore um procedimento com as antocianinas extraídas das pétalas de flores ou de frutos como o açaí e um pouco de manteiga. Esse experimento servirá para discutir várias questões em sala de aula: 1. O que é um processo oxidativo? 2. Qual a concentração mínima de antocianinas capaz de impedir a oxidação? A concentração será definida em termos de mL de extrato utilizado. 3. Observando os resultados da oxidação, como explicar o processo que desencadeia a arteriosclerose? Materiais e Experimentos no Ensino de Química Outra aplicação para as antocianinas no laboratório é servir na avaliação do pH de soluções simples como o vinagre, a água de torneira, por exemplo. De acordo com Ramos e colaboradores (2000), as antocianinas, quando extraídas do meio natural, apresentam-se na forma de sais de flavílio, normalmente glicosiladas, ou seja, ligadas a moléculas de açúcares, sendo os mais comuns a D-glucose, a D-galactose e a D-ramnose1. Quando livres dos açúcares são chamadas antocianidinas. As estruturas mais comuns apresentadas pelas antocianidinas são apresentadas na Figura 3. 30 Figura 2 – Estruturas das antocianidinas comumente encontradas em tecidos vegetais O Estudo da Química: A Teoria e a sua Contextualização Unidade II COMPOSTO R1 R2 CIANIDINA PEONIDINA DEFINIDINA PETUNIDINA MALVIDINA PELARGONIDINA OH OCH2 OH OCH2 OCH2 H H H OH OH OCH2 H Ele mostraram ser possível realizar experimentos simples, com baixo custo, utilizando-se de vegetais facilmente encontrados no Brasil. Os corantes utilizados se prestam ao ensino desde conceitos básicos de equilíbrio químico para estudantes de ensino médio, de indicadores em titulação para cursos de Química Geral e até da Lei de Lambert-Beer (A = x L x C)* e de Espectros de Absorção, para cursos de instrumentação. * A = absorbância é definida pela reação seguinte: A = - log It/I0, que por ser uma razão, não possui unidade (Io é intensidade de luz incidente; It é intensidade de luz transmitida); = absortividade molar (característico de cada substância), em L.(mol.cm)-1; l = caminho óptico (percurso da luz monocromática na solução) em cm; c = concentração da substância em mol/L. Realizaram um experimento em que a antocianina utilizada foi extraída da Solanum nigrum L. (maria-preta). De acordo com Ramos e col. (2000), o extrato bruto funcionou como indicador em titulações ácido-base, pois os experimentos apresentaram um da ordem de 0,11-1,0%, quando comparado com os resultados potenciométricos. A mudança de cor observada foi de vermelho para amarelo, entre pH 4 e 10. Outro experimento foi realizado com sucesso no ensino médio, em escolas públicas da periferia de Uberlândia, MG utilizando-se as antocianinas. Soares e colaboradores (2001) utilizaram flores de quaresmeira (Tibouchina granulosa) unha de vaca (Bahuinia variegata) e da casca de feijão preto (Phaseolus vulgaris), para extrair as antocianinas na identificação de substâncias ácidas ou básicas. O resultado desse trabalho mostrou, entre os estudantes, uma excelente aceitação da teoria, pois o experimento foi eficiente em demonstrar os conceitos de acidez, basicidade e o papel dos indicadores. A cromatografia é uma técnica poderosa empregada em diversas áreas da ciência. A palavra cromatografia, de origem grega, significa "escrever com cor" (chromatus quer dizer cor e graphein, escrever). Ela foi criada em 1906, pelo botânico russo Mikhail Tswett (NOGUEIRA, 2006). Pós-Graduação a Distância Eles utilizaram, além das plantas citadas, outros materiais baratos e fáceis de encontrar fenolftaleína: suco de laranja e limão; vinagre de vinho branco e de álcool; álcool comum; alvejante para tecidos (solução de hipoclorito) e detergente; água mineral e água de torneira; sabão; copos e colheres; vasilhames comuns (garrafas de água mineral), com volumes de aproximadamente 100 e 500 mL. 31 O Estudo da Química: A Teoria e a sua Contextualização Fotos de Mikhail S. Tswett (adaptado por NOGUEIRA, 2006) Unidade II M.S. Tswett junto da sua unidade cromatográfica em 1910. (adaptado por NOGUEIRA, 2006) A técnica permite analisar o ambiente e verificar, por exemplo, a qualidade do solo, do ar e da água determinando se existem contaminantes. As polícias usam as técnicas cromatográficas na busca de drogas no sangue ou na urina de suspeitos e vítimas. Não existe substância que não possa ser analisada e estudada, pois existem diversos tipos de cromatografia. O princípio dessa técnica é fracionar a mistura de modo que se possam estudar as diferentes substâncias presentes. Devido às propriedades distintas das substâncias na mistura, elas acabam por interagir de forma diferente com a fase estacionária e com a fase móvel. Existem quatro tipos principais de cromatografia: a líquida, gasosa, em camada delgada e cromatografia em papel. Um experimento com cromatografia pode ser constituído de várias formas, mas nele sempre constará uma fase estacionária e outra móvel. A fase estacionária (que pode ser sólida, líquida ou pode consistir em uma mistura de um sólido com um líquido) é finamente dividida e fixada a um suporte. A fase móvel (que pode ser líquida ou gasosa) preenche os interstícios da fase estacionária e deve ser capaz de fluir através dessa fase. Nesse processo, vários mecanismos de distribuição podem ser empregados: uma simples partição entre dois líquidos imiscíveis; um equilíbrio de adsorção entre uma fase estacionária adsorvente e uma fase líquida móvel; ou um equilíbrio de troca iônica entre uma fase estacionária trocadora de íon e uma fase móvel constituída por uma solução de um eletrólito. (Site da UFRJ, acesso em jan. 2008). É possível ensinar as técnicas cromatográficas no ensino fundamental e médio. O processo de separação de uma mistura complexa pode ser feito através da cromatografia de adsorção, utilizando materiais simples e de fácil acesso. Materiais e Experimentos no Ensino de Química A cromatografia de adsorção pode ser comparada aos raios de luz em um espectro, em que se separam os diversos componentes de uma mistura de pigmentos, podendo então ser determinados qualitativa e quantitativamente. 32 A cromatografia é tão importante na Química Orgânica como na Química Inorgânica. Foi o método empregado para a separação dos produtos obtidos na fissão nuclear antes do desenvolvimento das resinas de intercâmbio iônico. (PALOSCHI; LENI; RIVEROS, 1998). Uma das técnicas, cromatográficas usadas em aulas práticas é a cromatografia em papel e o protocolo extraído da apostila de aula prática do Instituto de Química para o Curso de Biologia Noturno da Universidade de São Paulo (USP) (ARMELIN, 2008). Nesse protocolo, o autor utilizou a cromatografia de aminoácidos em papel. Nesse procedimento emprega-se uma mistura de solventes que interagem com as fibras de celulose no papel de formas diferentes. O deslocamento do soluto pode ser explicado da seguinte forma: as fibras de celulose do papel possuem uma forte afinidade pela água presente na mistura de solvente, mas muito pouca afinidade pela fase orgânica. O papel, assim, pode ser visto como um suporte inerte contendo uma fase estacionária aquosa (polar). Na medida em que o solvente flui através de uma seção do papel contendo o soluto, uma partição deste composto ocorre entre a fase móvel orgânica (pouco polar) e a fase estacionária aquosa (polar). O Estudo da Química: A Teoria e a sua Contextualização Unidade II Dessa forma, parte do soluto deixa o papel e entra na fase móvel. Com o fluxo contínuo de solvente, o efeito dessa partição entre a fase móvel e a fase estacionária é a transferência do soluto do seu ponto de aplicação ao papel para um outro ponto localizado a alguma distância do local de aplicação, no sentido do fluxo de solvente. Após o equilíbrio do papel com o vapor de um solvente saturado em água o desenvolvimento do solvente produz a separação. Um esquema do processo pode ser visto na figura. Figura 4 – Ilustração de um esquema de montagem experimental Fonte: ARMELIN, 2008 Quanto mais apolar for o grupo R, maior a mobilidade do aminoácido com a fase móvel. Consequentemente a relação (RF) entre a distância percorrida pelo aminoácido no papel e a distância percorrida pela fase móvel será também maior. RF = distância percorrida pelo aminoácido no papel distância percorrida pela fase móvel Através da cromatografia em papel, é possível comparar, por exemplo, um aminoácido desconhecido com quatro outros conhecidos (denominados de aminoácidos-padrão). Uma tabela contendo os valores de pKa observados auxilia a titulação e consequentemente a identidade do aminoácido. Quando a polaridade do solvente é alterada, ou o seu pH, a solubilidade dos aminoácidos nas duas fases pode ser alterada, pois estaremos alterando o PI (ponto isoelétrico) dos aminoácidos. Então é possível modificar as condições do conjunto de modo que se possa deslocar cada molécula em momentos diferentes sobre a fase estacionária, e isso poderá ser analisado a partir da origem, quando se cessa o fluxo do solvente (STRYER, 2002; VOET; VOET, 2006). Pós-Graduação a Distância Para analisar a amostra é necessário coletar, em tubos de ensaio, a cada intervalo de tempo, as frações que estão em contato com o solvente previamente escolhido para passar pela coluna. Podemos ver, na figura 5, o processo de coleta das frações e, na figura 6, o deslocamento das amostras. Vê-se que a amostra número 1 sairá primeiro que a número 2. Figura 5 – Coluna de cromatografia líquida 33 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Figura 6 – Cromatrografia de leito Móvel Um aminoácido é uma molécula orgânica formada por átomos de hidrogênio, oxigênio nitrogênio e eventualmente enxofre. O oxigênio aparece na estrutura da molécula orgânica chamada carboxila (−COOH), o nitrogênio como um grupo amina (NH2), um grupamento alquila (R), que determina os diferentes tipos de aminoácidos e um hidrogênio completam a estrutura (são 22 ao todo). Todos estes substituintes se ligam ao carbono, chamado de (STRYER, 2002; VOET; VOET, 2006). Os aminoácidos absorvem luz fora do comprimento de onda visível (240nm- 340nm), então para serem analisados no espectrofotômetro eles são unidos a um cromóforo. Materiais e Experimentos no Ensino de Química A reação de ninhidrina é usada para este propósito porque reage com grupamentos amino livres produzindo um composto colorido, usualmente púrpura (figura 7). 34 Figura 7 Fonte: Armelin, 2008. Diversos aminoácidos, contudo, produz em diversas tonalidades de cores com a ninhidrina, o que pode ajudar em sua identificação. A reação da ninhidrina com prolina, por exemplo, gera um composto amarelo e a reação da ninhidrina com a tirosina produz uma coloração azul metálica. (STRYER, 2002; VOET; VOET, PRATT, 2006). A cromatografia de adsorção pode ser comparada aos raios de luz em um espectro, em que se separam os diversos componentes de uma mistura de pigmentos, podendo então ser determinados qualitativa e quantitativamente. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Para mostrar tal técnica cromatográfica para o Ensino Fundamental e Médio, é possível utilizar materiais simples e de fácil acesso. Umas das técnicas que utiliza a cromatografia de adsorção, usa materiais baratos como: giz, canetas hidrocor de várias cores, batom, copo e álcool comum. (PALOSCHI; ZENI; RIVEROS, 1998). O procedimento de observação é relacionado com o deslocamento da solução de substâncias a separar, em uma direção pré-determinada, através de uma disposição de aparatos, por meio de uma fase sólida, insolúvel, inorgânica ou orgânica, sendo os componentes retidos em medida individualmente distinta. Em geral, na cromatografia de adsorção empregamse como adsorventes óxidos, óxidos hidratados ou sais. (PALOSCHI; ZENI; RIVEROS, 1998). A mistura atravessa a fase solída representada pelo giz, onde podem ser observadas as diferentes retenções na superfície do sólido. Assim como na cromatografia líquida a escolha do solvente pode determinar o deslocamento da mistura. (COLLINS, 1999). Existe uma relação que pode ser expressa para as distâncias percorridas pelo solvente e pelo soluto, quando esses se movem ao mesmo tempo através da fórmula. A distância que foi percorrida pela amostra é medida do ponto de aplicação até o centro de sua zona de distribuição. Ela pode ser calculada da seguinte maneira RF = distância percorrida pela amostra no giz / distância percorrida pela fase móvel. Este método também é muito usado na cromatografia em papel é representada na figura. 08. (PALOSCHI et al., 1998; COLLINS, 1999). Às vezes não é possível visualizar todas as substâncias que são separadas pelos métodos cromatográficos, por isso é adicionado à solução um cromógeno, como é feito para a ninhidrina. (STRYER, 2002; VOET; VOET; PRATT, 2006). Agentes físicos podem ser usados para visualizar essa separação como a luz ultravioleta, ou vapores de iodo. A utilização de métodos físicos tem uma ótima vantagem. As substâncias analisadas podem ser recuperadas e estudadas mais tarde. (PALOSCHI; ZENI; RIVERES, 1998). Descrevo, a seguir, a técnica mais detalhada para realizar em sala de aula a cromatografia em giz (COLLINS; BRAGA; PIERINA, 1990; PALOSCHI; ZENI; RIVERA, 1998). Esses são os materiais e reagentes utilizados para a prática. Note que eles são baratos e fáceis de encontrar giz inteiro (bastões); confeitos (balas) coloridos; cuba cromatográfica; béquer de 100mL; proveta de 25mL; espátula metálica; vidro de relógio; pinça; água destilada; frasco lavador (pisseta); bastão de vidro fino. Pós-Graduação a Distância Figura 8 – Cálculo do fator de retenção Rf Fonte: Paloshi; Zeni; Riveros, 1998; COLLINS, 1999) 35 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Procedimento • Transfira, com o auxílio de um béquer, a água destilada para a cuba cromatográfica até atingir a altura de aproximadamente 1cm. Tampe a cuba cromatográfica e reserve. • Coloque uma pastilha de confeito no vidro de relógio e adicione algumas gotas de água destilada para a extração do pigmento. • Utilizando a espátula metálica, faça uma ranhura no bastão de giz, cerca de 2cm acima da base. Preencha essa ranhura com o pigmento extraído. Enrole a tira de papel de maneira a formar um cilindro e prenda com clipes de metal (superior). • Coloque o giz (posição vertical) na cuba cromatográfica, tomando o cuidado de não submergir o pigmento na solução. Tampe a cuba e observe. • Deixe o sistema em repouso até a solução atingir a extremidade superior do bastão. • Retire o giz da cuba e observe. • Repita esse procedimento utilizando pastilhas de outras cores. Outra forma de estudar Química e torná-la mais interessante aos alunos é através de simulações de estruturas moleculares. Esses procedimentos podem ser feitos com materiais baratos como isopores e programas de computadores e são alternativas acessíveis aos alunos. Essa é uma forma inteligente de contribuir para os estudos sobre os fenômenos simulados e para a educação em ciências, do ponto de vista da teoria do conhecimento (GIORDAN, 2005). Nas circunstâncias em que a atenção do aluno esteja mobilizada por uma aplicação simuladora do fenômeno, o controle sobre as variáveis pode ser exercido com o intuito de observar regularidades, fazer previsões, ou ainda a própria representação do fenômeno simulado pode servir de suporte para o aluno elaborar narrativas ou explicações acerca do fenômeno no meio natural. (GIORDAN, 2005). Materiais e Experimentos no Ensino de Química A molécula de metano (CH4), por exemplo, pode ser demonstrada como na figura 9a, onde a molécula é vista através de um software da área da química (figura 9b), ou construída com uma única folha de cartolina, que pode ser dobrada para formar tetraedro. Esta figura geométrica, um poliedro por quatro faces triangulares, é visualizada na figura 9b. 36 Figura 9b Figura 9a No estudo da Química os gases também podem ser abordados em sala de aula de maneira prática e com materiais fáceis de serem encontrados. Primeiro vamos à teoria. De acordo com a teoria dos gases perfeitos mantendo-se a quantidade de matéria, massa ou número de moles, é determinada a relação entre P,V e T do gás em diferentes estados de equilíbrio. Essa relação é chamada lei dos gases perfeitos ou ideais e pode ser expressa pela fórmula a seguir, que demonstra que a relação (PV/T) não varia quando o número de partículas do gás não se altera. P1 V1 P V 2 2 = constante T1 T2 O Estudo da Química: A Teoria e a sua Contextualização Unidade II A “constante” apresentada na fórmula pode ser expressa, na maioria dos gases de baixa pressão é igual ao número de moles (n) multiplicado pela constante universal dos gases ideais (R), que vale 0,82atm l/mol K ou 8,375J/mol K no sistema internacional (S.I.). Assim chega-se à relação conhecida como lei de Clapeyron.: PV = n R T. Figura 10 – Modelo experimental criado por Gay-Lussac (1807) para estudar os gases ideais Fonte: <(http://leblon.mec.puc-rio.br/~wbraga/fentran/termo/hist3.htm>. Os estados de equilíbrio de um gás podem ser alterados de várias formas. Utilizando-se o modelo acima, podemos na sala de aula, mostrar o efeito de duas das variáveis termodinâmicas, após fixarmos o valor de uma delas com o objetivo de estudar os diferentes tipos de processos, por exemplo, isobáricos, isocóricos e isotérmicos. A mídia reconhece o DNA (ácido desoxirribonucléico, em português) como a molécula da vida. Friedrich Miescherm, médico suíço, escolheu estudar essa molécula, pois já estavam ocorrendo estudos prévios sobre a origem e o controle celular. Era o início da Biologia Celular, uma das 168 áreas das Ciências Biológicas. Curiosidade O livro “DNA: O Segredo da Vida”, de James D. Watson e Andrew Berry, mostra de maneira clara como ocorreu a descoberta do DNA. É um livro que vale a pena ser lido por estudantes e profissionais da área de Ciências. A figura 11 mostra a bela capa do livro cuja imagem se altera entre a imagem do DNA com a de um inseto. Pós-Graduação a Distância Figura 11 37 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Em 07 de março de 1953, James Watson e Francis Crick tiveram a sua descoberta publicada na revista Nature (v. 171:737-738, 1953). Esse artigo original pode ser lido na página <http://www.nature.com/nature/dna50/watsoncrick. pdf>. Pela descoberta dessa molécula, Watson e Crick em 1962, juntos com Maurice Wilkins, receberam o Prêmio Nobel de Fisiologia – Medicina. A descoberta dessa molécula revolucionou o modo como observamos e manipulamos a natureza da célula. Saber como a célula se comporta deu embasamento, como já se sabe, ao desenvolvimento da Biologia Molecular. Essa área foi responsável pelos fantásticos avanços na saúde, agricultura e meio-ambiente, que foram publicados nos úiltimos anos, em centenas de artigos, em periódicos de qualidade com a Science e a Nature. Um desses avanços, originados da descoberta do DNA, foi alcançado pelo esforço feito por um consórcio internacional, realizado em 1990, por diferentes países, para mapear o genoma humano. O objetivo desse projeto foi atingido em 14 de abril de 2003. Uma nota da NIH resume os esforços da finalização desse empreendimento e pode ser vista na página da genoscope. <www.genoscope.cns>. A um custo de um dólar americano para cada nucleotídeo foi mapeado todo o código. Por causa desse esforço, sabemos hoje, como os três bilhões de nucleotídeos estão organizados em nossos 23 cromossomos. No rastro dessa empreitada, que determinou o aparecimento da área Genômica, surgiu a Proteômica, pois só o conhecimento dos genes não era suficiente para entender como eles trabalhavam na regulação da célula. Esse novo ramo se propôs a analisar as proteínas expressas pelos tecidos e como os genes seriam regulados para melhor compreensão dos processos moleculares. Se a proteômica se notabilizou por buscar as proteínas, a metabolômica, uma nova área de estudos, surgiu para entender como as proteínas interagem e regulam a síntese de outros genes e como estes se ligam ao fenótipo (produto dos genes versus ambiente e idade). Materiais e Experimentos no Ensino de Química Sabemos que o DNA é constituído de quatro bases nitrogenadas. Essas bases são classificadas como púricas e pirimidínicas, onde são encontradas, respectivamente, no primeiro e segundo grupo: adenina e guanina e de timina e citosina (Figura 12). Essas moléculas se organizam junto com as moléculas de ribose e fosfato para dar origem à estrutura em α-hélice do DNA. (STRYER, 2002; VOET; VOET; PRATT, 2006). 38 Figura 12 O Estudo da Química: A Teoria e a sua Contextualização Unidade II O arranjo dessa molécula ocorre da seguinte maneira: os nucleotídeos que formam o DNA estão unidos a um açúcar da classe das pentoses (2-desoxirribose), que se une a uma base orgânica e a um radical fosfato (PO4-3). Os nucleotídeos, como apresentados na figura 13. A figura 14 mostra como os nucleotídeos se unem através das ligações do tipo ponte de hidrogênio. (STRYER, 2002; VOET; VOET; PRATT, 2006; LIMA; FRACETO, 2007). Figura 14 Para explicar o papel do DNA e para trabalhar uma série de conceitos químicos e bioquímicos, Lima e Fraceto (2007) realizaram um procedimento para extrai-lo do tomate. Esse extração pode ser feito de morangos, da cebola, da mucosa bucal. Os materiais são de baixo custo e o procedimento é simples. Os alunos, após a realização do experimento sentem um impacto grande na sala de aula, pois o resultado permite ver e tocar a molécula de DNA. Cito, a seguir, o protocolo utilizado pelos autores para que possa ser repetido em sala de aula. O mesmo protocolo pode ser visto também na apostila do módulo 1 do sítio “O DNA vai à escola”. Pós-Graduação a Distância Figura 13 39 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Os materiais utilizados foram: um tomate, cloreto de sódio (4g equivalente a 4 colheres de café), água, etanol 96% (álcool etílico comercial); como alternativa pode ser utilizado também álcool de cereais (99%) encontrado em lojas de produtos para perfumaria e farmácias de manipulação), detergente comercial (6mL), gelo (4 a 5 bandejas), papel de filtro, bandeja plástica (para fazer banho de gelo), faca, funil, béquer de 500mL, béquer de 100mL, termômetro, tubos de ensaio, tripé e tela de amianto, mixer ou liquidificador. O procedimento que pode ser visto no esquema 01, é fácil de ser montado e executado. De acordo com esse método de extração de DNA, observam-se três procedimentos básicos: a lise dos tecidos e células; a remoção de proteínas e outros fragmentos de material do DNA; e, finalmente, a precipitação do DNA. Esquema 01 De acordo com Lima e Fraceto (2007), podem ser feitas várias perguntas aos alunos sobre os procedimentos realizados nesse experimento. 1) Qual a importância química da utilização de sal em uma das etapas de extração de DNA? Materiais e Experimentos no Ensino de Química 2) Qual a característica química presente na molécula de detergente (tensoativo) responsável pela lise das membranas celulares? 40 3) Por que é necessária a utilização de etanol gelado em vez de etanol em temperatura ambiente na extração de DNA? 4) Qual o efeito da temperatura na solubilidade do DNA no etanol? Outra forma de exercitar a curiosidade dos alunos sobre essa molécula é a de orientá-los na montagem de uma molécula de DNA. Poderíamos usar isopores, pedaços de cartolina ou ambos. Existem várias formas de apresentar experimentos simples e criativos aos alunos, com o uso de plantas. O Reino Plantae ou Metaphyta possui, aproximadamente, 350.000 espécies conhecidas. São organismos classificados como autotróficos, isto é, eles são capazes de produzir a própria energia através de organelas especializadas chamadas de cloroplastos (RAVEN; EVERT; EICHHORN, 1996). Na figura 15 é apresentada estrutura de um cloroplasto. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Figura 15 Os cloroplastos contêm pigmento chamado clorofila (figura 16). Figura 16 Pós-Graduação a Distância Essas estruturas são capazes de converter a energia luminosa em compostos amilíferos a partir da água e do CO2 por um processo chamado fotossíntese. Note que essas estruturas têm similaridade química com o grupo heme (figura 17). As porfirinas podem ser observadas na natureza unidas a metais com diversas funções biológicas. A ferroprotoporfirina IX constitui o grupo prostético de várias enzimas importantes como, por exemplo, a catalase e estruturas importantes como a citocromo b na Cadeia Transportadora de elétrons. (STRYER, 2002; VOET; VOET; PRATT, 2006). Figura 17 41 O Estudo da Química: A Teoria e a sua Contextualização Unidade II No núcleo do anel de porfirina, na clorofila vemos o íon Mg+2. As plantas quando submetidas a processos como de calor pH e de luminosidade podem alterar a sua estrutura (STREIT, et al., 2005). Quando verduras e vegetais são preparados por meio do cozimento, mudanças químicas também podem ocorrer na estrutura da clorofila (DE OLIVEIRA; PEREIRA MAIA, 2007). Uma dessas modificações diz respeito a substituição do Mg+2 presente na estrutura da clorofila por dois íons H+ provenientes de ácidos liberados durante o processo de ruptura da clorofila (figura 18). Figura 18 Fonte: Streit, 2005, com modificações Baseado nisso, De Oliveira e Pereira Maia (2007) propuseram um experimento simples para verificar a mudança que ocorre na coloração de vegetais durante o processo de aquecimento e, dessa forma, demonstrar a formação da feofitina. Essa reação é denominada feofitinização e a nova molécula formada é a feofitina (figura 18). O objetivo desse trabalho foi mostrar a importância do íon Mg+2, dito inorgânico, na manutenção da vida. O experimento acima pode despertar a curiosidade dos estudantes, relacionando com outras áreas de pesquisa como a bioquímica. Materiais e Experimentos no Ensino de Química 1. Sobre este experimento, explique a relação das porfirinas com a hemocromatose. 42 2. As antocianinas poderiam ser usadas como marcadores deste processo? 3. Como podemos usar este experimento para explicar o processo de redução em uma reação química? Existem vários fatores que podem influenciar a velocidade de uma reação química. A temperatura, a concentração dos reagentes, os catalisadores são variáveis que devem ser consideradas. A área da química que estuda como as reações alteram a sua velocidade é a Cinética. Os catalisadores citados no parágrafo anterior são substâncias que aumentam a velocidade das reações, sem serem consumidos nas reações químicas. Eles reduzem a quantidade de energia necessária para que ocorra a reação, como mostra a figura 19. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Figura 19 Exercício (UnB) De acordo com as informações sobre catálise, julgue os itens a seguir: a) O catalisador afeta a velocidade de uma reação porque aumenta o número de moléculas com energia cinética maior ou igual à energia de ativação da reação. b) A temperatura afeta a velocidade de uma reação porque muda a energia de ativação da reação. c) A concentração dos reagentes afeta a velocidade de uma reação porque há alteração no número de colisões efetivas. d) Uma reação ocorre quando há colisão efetiva entre as moléculas reagentes numa orientação apropriada. Figura 20 A síntese de Wöhler foi o argumento dos oposicionistas da Teoria da Força Vital uma vez que foi provado que um composto orgânico poderia ser produzido a partir de um composto inorgânico. Pós-Graduação a Distância Friedrich Wöhler, em 1928, propôs uma rota de síntese para a uréia, uma substância orgânica encontrada na urina conforme vemos na figura 20. Esta síntese resultava no aquecimento do cianeto de amônio (NH4CNO), um composto inorgânico (FRIEDMANN, 1997). 43 O Estudo da Química: A Teoria e a sua Contextualização Unidade II A urease é uma enzima que, em meio aquoso, catalisa a hidrólise da uréia em amônia e dióxido de carbono e ocorre em algumas sementes, tais como soja: melão, melancia, entre outras. (DE ALMEIDA, 2008). O cofator enzimático da urease é o íon metálico Ni+2. O reconhecimento da participação de níquel em processos bioquímicos é relativamente recente. Atualmente esse metal é considerado um elemento traço essencial para bactérias, plantas, animais e humanos. (CIURLI e COLS., 1999, citado por DE ALMEIDA et al., 2008 ). O níquel tem um papel importante na reação como vários outros metais (Fe+2/+3, Cu+1/+2) , que ficam localizados no sítio ativo das enzimas, e cuja orientação espacial é auxiliada pela estrutura protéica que o mantém. Manter a integridade da enzima é fundamental. O aquecimento, ou mudança do pH, leva a um processo de denaturação, onde a proteína perde a sua estrutura tridimensional e, portanto, as suas propriedades biológicas. (STRYER, 2002; VOET; VOET; PRATT, 2006). A hidrólise da uréia, empregando essa enzima como biocatalisador, na temperatura de 20°C, é até 1014 vezes mais rápida que a hidrólise realizada em meio ácido a uma temperatura de 60°C. (SOUZA; FATIBELLO-FILHO, 2006, citado por DE ALMEIDA, 2008). Atualmente, a ureia é utilizada como suplemento na alimentação de animais, na agricultura (como fertilizante), na fabricação de plásticos, na indústria farmacêutica. De Almeida e colaboradores (2008) propuseram um experimento para ilustrar a hidrólise da ureia em urina catalisada pela urease extraída de sementes de melancia. Curiosidade Em 1807, Jöns Jacob Berzelius (químico sueco, 1779-1848) lançou a ideia de que somente os seres vivos possuiriam uma “força vital” capaz de produzir os compostos orgânicos. Segundo essa teoria, os elementos, nos organismos vivos, obedecem a leis totalmente diferentes das que regem o material inanimado. Ela foi prontamente aceita, o que constituiu um verdadeiro entrave ao progresso da química orgânica, pois essa concepção vitalista, amplamente aceita na época, não dava margens a questionamentos sobre a possibilidade da síntese de substâncias orgânicas em laboratório, portanto não havia discussões nem pesquisas a respeito. Materiais e Experimentos no Ensino de Química Fonte: Wikipedia, acesso em dez. 2008. 44 Os materiais e reagentes utilizados no trabalho foram: estante para tubos de ensaio, quatro tubos de ensaio, pipeta 5,0 mL, extrato de repolho roxo, sementes de melancia, solução aquosa de ureia 1,0% (a ureia pode ser facilmente adquirida em lojas de produtos agropecuários), urina humana, liquidificador, filtro de papel, funil, erlenmeyer e álcool etílico (comercial). Para executar esse trabalho foram determinados os seguintes procedimentos: a) Para identificação, enumerar quatro tubos de ensaio. b) Adicionar, aproximadamente, 100mL de água e cerca de 40 sementes de melancia em um liquidificador e triturar por 15 segundos. Filtrar a mistura e recolher a parte líquida. Dividir a fração líquida em duas partes iguais e levar uma delas a fervura a 100ºC por 1 minuto (inativação enzimática). Deixar em repouso para atingir a temperatura ambiente. c) Para a obtenção do extrato de repolho roxo, triturar no liquidificador 3 folhas de repolho roxo picadas com, aproximadamente, 100mL de álcool etílico comercial. Filtrar a mistura e utilizar o extrato alcoólico como O Estudo da Química: A Teoria e a sua Contextualização Unidade II indicador ácido-base. A extração das antocianinas (pigmentos da classe dos flavonóides, responsáveis pela cor azul, violeta, vermelho e rosa de flores e frutas e indicadores ácido-base natural) pode inclusive ser realizada por imersão da folha de repolho roxo em etanol, seguido de repouso por 24 ou 48 horas. (TERCI; ROSSI, 2002; COUTO e COLS., 1998, citados por De Almeida et al., 2000). d) Tubo 1 – No tubo de ensaio número 1, adicionar 1,0mL de extrato de repolho roxo, 2,0mL de urina recémcoletada e acrescentar 1,0 mL da fração líquida resultante da trituração de sementes de melancia em água (sem fervura). Agitar e observar a cada 10 minutos. e) Tubo 2 – No tubo de ensaio número 2, adicionar 1,0mL de extrato de repolho roxo, 2,0mL de urina recémcoletada e acrescentar 1,0 mL do líquido resultante da trituração de sementes de melancia (fervido). Agitar e observar a cada 10 minutos. f) Repetir os procedimentos (acima) para os tubos 3 e 4, substituindo a urina pela solução de ureia a 1%. Pós-Graduação a Distância Os fenômenos que estudamos nos livros podem ser abordados e materializados socialmente. E isso é importante para o aluno do curso de Química, pois ele precisa ter uma conscientização maior sobre o poder adquirido através do conhecimento. Ele terá uma nova atitude, que certamente o levará a uma ação mais social e responsável, diante dos acontecimentos do mundo. 45 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Capítulo 4 – A Contextualização das Aulas com a Prática Laboratorial A partir da promulgação da Constituição em 1988, fica claro o propósito da educação: desenvolver plenamente a pessoa, para que ela possa exercer a sua cidadania de modo a dar continuidade aos estudos e a sua qualificação profissional. Observa-se ainda que o ensino médio passou por grandes transformações que se consolidaram com a publicação, em 1996, da Lei no 9394 das Diretrizes e Bases da Educação Nacional (LDB). Essa Lei dá ao ensino novas diretrizes de forma a preparar melhor os alunos e consequentemente cidadãos conscientes. O ensino vem reduzindo sua característica conteudista e aumentando a interatividade com os problemas que ocorrem em nossa volta. Evitando assim que a teoria dada em sala de aula seja utilizada apenas para resolver exercícios. Essa interatividade é essencial para quem entrar no mercado de trabalho de forma competitiva A interdisciplinaridade representa hoje uma forte tendência educacional. É impressionante que a Química, mesmo precisando da Matemática, da Física e da Biologia, tenha sido mantida isolada do contexto de nosso dia a dia. É uma concepção pouco interessante, pois torna o ensino mais hermético. É possível e necessário interagir a Química com disciplinas como Matemática, Física e Biologia. A contextualização é também um forte recurso que permite aos alunos enxergarem o significado do aprendizado. Eu só consegui visualizar isso frequentando o curso de Biologia na Universidade de Brasília. Para compreender as Ciências Biológicas, necessita-se de conhecimentos nas grandes áreas das exatas: Química, Matemática e Física, além da Biologia. Então a Química é uma profissão que se relaciona com outras áreas. Pode-se trabalhar na indústria exercendo controle de qualidade, ambiental, de rejeitos. Os químicos podem desenvolver processos ou ainda trabalhar com pesquisa. Materiais e Experimentos no Ensino de Química Uma das formas de contextualizar o ensino da Química hoje é relacionando-o com o meio ambiente. São importantes os conhecimentos de Química na proteção das doenças, no descarte de alimentos, fármacos e outros materiais orgânicos e inorgânicos de forma consciente e organizada. 46 Sempre dependemos do ambiente. A questão ambiental vem sendo considerada cada vez mais urgente e importante para a sociedade, pois o futuro da humanidade depende da relação estabelecida entre a natureza e o uso pelo homem dos recursos naturais disponíveis. Desde os primórdios quando o homem vivia em grupo e era nômade, o consumo de recursos como frutos, sementes, água era suficiente para sustentá-lo. Entretanto a habilidade de construir ferramentas, o aumento do grupo e, consequentemente, a sua fixação mudaram a forma de utilização da terra. A percepção de que os recursos em nosso planeta são finitos não era percebido, mesmo com o aumento da população e a ocupação de diferentes biomas. A preocupação com o meio ambiente nasceu nos anos 1960. D'AMATO e col. (2002) descrevem os riscos ambientais citando a autora Rachel Carson. Ela escreveu o livro Primavera Silenciosa que alertava o mundo para os riscos do DDT (Dicloro-Difenil-Tricloroetano). De acordo com a autora, o DDT foi causa da redução populacional de diversas aves; muitas delas seriam as de topo de cadeia alimentar, como o falcão peregrino e a águia calva (bald eagle – Haliaeetus leucocephalus), animal símbolo dos EUA. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Curiosiade O DDT (diclorodifeniltricloretano) é uma potente veneno, que foi muito utilizado no mundo para o controle de pragas e endemias, altamente solúvel na água e na gordura, ele permanece por mais de vinte anos com sua estrutura molecular inalterada. Já foi encontrado no tecido de animais no Ártico, o que prova que todo planeta está contaminado. O DDT foi sintetizado, em 1874, por um estudante alemão, mas caiu no esquecimento por muitos anos. Foi muito usado na II Guerra Mundial para proteger soldados contra insetos. A partir daí tornou-se um popular pesticida, tanto para combater doenças transmitidas por insetos, quanto para ajudar fazendeiros a controlar pestes agrícolas. Estrutura do Dicloro-Difenil-Tricloroetano Em 1948, o suíço Paul Müller, descobridor moderno do DDT, ganhou o prêmio Nobel de medicina. Curiosamente, Müller não fazia pesquisas médicas, apenas buscava um bom inseticida. Mas seu produto era capaz de eliminar o mosquito Anopheles, transmissor do parasito da malária. O DDT não apenas é o mais barato, como também o mais eficaz método de combater a malária. Os Estados Unidos chegaram a aplicar um bilhão de toneladas do DDT, até que, em 1972, depois de uma acirrada disputa judicial e política, baniram o produto. Logo foram seguidos pela maioria dos países industrializados. <http://www.ambientebrasil.com.br/composer.php3?base=./agropecuario/index.html&conteudo=./agropecuario/artigos/ddt. html> (Acesso em jan. 2008, com modificações). Os livros de resumos de congressos também apresentam trabalhos, como tendência firme para o futuro, os problemas ambientais sendo investigados pela Química como pode ser visto no sítio da 23o Reunião da Sociedade Brasileira de Química (SBQ). Vários resumos tratavam de temas como água, lixo e atmosfera. Tomemos como exemplo o trabalho de POMPEI; JARDIM (2000) intitulado: Especiação de Mercúrio em Águas Naturais: toxicidade aguda usando escherichia Coli. Nesse trabalho eles propuseram desenvolver um método experimental que permitisse avaliar a toxicidade do mercúrio em águas naturais, partindo da hipótese de que há uma relação entre a fração facilmente redutível do mercúrio e seu potencial tóxico em relação à bactéria Escherichia coli. Com tanto material disponível, como podemos unir esses temas à rotina laboratorial para tornar o ensino de Química mais atraente e tornar os nossos alunos mais conscientes sobre o mundo a sua volta? Pós-Graduação a Distância Por causa da percepção mais clara dos problemas ambientais que nos rodeiam os livros didáticos começaram a sofrer alterações ainda na década de 1990. O livro do Ricardo Feltre, 4o edição, de Química e a 1o edição da Química na Abordagem do Cotidiano de Peruzzo e Canto (1995), ambas em 3 volumes, mostram essa nova tendência. 47 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Devemos primeiro abordar o tema aproveitando situações apresentadas na mídia que causem impacto nos estudantes. O derramamento de óleo em um córrego, o uso de pesticidas nas plantações de cana-de-açúcar, a mortandade de peixes em lagoas e rios, dentre outros. Dessa forma o ensino ficará mais dinâmico interdisciplinar e contextualizado. Esses temas precisam obrigatoriamente estar ligados aos conteúdos programáticos de Química para poder proporcionar a construção do conhecimento através dos fenômenos visualizados e lidos em artigos, trabalhos em grupo, excursões e finalmente a execução de experiências em laboratório. Para melhor organizar o trabalho, é necessária a escolha de um tema de impacto; um cronograma de trabalho que envolva várias atividades; as questões da pesquisa levantadas para buscar possíveis soluções; um experimento laboratorial; um relatório final que deverá ser enriquecido com uma lista de artigos e livros; e uma parte do cronograma chamada leitura complementar. Este Caderno abordará diversos tópicos que servirão futuramente como sugestão para uso em sala de aula. A preocupação com o meio ambiente é um tema atual, muito abordado pela mídia. Isso acabou popularizando o conhecimento da chuva ácida. O fenômeno foi descoberto na Grã-Bretanha, na metade do século XIX, mais precisamente em 1881, pelo cientista e químico Robert Argus Smith. Ele chamou essa ocorrência de precipitação suja para descrever a precipitação sobre a cidade de Manchester, no início da Revolução Industrial. (BAINES, 2003). A percepção da acidez da chuva, porém, só ocorreu, a partir da década de 1950, quando diversos ecossistemas já estavam seriamente comprometidos. A imagem na figura 21 mostra uma floresta Checa após a ação da chuva ácida. Materiais e Experimentos no Ensino de Química Figura 21 48 A deposição úmida de constituintes ácidos presentes na atmosfera oriundos da queima de combustíveis fósseis, indústrias, queima de florestas para a expansão da agricultura e pecuária produzem gases que se elevam para a atmosfera. Outros emissores importantes são as usinas termelétricas, as refinarias de petróleo e as indústrias siderúrgicas. Essa deposição de constituintes particulados, ricos em enxofre formam uma solução com pH inferior a 5,6. Veja na figura 22 um esquema deste processo. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Figura 22 – Precipitação ácida Em nosso sangue, o CO2 é transformado em ácido carbônico (H2CO3) espontaneamente ou através da enzima anidrase carbônica no interior das hemácias. Curiosamente na atmosfera isso já ocorre naturalmente. A chuva exibe um grau de acidez. O CO2 na atmosfera também pode combinar-se na água para formar o H2CO3. Esse ácido é considerado fraco. Ele confere à chuva um pH igual a 5,6. O problema é quando esses níveis tornam-se inferiores a 5,6, pois isso indica que o ar está carregado de ácido sulfúrico (H2SO4) e ácido nítrico (HNO3). As reações químicas abaixo representam a acidez natural da chuva, ou seja, a formação do ácido carbônico (H2CO3) a partir do CO2 (gasoso) quando em contato com a água da chuva: [1] CO2 (g) + H2O Á H2CO3(aq) [2] H2CO3 (aq) HCO3– (aq) + H+ (aq) A presença de compostos ácidos na atmosfera ocorre devido às emissões de dióxido de enxofre (SO2) e dos óxidos de nitrogênio (NO e NO2), pois a atividade humana frequentemente emite esses gases na atmosfera. Existem diversos locais no mundo afetados pela chuva ácida: Estados Unidos, Europa, Ásia. No Brasil, por exemplo, temos o registro da Companhia de Tecnologia de Saneamento Ambiental (CETESB), do governo do Estado de São Paulo, feito entre 1983 e 1984. O objetivo da CETESB era examinar em detalhes as operações industriais do Polo Industrial de Cubatão, cadastrando as fontes poluidoras e os poluentes emitidos. (COUTO, 2005). Foram identificadas 320 fontes de poluição ambiental: 230 de poluição do ar, 46 de poluição do solo e 44 de poluição da água, comprovando a existência de 75 elementos poluentes na atmosfera de Cubatão. Nesse período a CETESB detectou índices de pH de 3.5 a 4,5 das chuvas que precipitavam no centro da cidade de Cubatão-SP. Não por acaso nos anos 1980, Cubatão foi considerada a cidade mais poluída do Brasil, por causa das altas emissões na atmosfera, aí incluídos os compostos derivados do enxofre. (COUTO, 2005). A escala utilizada pelos pesquisadores para medir a acidez da chuva vai de zero a 14 e é conhecida como escala de pH (potencial hidrogeniônico) (Fig 23). Uma solução é ácida quando o pH é menor que 7,0; é básica quando o pH é maior que 7,0; e neutra quando o pH é igual a 7,0. A mensuração da acidez das gotas de chuva é um processo simples, para isso coletam-se amostras no início e no fim da precipitação. Existem aparelhos chamados pHmetros que medem com precisão o pH. Vários experimentos podem ser criados para mostrar aos alunos os diversos conceitos importantes da Química usando o tema chuva ácida. Pós-Graduação a Distância A acidez, quando não neutralizada no ambiente, eleva-se, e há risco de iniciar-se um processo de degradação ambiental. Tal processo pode levar à queda da biodiversidade e de alterações físico-químicas nesses ambientes, com prejuízos à agricultura e à pesca. (BAINES, 1993). 49 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Figura 23 – A escala de pH Maia et al. (2005) apresentaram um artigo onde era estudado o equilíbrio 2NO2 ↔ N2O4 na reação de um dos gases com água para produção de chuva ácida. Através desse experimento eles demonstraram que o aluno pode aprender conceitos qualitativos sobre equilíbrio químico, sobre acidez e basicidade. Também pode observar como a chuva ácida atua na deterioração de monumentos de mármore. Um esquema montado pelos autores para verificar o equilíbrio de 2NO2 ↔ N2O4 e formação da chuva ácida pode ser visto a seguir: Figura 24 Materiais e Experimentos no Ensino de Química Seria possível abordar esse assunto, a chuva ácida sob outros aspectos, de modo a reforçar a compreensão dos temas. Perguntas criadas pelo professor e a discussão após o experimento prático são ferramentas úteis de aprendizado. 50 Seguem alguns exemplos: 1. Descreva a estrutura química dos gases responsáveis pela formação da chuva ácida e as reações químicas que os formam. 2. Quantas vezes uma amostra da água da chuva com pH=3.0 é mais ácida que outra água com pH=5,0? 3. Qual o pH de uma amostra de água de chuva que contém 10-3 gL-1 de ácido sulfúrico? Outro assunto que pode ser abordado no laboratório, usando parte das técnicas e conceitos do assunto anterior, dizem respeito à água usada no abastecimento. A água é um elemento indispensável à vida. É possível, dependendo do organismo e da atividade metabólica, ficar alguns dias sem se alimentar, mas, sem água, ficaríamos muito debilitados em três ou quatro dias. Não existe nenhuma reação dentro da célula que ocorra sem estar em meio aquoso. A distribuição desse importante recurso hídrico, que é utilizado para consumo humano, indústria e agricultura, ajudou a moldar a nossa civilização. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Os níveis de poluentes (orgânicos e inorgânicos) derivados da ação antrópica pode nos prejudicar, assim como a presença de metais pesados. Por isso a qualidade da água deve ser permanentemente verificada. No Brasil existem vários órgãos que agem em todas as esferas governamentais seja na emissão de outorgas, seja na fiscalização ou no tratamento das águas. Normalmente as águas superficiais provenientes de rios, lagos ou nascentes não possuem a qualidade necessária para consumo humano. Muitos acidentes têm ocorrido em diversos estados e isso tem alarmado a população. Uma metodologia que pondera esses diversos parâmetros é o Índice de Qualidade de Água (IQA). Várias companhias de água calculam esse índice para medir o padrão de qualidade, que possibilita enquadrar os cursos de água como utilizáveis. Por meio desse índice, é possível estabelecer níveis e padrões de qualidade que possibilitam o enquadramento de cursos d‘água em classes ou níveis de qualidade. (LACERDA; BILICH, 2005). Tendo esse resultado em mãos, é possível inferir sobre o meio ambiente, por exemplo. Para isso ocorrer é necessária à utilização de métodos simples que forneçam informações objetivas e de fácil interpretação. O índice de qualidade de água (IQA) utilizado pela CAESB é calculado por meio de uma equação empírica aritmética simples, que utiliza os seguintes parâmetros e seus respectivos pesos: coliformes fecais (0.2), turbidez (0.15), cor (0.1), amônia (0.15), ferro (0.15), cloreto (0.1), pH (0.05) e Demanda Química de Oxigênio (DQO) (0.1) (LACERDA; BILICH, 2005). A amônia, por exemplo, possui um elemento químico essencial no desenvolvimento das plantas. O nitrogênio é utilizado na construção de hormônios, como as catecolaminas, o DNA e outros importantes compostos nitrogenados chamados de proteínas. Utiliza-se o nitrogênio por causa de um ciclo de reações que ocorrem na biosfera. É o Ciclo do Nitrogênio visto a seguir: Figura 25 – Ciclo do Nitrogênio + Guimarães; Mello (2006) apresentam em seu artigo vários estudos no Brasil sobre os altos níveis de NO4 (via deposição úmida) nos centros urbanos e industriais. A elevada deposição atmosférica de NO+4 pode contribuir para acidificação de ambientes terrestres e aquáticos (a nitrificação resulta na formação de dois hidrogênios ácidos: NO+4 +202 2H+ +NO3– +H2O ), eutrofização de ecossistemas aquáticos e aumento da produção e emissão de óxido nitroso (N2O). Pós-Graduação a Distância Fonte: <http://www.ib.usp.br/ecologia/ciclos_biogeo_05_ciclo_nitrogenio.jpg> 51 O Estudo da Química: A Teoria e a sua Contextualização Unidade II – + Ainda de acordo com os autores, as águas da Baía de Guanabara possuem níveis bastante superiores de NO3 e NO4 quando comparados àqueles verificados nas regiões oceânicas. A Baía de Guanabara é caracterizada como um sistema costeiro poluído e eutrófico, onde as principais fontes de poluição são os esgotos domésticos. Baumgarten; Rocha e Niencheski (1996) descrevem um método espectrofotométrico para detecção de NHx em meio aquoso simples e preciso. O método consiste na reação do NHx ( NHO3 +NH+4 ) com cloro para formação da monocloramina. Esta reage com o fenol, levando a construção de um complexo de cor azul chamado de “azul de indofenol”. Também podemos medir a amônia na água através de um método simples e barato, utilizando um kit vendido em lojas de aquarofilia a um preço médio de 50 a 60 reais, porém existem outros kits baratos. O teste está longe de ser exato, mas pode ser facilmente usado em práticas do 1o e 2o graus. Podemos ainda encontrar outros testes em lojas de aquarofilia, que medem imprecisamente o nitrito e o cobre. A Demanda Química de Oxigênio (DQO) é um índice que determina a quantidade de O2 necessária para a oxidação da matéria orgânica através de um agente químico. Ela se baseia no fato de que alguns compostos orgânicos são oxidados por agentes químicos oxidantes considerados fortes como, por exemplo, o K2Cr2O7 (bicromato de potássio) em meio ácido. Sendo o resultado final dessa oxidação o dióxido de carbono e água. (VALENTE; PADILHA; SILVA, 1997). Esta técnica apenas estima a concentração de matéria orgânica em termos de oxigênio consumido já que na água, algumas espécies inorgânicas, tais como nitritos, compostos reduzidos de enxofre e substâncias orgânicas - como hidrocarbonetos aromáticos, compostos alifáticos de cadeia aberta e piridinas – não são oxidadas. A principal vantagem da DQO é a rapidez, pouco mais de duas horas. Embora a Demanda Química do Oxigênio possa ser medida com vários oxidantes, o mais comum é com o dicromato, conforme visto na reação abaixo (VALENTE et al., 1997). 2– – 3+ 0 Cr2 O7(aq) +14H2+ (aq) +6e 2Cr(aq) +7H2 O (E =+1,33V) O sítio da Enasa Engenharia mostra os materiais e o procedimento desse método. MATERIAIS • Balão de fundo chato de 500mL de boca esmerilhada. • Proveta graduada de 50mL. • Condensador de refluxo de extremidade de boca esmerilhada. Materiais e Experimentos no Ensino de Química • Pipeta volumétrica de 2, 5, 10 e 20mL. 52 • Conjunto de aquecimento. • Bureta de 50mL. • Pérolas de vidro. REAGENTES • Bicromato de potássio 0,250 N SV. • Acido sulfúrico – sulfato de prata, SR. • Sulfato ferroso amoniacal 0,25 N SV. • Ferroína SI. • Sulfato de prata PA. • Sulfato de mercúrio PA. O Estudo da Química: A Teoria e a sua Contextualização Unidade II A MONTAGEM DO EXEPERIMENTO 1. Amostras com DQO até 2000mg/L: pipetar 15mL da amostra e diluir para 100mL em balão volumétrico – 20mL da diluição conterão 3mL de amostra. 2. Amostras com DQO de 2000 até 7000mg/L: pipetar 10mL da amostra e diluir para um balão volumétrico de 100mL – 20mL da diluição conterão 2mL de amostra. 3. Amostras com DQO acima de 7000mg/L: pipetar 5mL da amostra e diluir para 100mL em um balão volumétrico – 20mL da diluição conterão 1mL da amostra. METODOLOGIA 1. Coloque cerca de 0,4g de sulfato de mercúrio em um balão de 500mL de fundo chato. 2. Coloque no balão 20mL da amostra, já diluída, e 10mL da solução de bicromato de potássio 0,25N. 3. Vagarosamente adicione ao balão 30mL da solução de ácido sulfúrico/sulfato de prata, agitando com cuidado (homogeneizar até que ocorra uma mistura completa de todos os reagentes). 4. Adicione algumas pérolas de vidro e então conecte o balão com o condensador de refluxo. 5. Repita as operações dos itens 1, 2, 3 e 4 substituindo os 20mL da amostra por 20mL de água destilada. Este será o branco. 6. Refluxe a amostra e o branco por um período de duas horas. Se após o refluxo a amostra apresentar coloração verde, significa que a amostra estava muito concentrada. Utilize uma amostra mais diluída, anote o fator de diluição. 7. Durante o processo de refluxo (2 horas) da amostra e do branco, titule a solução de sulfato ferroso amoniacal da seguinte forma: • pipete 10mL da solução padrão de bicromato de potássio em um elernmeyer de 250mL e adicione 10mL; • adicione 30mL de ácido sulfúrico concentrado, com cuidado homogeneíze, deixe esfriar; • adicione 3mL do indicador de ferroína. Titule com sulfato ferroso amoniacal Fe(NH4)2(SO4)2; a cor mudará de laranja para verde e finalmente para vermelho. 10 x 0,25 concentração da solução = _______________ = C 8. Depois da duas horas em refluxo, lave o interior do condensador com água destilada. Deixe esfriar por completo e adicione água destilada até cerca de 140 mL. 9. Titule a amostra e o branco com a solução de sulfato ferroso amoniacal, de concentração “C” já aferida. CÁLCULOS 1.Para amostra com teor de cloretos abaixo de 1000mg de CI-/L DQO para 20mL da amostra será: (A – B). C x 8000 Pós-Graduação a Distância de sulfato ferroso amoniacal mL gastos. 53 O Estudo da Química: A Teoria e a sua Contextualização Unidade II ---------------------- x D = mg/L de DQOmL da amostra A= mL de Fe(NH4)2(SO4)2 gastos com o branco B= mL de Fe(NH4)2(SO4)2 gastos com a amostra C= Concentração da solução de Fe(NH4)2(SO4)2 D= Fator de diluição 2. Amostras com teor de cloreto acima de 1000mg de CI-/L Quando a concentração de cloreto for maior de 1000mg/L o valor mínimo aceitável para DQO é 250 mg/L. Os valores menores que 250mg/L são questionáveis porque a correção a ser feita é muito alta. Para correção da DQO, é necessário preparar uma curva padrão de DQO versus mg/L de cloretos usando soluções padrões de NaCI em concentrações diversas. O intervalo deve ser de 4000mg/L até 20000mg/L de cloretos. (A – B) x C x 8000 – (50 x E x 1,2) Mg/L de DQO = ---------------------------------------------- x D mL da amostra A = mL de Fe(NH4)2(SO4)2 gastos com o branco B = mL de Fe(NH4)2(SO4)2 gastos com a amostra C = concentração da solução de Fe(NH4)2(SO4)2 D = Fator de diluição E = Correção de cloretos dada pela curva 1,2 = Fator de correção da oxidação dos cloretos em função da matéria orgânica ou não orgânica. PREPARO DAS SOLUÇÕES Materiais e Experimentos no Ensino de Química 1) Bicromato de potássio 0,250 N SV. Dissolva exatamente 12,259g de K2Cr2O7, de qualidade padrão primário, previamente seco a 105oC por 2 horas, em água destilada e dilua para em balão volumétrico para 1000mL. 54 2) Ácido sulfúrico – sulfato de prata, SR. Adicione 10g de sulfato de prata (AgSO4), a 1000mL de ácido sulfúrico concentrado. Misture e aguarde dois dias até completa dissolução. 3) Sulfato ferroso amoniacal 0,25 N SV. Dissolva 98,0g de Fe(NH4)2(SO4)2- 6H2O em água destilada, adicione 20mL de ácido sulfúrico concentrado. Resfrie e complete o volume em balão volumétrico de 1000mL. Dilua 100mL desta solução para 1000mL com água destilada. Essa solução deve ser aferida diariamente. 4) Ferroína SI. Dissolva 1,485g de 1-10 fenatrolina monohidratada ( Cr12H8N2–CH2O ) juntamente com 0,695g de FeSO–4 7H2O em água destilada e dilua a 100mL. 5) Sulfato de prata PA (Ag2SO4). Reagente pulverizado de coloração branca. 6) Sulfato de mercúrio PA (HgSO4). Cristais de alta pureza para análise. O Estudo da Química: A Teoria e a sua Contextualização Unidade II A questão ambiental que envolve a qualidade na água pode gerar discussões interessantes no laboratório após os experimentos, ou mesmo em sala de aula. Poderia ser abordada a solubilidade em água, a separação de misturas e a concentração de soluções, eutrofização. É muito importante incentivar os alunos a estudarem mais esses problemas. Monitorar constantemente a qualidade da água em busca de substâncias químicas orgânicas e inorgânicas, agentes microbiológicos e de diferentes tipos de poluentes é essencial para a sobrevivência de nossos ecossistemas. Seguem algumas questões e sugestões que poderiam auxiliar os estudantes a refletir mais sobre a necessidade de monitorar a qualidade da água e aprender mais Química: 1. Existem valores máximos permitidos para estes metais: Fe, Cu, Al, Mn e Mg, conforme os níveis de aceitação para consumo. Considerando que o consumo diário de água de uma pessoa seja de 50mL/kg/dia, qual a quantidade desses elementos que ela pode ingerir diariamente? Expresse os valores em p.p.m (partes por milhão) e em porcentagem. 2. Alguns herbicidas contêm o ácido arsênico (H3AsO4). Ele é um agente químico muito poderoso usado em inseticidas (sítio da “Environmental Chemistry”). Sabendo-se que o cloreto férrico (FeCl3) reage com o AsO–3 4 , precipitando-se como arseniato de férrico e o íon Cl-, possibilitando a sua retirada da água, escreva a equação balanceada correspondente. 3. Crie um experimento simples, possível de ser demonstrado em sala de aula ou no laboratório, que permita a detecção de algum metal pesado. Um outro problema ambiental importante é o aumento populacional das cidades. Isso tem elevado a geração de lixo, o qual pode ser definido como um material oriundo da atividade humana, descartado após o uso. A produção de lixo por habitante é algo alarmante em cidades grandes como São Paulo, Rio de Janeiro, Brasília ou Porto Alegre. De modo geral, o Brasil produz 240 mil toneladas de lixo por dia. O aumento excessivo da quantidade de lixo se deve à elevação do poder aquisitivo e ao perfil de consumo de uma população (Sitio Ajuda Brasil). Certamente é um assunto atual e interessante do ponto de vista ambiental que pode ser tratado em sala de aula. O tema envolve facilmente os estudos de Química e Biologia. Existem vários tipos de dejetos: domiciliar, urbano, industrial, hospitalar, agrícola e de uso tecnológico, como os computadores ou dejetos de usinas nucleares. A sua destinação tem sido discutida pela sociedade uma vez que não é raro o despejo em grandes lixões situados à beira de um rio, ou lago, ou estrada. A figura 26. mostra o aspecto de um desses lixões. Na foto vemos pessoas que trabalham com a reciclagem e o material que permanece em decomposição a céu aberto por longos períodos. Figura 26 – Aspecto de um lixão a céu aberto Fonte: <http://static.hsw.com.br/gif/landfill-leachate-seepage.jpg>. Acesso em jan. 2009. Pós-Graduação a Distância Essa forma de tratamento desses resíduos eleva as chances de contaminação de lençóis freáticos, dos mananciais e a proliferação de bactérias causadoras de doenças como a diarreia, a cólera, febre tifóide e doenças transmitidas por insetos. 55 O Estudo da Química: A Teoria e a sua Contextualização Unidade II O material presente nos lixões sofre um processo de decomposição química contínua. Dependendo da estrutura do solo podem ocorrer vazamentos de líquidos oriundos dessa decomposição chamado de chorume. A figura, à esquerda, mostra o vazamento de líquido, de cor escura, fétida, na cobertura vegetal. Ele é rico em metais pesados como o arsênico, cádmio, cromo, cobalto, cobre, chumbo e mercúrio. Esse líquido pode atingir os lençóis freáticos, de águas subterrâneas, poluindo esse importante recurso natural. A elevada carga orgânica presente no chorume faz com que ele seja extremamente poluente e danoso às regiões por ele atingidas. (Wikipedia.org – Brasil). Como abordar o assunto em uma aula prática? Tratando da produção de metano, por exemplo, ou de processos fermentativos utilizar cálculos estequiométricos explicados dando como exemplos a decomposição química. A celulose (C6H1005)n é um polímero de cadeia longa (um polissacarídeo) composto de um só monômero chamado glicose. Cerca de 40% do peso das plantas é constituído desse carboidrato. Ele é um dos principais constituintes das paredes celulares das plantas (cerca de 33% do peso da planta), em combinação com a lignina, com hemicelulose e pectina (STRYER, 2002; RAVEN; EVERT; ECHHORN,1996). A celulose pode sofrer a seguinte reação química: (C6H1005)n(s) + n H2O(l) 3n CO2(g) + 3 CH4(g) Esse processo é chamado de fermentação e o metano produzido pode ser utilizado como fonte de energia. Muitas empresas já utilizam o processo através da captação dos dejetos de animais em confinamento. A empresa SADIA S/A, em Santa Catarina, por exemplo, tem um programa chamado “3S” que visa promover ações para o desenvolvimento sustentável no sistema de integração de suinocultura. Eles implantam biodigestores nas granjas que são associadas à empresa. Essa tecnologia reduz o risco de contaminação do solo por dejetos dos animais e ainda implementa projetos ambientais, que geram os chamados Créditos de Carbono. Materiais e Experimentos no Ensino de Química Em 2006, a Sadia teve sua metodologia para o sequestro de carbono aprovada, e o Comitê Executivo da ONU deu seu aval para o projeto que utiliza um biodigestor para evitar a emissão de gás metano (CH4) na atmosfera originado pelos dejetos dos suínos. A previsão é de que a empresa possa negociar, no mercado internacional, de 6 a 10 milhões de toneladas de carbono em um período de 10 anos. (MINISTÉRIO DE MINAS E ENERGIA, 2006). 56 Os Créditos de Carbono são certificados gerados por projetos que, comprovadamente, através de metodologias, reduzam ou absorvam emissões de gases do efeito estufa. Os compradores desses créditos são empresas ou governos de países desenvolvidos que precisam alcançar metas (instituídas pelo Protocolo de Quioto, pela própria empresa ou por outros programas) de redução dessas emissões, e os vendedores são diversificados dependendo do país de origem do projeto. As quantidades de toneladas de CO2 ou outros gases economizadas ou sequestradas da atmosfera são calculadas por empresas especializadas de acordo com determinações de órgãos técnicos da ONU (no caso do Protocolo de Quioto). Por exemplo, uma tonelada de óleo diesel trocado por biodiesel gera o direito a 3,5 toneladas de créditos. Um hectare de floresta de eucalipto absorve por hectare, por ano, 12 toneladas de gás carbônico. Um grande O Estudo da Química: A Teoria e a sua Contextualização Unidade II aterro sanitário que capte o metano e o transforme em eletricidade pode ter o direito a milhões de toneladas de créditos por ano. (Jornal do Meio Ambiente). Projetos de aproveitamento do gás metano liberado por lixões das empresas: Vega, de Salvador (BA), e Nova Gerar, de Nova Iguaçu (RJ). O gás metano é canalizado e aproveitado para gerar energia, deixando de ser liberado na atmosfera naturalmente pela decomposição do lixo. Apesar do gás ser o metano, a redução de emissões é calculada em dióxido de carbono: 14 milhões de toneladas de CO2 em 16 anos, para a Vega e 14 milhões de toneladas de CO2 para a Nova Gerar, em 21 anos. Esses dois projetos são oficialmente os dois primeiros aprovados pelo governo brasileiro sob as regras do MDL <www.oestadao.com.br, 2004>. Para entender melhor esse processo e a sua importância, tente com os seus colegas esquematizar a planta de um biodigestor de grande porte e um caseiro. Um dos dejetos que tem gerado muitas discussões é o lixo nuclear, principalmente porque, apesar de seus defensores o considerarem limpo, são gerados resíduos que demoram centenas de anos para não emitirem mais radiação. A França tem o maior número de usinas nucleares em funcionamento. São 89 ao todo, que constituem mais de 80% da matriz energética do país. O Brasil só possui duas usinas em funcionamento. Mesmo assim o lixo gerado por elas tem preocupado a população onde as usinas estão instaladas, (NATIONAL GEOGRAPHIC, fev. 2009). Essa preocupação é válida, pois o tempo de meia vida de alguns compostos radioativos é muito longo. Vide a tabela 1. NUCLÍDEO MEIA-VIDA (T1/2) Cs 137 30 anos U 238 4,5x109 U 235 7,1x108 Co 60 5,26 Th 232 1,39x1010 Th 234 24 K 40 1,26x109 I 131 8 Hg 197 65 Pós-Graduação a Distância Tabela 1 – A meia vida de alguns elementos 57 O Estudo da Química: A Teoria e a sua Contextualização Unidade II Estamos sempre expostos à radiação, pois existem fontes que podem ser naturais ou artificiais. Entender como os elementos radioativos se comportam é imprescindível para criarmos mecanismos que nos protejam contra a contaminação. Esses conceitos são importantes e devem ser passados aos alunos. As fontes naturais que envolvem a terra nos expõem, em média, a 110 milirem por ano (REM é uma unidade de medida de dose de radiação). Esse valor vem dos raios cósmicos, das construções, dos alimentos, da água, do ar e do solo. Os raios cósmicos chegam ao nosso corpo na taxa de 1 REM por minuto por centímetro quadrado. Cerca de 15 átomos de carbono quatorze (C14) se desintegram por grama de carbono existente em nosso corpo produzindo cerca de 200.000 radiações beta por minuto. (ROCHA; HABERT, 1979). O potássio quarenta (K40) produz um número semelhante de radiações beta e gama em nosso organismo. O rádio ingerido através da água e da alimentação contribui com radiação alfa, beta e gama para o aumento da dose que recebemos. O radônio (Rn) do ar, o césio (Cs) e o estrôncio (Sr) da alimentação e outros isótopos radioativos incorporados nos materiais de construção aumentam a dose de radiação a que estamos sujeitos. As fontes artificiais são provenientes de aparelhos de radiografias (raios x) e de radioisótopos usados com diversas finalidades. Além dessas estamos expostos a radiações provenientes de usinas e explosões nucleares. (ROCHA; HABERT, 1979). É possível trabalhar no laboratório com compostos que emitam radiação e não sejam perigosos. O tecnécio 99 (Tc99), por exemplo, que é utilizado em exames de cintilografia e tem um tempo de meia vida de 3 horas. Um experimento simples, com Tc99 no tempo zero de emissão e chapas de filme fotográfico, poderia ser utilizado para ensinar aos alunos alguns conceitos importantes em físico-química como o tempo de meia-vida. E o que é o tempo de meia-vida? Não é possível prever como o núcleo de um átomo irá decair em um dado instante. Isso é um fenômeno aleatório. Existem núcleos com tempo de vida longo e outros mais curtos. Para calcular o tempo de meia-vida usamos lei fundamental do decaimento radioativo e pode ser reescrita da seguinte forma: • N=N0 e -λT Materiais e Experimentos no Ensino de Química O sinal menos indica que o número de núcleos radioativos diminui como um resultado do decaimento radioativo. A constante λ é chamada constante de decaimento e é característica de cada núcleo. Obtemos, assim, o número N de partículas que permanecem radioativas depois de um tempo t. Podemos, então, calcular o tempo t no qual o número N de núcleos radioativos é igual à metade do número inicial de núcleos radioativos No (N = No /2), donde: 58 • N0 / 2= N0 e –λT • Ln (1/2) = -λT • Ln (2) = λT • T = 0,693/λ Esse tempo t é chamado meia-vida (T1/2) e nos diz qual o tempo que deve transcorrer para que a intensidade da fonte radioativa se torne a metade da existente no tempo inicial. A constante λ tem dimensão de 1/s e caracteriza a fração de núcleos que decaem na unidade de tempo, isto é, determina a taxa de decaimento radioativo. A quantidade τ = 1/λ é chamada vida média de um isótopo radioativo, pois expressa o seu tempo médio de vida, isto é: • τ = tempo total/N0 O Estudo da Química: A Teoria e a sua Contextualização Unidade II O número de desintegrações que ocorrem em uma dada amostra radioativa durante um segundo, chamado ATIVIDADE da amostra, é medido em Bequerel (Bq). O decaimento radioativo pode ser representado através do seguinte gráfico onde o número de núcleos radioativos da amostra está relacionado à sua atividade: Observando o gráfico responda: 1. Qual o tempo t transcorrido para que a atividade seja Ao/2? 2. Qual o tempo t transcorrido para que a atividade seja Ao/4? 3. Qual o tempo t transcorrido para que a atividade seja nula? Nas regiões rurais o uso indiscriminado de fertilizantes e, principalmente, agrotóxicos chama a atenção. Eles têm sido um dos principais agentes contaminantes de rios e nascentes, prejudicando a saúde das pessoas e animais. Eu já observei, no meio rural, os vasilhames que continham agrotóxicos serem lavados para reutilização e a água utilizada nesse processo ser vertida em qualquer lugar, às vezes até próximos a poços artesianos. Curiosidade: Em uma dissertação de mestrado defendida na Universidade de São Paulo, a autora estudou a ocorrência de compostos organoclorados (pesticidas e PCBs) em mamíferos marinhos da costa de São Paulo (Brasil) e da Ilha Rei George (Antártica). Nesse trabalho ela verificou que os compostos DDTs e PCBs eram aqueles que Pós-Graduação a Distância Na primeira semana de fevereiro de 2001, em Paulínia, foi descoberto e tornado público um crime ambiental. A Shell admitiu a responsabilidade pela contaminação do lençol freático da região, localizado entre o Rio Atibaia – um dos afluentes do Rio Piracicaba – e a fábrica, com organoclorados Endrin, Dieldrin e Aldrin, que são substâncias perigosas da classe dos organoclorados. (DHESC, 2003). 59 O Estudo da Química: A Teoria e a sua Contextualização Unidade II causaram mais impacto nos cetáceos da costa de São Paulo. Isso refletiu o histórico de ambos no Brasil, tanto em indústria como em agricultura e saúde pública. O impressonante foi ter dectetado na foca de Weddell (Leptonychotes weddelli), habitante do continente antártico, cargas baixas, mas existentes desses contaminantes. As toninhas (Pontoporia blainvillei) o golfinho-nariz-de-garrafa (Tursiops truncatus) também apresentaram baixos níveis de organoclorados. Os botos-cinza (Sotalia fluviatilis) revelaram concentrações de DDT iguais ou superiores a cetáceos da Índia, país onde esse pesticida ainda não está proibido. Já o golfinho-de-dentes-rugosos (Steno bredanensis) mostrou a maior contaminação entre os animais analisados, comparável a espécies estudadas em águas costeiras de países desenvolvidos (onde os organoclorados foram muito utilizados). Para compreender o papel desses contaminantes, os alunos inicialmente deveriam identificar quão tóxicos são estes agentes químicos empregados na agricultura. Um experimento realizado com meio de cultura celular e doses crescentes dos pesticidas mais empregados teriam uma grande relevância no aprendizado. O experimento poderia ser feito desta forma: • uma placa de petri contendo meio de cultura para uma célula comum como a Secherichia colli. Doses crescentes de um metal pesado poderiam ser utilizados para mostrar como cotaminantes interferem no crescimento de uma população de micro-organismos. Várias questões poderiam ser discutidas com esse experimento: 1. Quais seriam os principais processos de liberação de agrotóxicos no ecossistema, Materiais e Experimentos no Ensino de Química 2. O que é biomagnificação? 60 O governo do Japão aprovou nesta terça-feira uma série de medidas para estimular a reciclagem que pretende fazer com que a produção de lixo por parte de indústrias e indivíduos caia 60%. O objetivo deverá ser alcançado em 2015 e é relativo à produção registrada no ano de 2000. Entre outras medidas, os cidadãos serão instados a levar os próprios hashis (pauzinhos que substituem os talheres) para as refeições em restaurantes, ao invés de usar os descartáveis oferecidos pelos estabelecimentos. Outra medida é estimular entre os consumidores o hábito de usar sacolas permanentes para compras em lojas e supermercados, em lugar dos sacos plásticos descartáveis. As pessoas serão estimuladas ainda a mudar hábitos de transporte. Por isso, o carro deverá ceder lugar ao transporte público e também às bicicletas. O Estudo da Química: A Teoria e a sua Contextualização Unidade II De acordo com Tsuyoshi Kawakami, do Ministério do Meio Ambiente, os cidadãos deverão responder pelo corte de cerca de 20% na produção do lixo. O restante virá de medidas adotadas pela indústria. “Ainda há muito por fazer. Não conseguimos nos desvencilhar dos costumes da sociedade de consumo”, disse Kawakami, segundo reportagem da CNN. O objetivo final dos japoneses é reduzir a produção global de lixo a 25,3 milhões de toneladas ao ano em 2015. Em 2000, esse valor era de 63 milhões de toneladas. Fonte: Veja On-line citada na página <http://viajeaqui.abril.com.br/ng/index.shtml> TEXTO 1 QUINA, F H. Nanotecnologia e o meio ambiente: perspectivas e riscos. Química Nova. [online]. v. 27, n. 6, p. 1028-1029. ISSN 0100-4042, 2004. NANOTECNOLOGIA E O MEIO AMBIENTE: PERSPECTIVAS E RISCOS A editoria de Química Nova recebeu esta carta do Prof. Frank Quina, um dos diretores do CEPEMA (USP), onde é exposta uma reflexão sobre o desenvolvimento da nanotecnologia e seu impacto sobre o meio ambiente. A matéria é considerada de alta prioridade científica e merece a análise e reflexão de toda a comunidade Química. O aproveitamento dessas propriedades em aplicações tecnológicas forma a base da nanotecnologia de materiais. Há, também, uma área ainda incipiente da nanotecnologia, denominada nanotecnologia molecular ou nanofabricação (nanomanufacturing), que almeja o desenvolvimento de sistemas nanométricos autorreplicantes (nanorrobôs ou nano-bots) capazes de fabricar, sob medida, materiais ou objetos através da manipulação da matéria a nível molecular. Não há dúvida de que a nanotecnologia oferece a perspectiva de grandes avanços que permitam melhorar a qualidade de vida e ajudar a preservar o meio ambiente. Entretanto, como qualquer área da tecnologia que faz uso intensivo de novos materiais e substâncias químicas, ela traz consigo alguns riscos ao meio ambiente e à saúde humana. Nos próximos parágrafos, analisaremos resumidamente os possíveis benefícios e perigos da nanotecnologia. Pós-Graduação a Distância A nanotecnologia estende a ciência de materiais para o domínio de partículas e interfaces com dimensões extremamente pequenas, da ordem de um a cem nanômetros. Partículas desse tamanho, ou “nanopartículas”, apresentam uma grande área superficial e, frequentemente, exibem propriedades mecânicas, ópticas, magnéticas ou químicas distintas de partículas e superfícies macroscópicas. 61 O Estudo da Química: A Teoria e a sua Contextualização Unidade II As três principais áreas nas quais podemos esperar grandes benefícios provenientes da nanotecnologia são13: (a) na prevenção de poluição ou dos danos indiretos ao meio ambiente. Por exemplo, o uso de nanomateriais catalíticos que aumentam a eficiência e a seletividade de processos industriais resultaria num aproveitamento mais eficiente de matérias-primas, com consumo menor de energia e produção de quantidades menores de resíduos indesejáveis. A nanotecnologia vem contribuindo para o desenvolvimento de sistemas de iluminação de baixo consumo energético. Na área da informática, o uso de nanoestruturas de origem biológica pode oferecer uma estratégia alternativa para a fabricação de dispositivos microeletrônicos. A nanotecnologia também vem aprimorando o desenvolvimento de displays (como, por exemplo, monitores de computador ou displays dobráveis de plástico que podem ser lidos como uma folha de papel) que, além de serem mais leves e possuirem melhor definição, apresentam as vantagens da ausência de metais tóxicos na sua fabricação e de terem um consumo menor de energia. (b) no tratamento ou remediação de poluição. A grande área superficial das nanopartículas lhes confere, em muitos casos, excelentes propriedades de adsorção de metais e substâncias orgânicas. A etapa subsequente de coleta das partículas e remoção de poluentes pode ser facilitada pelo uso, por exemplo, de nanopartículas magnéticas. Materiais e Experimentos no Ensino de Química As propriedades redox e/ou de semicondutor de nanopartículas podem ser aproveitadas em processos de tratamento de efluentes industriais e de águas e solos contaminados, baseados na degradação química ou fotoquímica de poluentes orgânicos. Num cenário futurístico, um exército de nano-bots poderia ser utilizado para descontaminar microscopicamente sítios de derrame de produtos químicos. 62 (c) na detecção e monitoramento de poluição. A nanotecnologia vem permitindo a fabricação de sensores cada vez menores, mais seletivos e mais sensíveis para a detecção e monitoramento de poluentes orgânicos e inorgânicos no meio ambiente. Avanços em sensores para a detecção de poluentes implicam diretamente num melhor controle de processos industriais; na detecção mais precoce e precisa da existência de problemas de contaminação; no acompanhamento, em tempo real, do progresso dos procedimentos de tratamento e remediação de poluentes; num monitoramento mais efetivo dos níveis de poluentes em alimentos e outros produtos de consumo humano; na capacidade técnica de implementar normas ambientais mais rígidas, etc. Não obstante essas perspectivas animadoras dos benefícios da nanotecnologia para a melhoria do meio ambiente, não se deve subestimar o potencial para danos ao meio ambiente2-10. As mesmas características que tornam as nanopartículas interessantes do ponto de vista de aplicação tecnológica podem ser indesejáveis quando essas são liberadas ao meio ambiente. O pequeno tamanho das nanopartículas facilita sua difusão e transporte na atmosfera, em águas e em solos, ao passo que dificulta sua remoção por técnicas usuais de filtração. Pode facilitar também a entrada e o acúmulo de nanopartículas em células vivas. De modo geral, sabe-se muito pouco ou nada sobre a biodisponibilidade, biodegradabilidade e toxicidade de novos nanomateriais. A contaminação do meio ambiente por nanomateriais com grande área superficial, boa resistência mecânica e atividade catalítica pode resultar na concentração de compostos tóxicos na superfície das nanopartículas, com O Estudo da Química: A Teoria e a sua Contextualização Unidade II posterior transporte no meio ambiente ou acúmulo ao longo da cadeia alimentar; na adsorção de biomoléculas, com consequente interferência em processos biológicos in vivo; na maior resistência à degradação (portanto, maior persistência no meio ambiente) e em catálise de reações químicas indesejáveis no meio ambiente. Apesar da crescente preocupação em relação às potencialidades negativas da nanotecnologia para o meio ambiente e/ou para a saúde humana, ela ainda não enfrenta nenhuma oposição tecnofóbica sistemática (algumas exceções isoladas incluem um pedido de moratória na pesquisa em nanotecnologia molecular, feito pelo ETC Group12 do Canadá, e uma obra de ficção sobre as consequências de liberação de nanobots autorreplicantes ao meio ambiente13). Aliás, quase todos os simpósios e estudos recentes 2,4-11 que avaliaram os riscos da nanotecnologia para o meio ambiente tratam a questão com equilíbrio e em termos predominantemente científicos. Três desses estudos, todos disponíveis pela internet, merecem destaque: (1) A. H. Arnall, Future Technologies, Today’s Choices: Nanotechnology, Artificial Intelligence and Robotics; A technical, political and institutional map of emerging technologies 8, de 2003, da conhecida organização ecológica Greenpeace Environmental Trust, que trata de forma bastante equilibrada a questão. (2) Nanotechnology: small matter, many unknowns”9, de 2004, da resseguradora internacional Swiss Re, que alerta para o estado de desconhecimento dos riscos associados à nanotecnologia e enfatiza a necessidade de normas e pesquisa que delineiem e minimizem esses riscos para as companhias de seguros. (3) Nanoscience and nanotechnologies: opportunities and uncertainties”10, da Academia Real de Engenharia e da Sociedade Real do UK, de julho de 2004, que recomenda, entre outras coisas, cuidado na manipulação ou aplicação de nanopartículas artificiais em forma livre (e.g., em processos voltados para a remediação do meio ambiente) e o tratamento de nanopartículas e nanotubos como substâncias químicas novas para fins regulatórios. Aponta ainda a necessidade de pesquisa interdisciplinar voltada para as questões de toxicidade, epidemiologia, persistência e bioacumulação de nanopartículas. Pós-Graduação a Distância Evidentemente, cabe à nossa comunidade avaliar continuamente as tecnologias em desenvolvimento nos laboratórios do ponto de vista do seu potencial de risco, buscando conscientemente soluções e alternativas que eliminem ou minimizem os possíveis danos ao meio ambiente ou à saúde, principalmente daqueles que manipulam nanopartículas em nossos laboratórios. Neste contexto, são da mais alta relevância iniciativas como o Edital MCT/CNPq no 13/2004, vinculado ao Programa de Desenvolvimento da Nanociência e da Nanotecnologia, que contemplou “apoio a atividades de pesquisa voltadas para o estudo de aspectos éticos ou impactos ambientais da nanotecnologia e nanobiotecnologia”. 63 O Estudo da Química: A Teoria e a sua Contextualização Unidade II TEXTO 2 TOMA H E. Nanotecnologia das moléculas. Química Nova na Escola no 21, maio 2005. Com adaptações. Neste início de milênio, a atenção do mundo está voltada para os aspectos moleculares da Ciência, como pode ser visto desde a Biologia Molecular até a recente explosão da nanotecnologia. Assim, muito da inovação que tem acontecido tem algo familiar para quem lida com a Química. Recentemente, Henry Taube, 90, Prêmio Nobel de Química de 1983 e membro da Academia Brasileira de Ciências, ao ser indagado sobre a sua visão do futuro, declarou: “Eu realmente aprecio o que está sendo feito na nanotecnologia. Os cientistas finalmente estão acreditando nos átomos. Se pudesse prosseguir na Química, eu escolheria essa área para fazer pesquisa”. Qual o sentido dessa declaração, feita por um dos maiores químicos de todos os tempos, se os átomos e moléculas sempre estiveram no foco da Química? De fato, a Química já consegue racionalizar grande parte do conhecimento sobre as substâncias, principalmente na escala macroscópica, onde a unidade de contagem é o mol, quantidade de matéria que contém esse número imenso de entidades conhecido como número de Avogadro (6 x 1023). Contudo, será que todo esse conhecimento se aplica a uma única molécula? Será que a cor de uma molécula é a mesma da substância a que dá origem? Com que velocidade um elétron ou um fóton transitariam pela molécula? Existiriam trilhas e armadilhas ao longo do percurso? Seria possível armazenar informações em sua estrutura e depois acessá-las? Poderíamos manipular suas propriedades intrínsecas, controlar seus movimentos e interações? Processá-las em conjunto, para obter arquiteturas planejadas e arranjos organizados? Depois disso, orquestrar suas ações de forma sinergística, para realizar um trabalho harmonioso e inteligente? E, finalmente, por que não, fazer das moléculas verdadeiras máquinas, ou utilizá-las para construir complexas máquinas moleculares? Realmente, quando começamos a pensar dessa forma, a Química ganha um novo sentido. Talvez muito mais puro, em sua essência, porém assimilando ao mesmo tempo novos conceitos tecnológicos. Materiais e Experimentos no Ensino de Química Nesse nível, a Química se confunde com a nanotecnologia molecular passa a usar novas ferramentas capazes de lidar com objetos muito pequenos, numa escala onde os fenômenos clássicos e quânticos se misturam. Essa nova maneira de ver a Química é a mensagem embutida na declaração de Henry Taube. 64 A tecnologia atual caminha definitivamente para a escala nanométrica, tanto através da miniaturização na eletrônica (sentido descendente, topdown), como através da montagem nanoestrutural a partir de átomos e moléculas (sentido ascendente, bottomup). Note que a dimensão expressa por 1 nanometro (1 nm) equivale a um bilionésimo do metro (10-9 m). Nessa dimensão, a luz visível, em sua faixa de comprimento de onda característica (400 a 760 nm), já não pode ser usada para enxergar os objetos, pois as leis da Física limitam a resolução óptica à metade do comprimento de onda utilizado. Assim, literalmente, estamos entrando em um mundo invisível. Para visualizar as formas nanométricas, uma saída seria empregar minúsculas pontas ou sondas, capazes de atuar como se fossem dedos na leitura Braille, varrendo a superfície através de delicados movimentos com precisão atômica. Que tipo de máquina faria isso? Na prática, podemos usar um simples cristal piezelétrico, como aqueles existentes em aparelhos de som. Esse tipo de cristal converte a pressão (piezo) em impulsos elétricos e vice-versa, através de deslocamentos atômicos em sua estrutura. Assim, basta colar uma ponta ou agulha muito fina nesse cristal e programar no computador os estímulos elétricos a serem aplicados, para gerar movimentos muito precisos na escala nanométrica. O Estudo da Química: A Teoria e a sua Contextualização Unidade II Essas ideias foram colocadas em prática, no início dos anos 1980, por Gerd Binnig e Heinrich Rohrer, na IBM (Suíça). Eles utilizaram uma agulha metálica movimentada por um cristal piezelétrico para sondar uma superfície condutora, através das diminutas correntes elétricas que começam a fluir quando as distâncias de aproximação entram na escala nanométrica. Tais correntes são denominadas de tunelamento, pois os elétrons conseguem vencer o espaço vazio (barreira isolante) que separa a ponta da sonda e a superfície condutora, como se passassem através de um túnel. Na realidade, o tunelamento é um fato característico do mundo quântico e está associado à natureza ondulatória do elétron. Medindo as correntes de tunelamento, Binnig e Rohrer obtiveram uma imagem topográfica da superfície, com resolução atômica. O novo microscópio (STM = scanning tunneling microscope), que deveria ser chamado de nanoscópio, permitiu visualizar os átomos sobre uma superfície! Por essa invenção, esses cientistas receberam o Prêmio Nobel de Física de 1986. O nanoscópio foi e continua sendo trabalhado de modo a utilizar não apenas as correntes de tunelamento, como também as vibrações e outros efeitos produzidos nas sondas, à medida que interagem com a superfície. A modalidade conhecida como AFM (atomic force microscopy) utiliza um laser que, ao refletir sobre a base da sonda, reproduz seus movimentos com grande precisão. Da mesma forma que um dedo consegue indicar se a superfície é mole ou dura, uma sonda de AFM também fornece muito mais informações do que simplesmente a imagem da superfície e das moléculas nela depositadas. Também é possível ter informações sobre a natureza e homogeneidade do material e sobre suas propriedades elétricas ou magnéticas. Por outro lado, através de modificações químicas, as sondas também podem ser usadas como ferramentas analíticas para monitorar átomos e moléculas específicas sobre uma superfície. Imitando as canetas-tinteiro, as sondas já vêm sendo empregadas para escrever com átomos ou moléculas, deslocando-os ou depositando-as sobre superfícies metálicas de planaridade atômica. Esse processo de gravação foi inicialmente demonstrado por Don Eigler, na IBM, que surpreendeu o mundo ao escrever a sigla da empresa com átomos de xenônio. Moléculas processando informações os CDs e DVDs, constituem atualmente a forma mais prática de guardar e reproduzir informações. A gravação dos bits nesses discos plásticos faz uso de um fino filme de moléculas como as fitalocianinas, com alto poder de absorção de luz acima de 600 nm. Esse filme é depositado sobre uma superfície refletora e protegido por um revestimento de polímero transparente. Usando um feixe de laser focalizado, a concentração de fótons torna-se muito alta e, ao serem absorvidos pelas moléculas, esses fótons acabam provocando alterações químicas e físicas na interface refletora que podem ser facilmente monitoradas pelo detector óptico. Isto permite gravar bits num espaço submicrométrico, conferindo enorme capacidade de memória a esses discos. Utilizando transformações fotoquímicas reversíveis é possível gravar e apagar informações no nível molecular. Pós-Graduação a Distância Em 2001, Chad Mirkin introduziu a nanolitografia de ponta de pena, utilizando as sondas para compor imagens com resolução nanométrica, ou como uma nanoimpressora capaz de escrever dezenas de páginas completas no espaço da largura de um fio de cabelo. No final de 2003, a IBM anunciou um novo processo de gravação e leitura em CDs empregando milhares de pontas de microscopia de varredura de sonda. Essa nova ferramenta, denominada Milliped, ampliará em várias ordens de grandeza a capacidade de memória dos atuais CDs. 65 O Estudo da Química: A Teoria e a sua Contextualização Unidade II A Química tem na nanotecnologia uma aliada perfeita para expressar toda a riqueza de propriedades e aplicações inerentes ao mundo molecular, dando origem a sistemas inteligentes (por exemplo, dotados de capacidade de reconhecimento e mecanismos alostéricos), nanomateriais e nanodispositivos eletrônicos, sensoriais e de conversão de energia. Atualmente, o impacto da nanotecnologia já está sendo sentido em todos os países, justificando investimentos governamentais superiores a 3 bilhões de dólares, aproximadamente equidistribuídos entre o Japão, EUA, União Europeia e o conjunto formado pelos demais países. Investimentos mais vultosos estão sendo feitos pelo setor privado, diante da expectativa de que o mercado da nanotecnologia chegará a um trilhão de dólares na próxima década. No Brasil, já existem várias redes de pesquisa em nanotecnologia, além de alguns institutos especializados. Cientes de tratar-se de uma grande portadora de futuro, diversos setores do governo já se mobilizam para criação de programas nacionais e regionais de nanotecnologia e nanociências. Nesse sentido, a questão da nanotecnologia também não pode deixar de ser incluída no cenário da Educação, visto que os principais atores dessa nova era serão os jovens estudantes, que precisarão ser preparados para ingressar nesse mercado de trabalho. Materiais e Experimentos no Ensino de Química H. E. Toma. 66 Para (não) Finalizar Como vimos neste Caderno, a química consiste de resultados obtidos de práticas experimentais e de teorias de algum modo semelhante a quase todos os aprendizados. Este Caderno torna evidente, que para aprender Química é indispensável a prática, os experimentos ao mesmo tempo que recebemos as informações reóricas do professor e dos livros. Temos consciência de que grande número de escolas não possui laboratórios apropriados, mas, uma vez que a Química é a ciência que está mais diretamente relacionada com o nosso dia a dia, está presente em nossa realidade, nos acompanha 24 horas po dia, está evidente em praticamente todos os produtos que utilizamos, sabemos que, para grande número de práticas químicas, não é necessário ter grandes laboratórios (até o labotatório poder ser dispensado em muitos casos), nem manipular instrumentos e substâncias caras. Há muitas coisas em nossa cassa que podem ser usadas. Nas farmácias, nos supermercados, podemos encontrar muitos instrumentos e materiais à preços Módicos. Há livros, além deste Caderno, que trazem descrições de experiências de pequeno custo, que podem ser feitas com produtos facilmente encontrados no mercado. Aí entra, além da ação do professor e a troca de ideias com seus colegas, o seu próprio esforço. É importante observar os feômenos com atenção e pedir sempre a orientação do professor. Em pouco tempo você estará surpreendido. Verá que, além de ter conhecimento de muita coisa, a aprendizagem foi um acontecimento natural e que a sua capacidade de absorver novos conhecimentos terá sido ampliada pelo exercício e pela satisfação em sentir o próprio crescimento. Por tudo isso, lembre-se de que o assunto não termina aqui. Há muito o que aprender. O que foi visto nesta etapa é um caminho apontando para fontes inesgotáveis de estudos e experimentações. Pós-Graduação a Distância Caminhe sempre, rumo à descoberta. Dessa forma, seus horizontes se ampliarão e, consequentemente, seu desempenho profissional. 67 Referências A TEORIA DA FORÇA VITAL. Disponível em: <http://pt.wikipedia.org/wiki/Teoria_da_for%C3%A7a_vital>. Acesso em: dez. 2008. BAINES, J. Chuva Ácida SP. Scipione 1993. BAUMGARTEN, M. D. G. Z.; ROCHA, J. M. D. B.; NIENCHESKI, L. F. H. Manual de análises em oceanografia Química. Rio Grande: Furg, 1996. BUTLER, D. Nature. 2006, 441, 914. CARDOSO. V. N.; DINIZ, S. O. F. Curso prático para aprender a metodologia e aplicação de radioisótopos. M.G.: Universidade Federal de Minas Gerais, Faculdade de Farmácia, 2006. COUTO, J. M. Entre estatais e transnacionais: o Pólo Industrial de Cubatão. Disponível em: <http://www. novomilenio.inf.br/cubatao/ch100s.htm>. Acesso em: out. 2008. COLLINS, C. H.; BRAGA, G. L.; PIERINA, S. B. Introdução a métodos cromatográficos. 4. ed. Campinas: Unicamp, 1990. CRICHTON, M.; Prey, HarperCollins Publishers: New York, 2002; publicado no Brasil com o título Presa. SP: Rocco. DADOS DO JORNAL DO MEIO AMBIENTE. Disponível em: <http://www.revistameioambiente.com.br/2008/03/28/ creditos-de-carbono/>. Acesso em: jan. 2009. DAGANI, R. Nanomaterials: safe or unsafe?. Chem. Eng. News 2003, 81, 30. DE ALMEIDA, V. V. et al. Catalisando a hidrólise da Uréia em Urina. Química Nova Escola. no 28, maio 2008. DE OLIVEIRA, M. F.; PEREIRA-MAIA, E. Alterações de cor dos vegetais por cozimento: experimento de Química Inorgânica Biológica. Química Nova na Escola. no 25, maio 2007. Materiais e Experimentos no Ensino de Química DO CANTO, E. L.; PERUZZO T. M. Química: na abordagem do cotidiano. 3. ed. S.L.: Moderna, 1995, v. 3. 68 FALJONI-ALARIO A. Carta ao editor. Quím. Nova [on-line]. 1998, v. 21, n. 5, p. 674-680. ISSN 0100-4042. FEDER, T. Physics Today. 2004, 57, 30. FELTRE, R. Química: Química Geral. 6. ed. S.L.: Moderna, 2006, v. 1. FIGURA 1. Disponível em: <http://biobioradicais.blogspot.com/2008/11/fontes-dos-radicais-livres.html>. Acesso em: dez. 2008. FIGURA 4. Disponível em: <http://www.jbrj.gov.br/materias/imagens/31_10_2006(4)_lixo.jpg>. Acesso em: dez. 2008. FIGURA 5. Disponível em: <http://madeincarla.wordpress.com/2007/11/29/acabou/>. Acesso em: dez. 2008. FIGURA 6. Disponível em: <http://pt.wikipedia.org/wiki/Cromatografia>. Acesso em: dez. 2008. Referências FIGURA 12. Disponível em: <http://i.s8.com.br/images/books/cover/img7/1023247_4.jpg>. Acesso em: dez. 2008. FIGURA 15. Disponível em: <http://www.icb.ufmg.br/prodabi/grupo5/synthesis/cloroplasto/chloroplast2.gif>. Acesso em: dez. 2008. FIGURA 21. Disponível em: <http://br.geocities.com/acideznachuva134/chuva_acida1.jpg>. Acesso em: dez. 2008. FRIEDMANN,H. C. From Friedrich Wöhler´s Urine to Eduard Buchner´s Alcohol Universitat de València, Valencia, Spain: p. 67–122, Ed. A. Cornish-Bowden, 1997. GIORDAN, M. O papel da experimentação no ensino de Ciências. Química Nova na Escola 10, p. 43-49, 1999. _____. Ensaio sobre o papel da animação e da simulação. Disponível em: <http://www.lapeq.fe.usp.br/pdf/ giordan_2005.pdf>. Acesso em: dez. 2008). GUIMARÃES, G. P.; MELLO, W. Z. DE. Estimativa do fluxo de amônia na interface ar-mar na Baía de Guanabara: estudo preliminar. Quím. Nova [on-line]. v. 29, n. 1, p. 54-60. 2006. ISSN 0100-4042. HALLIWELL, B.; GUTTERIDGE, J.M.C. Free Radical in Biology and Medicine Oxford. Fourth Edition, Clarwndon, 2000, p. 936. INMETRO. Disponível em: <http://www.inmetro.gov.br/consumidor/unidLegaisMed.asp#principaisSI>. Acesso em: jan. 2009. KEIPER. A. The New Atlantis, 2003, no 2 (Summer), p. 17-34: Disponível em: <http:// www.thenewatlantis.com/ archive/2/keiperprint.htm>. Acesso em: set. 2004. LACERDA, M. P. C.; BILICH, M. R. Avaliação da qualidade da água do Distrito Federal (DF), por meio de geoprocessamento. XII SIMPÓSIO BRASILEIRO DE SENSORIAMENTO REMOTO, Anais. Goiânia, Brasil, 16-21 abr. INPE, p. 2059-2065, 2005. LIMA, R.; FRACETO, L. F. Abordagem Química na Extração do DNA. Química Nova na Escola. no 25, maio 2007. MAIA, D. J.; et al. Acid Rain: An Experiment for Introducing Concepts of Chemical Equilibrium and Acidity in High School. Química Nova na Escola, 21 de maio de 2005. MASCIANGIOLI, T.; ZHANG, W. T. Environ. Sci. Technol. 2003, 37, 102A. MINISTÉRIO DE MINAS E ENERGIA. Disponível em: <http://www.conpet.gov.br/noticias/noticia.php?id_ noticia=657&segmento=>. Acesso em: jan. 2009. NOGUEIRA J. M. F.; MIKHAIL S.; TSWETT. Um legado para a cromatografia moderna. Química 100, jan/mar, 2006. NOTA DA NATIONAL HUMAN GENOME RESEARCH INSTITUTE SOBRE O FIM DO PROJETO GENOMA. Disponível em: <http://www.genoscope.cns.fr/externe/English/Actualites/Presse/HGP/HGP_press_release-140403.pdf>. Acesso em: dez. 2008. OBERDÖRSTER, E.; Environ. Health Perspect. 2004, 112, 1058. Pós-Graduação a Distância MORENO, F. P.; LEITE, F. C. L.; ARELLANO, M. Á M. Acesso livre a publicações e repositórios digitais em ciência da informação no Brasil. Perspect. ciênc. inf. [on-line]. 2006, v. 11, n. 1, p. 82-94. ISSN 1413-9936. 69 Referências O DNA VAI À ESCOLA. MÓDULO 1: PRÁTICA DE EXTRAÇÃO DO DNA. Disponivel em: <http://www. odnavaiaescola.com/modulo1.pdf>. Acesso em: dez. 2008. PÁGINA “AJUDA BRASIL”. Disponível em: <http://www.ajudabrasil.org/6.567.html>. Acesso em dez. 2008. PALOSCHI, R.; ZENI, M.; RIVEROS, R. Cromatografia em giz no ensino de química: didática e economia. Química Nova na Escola. Experimentos cromatográficos no 7, maio 1998. PLATAFORMA BRASILEIRA DE DIREITOS HUMANOS ECONÔMICOS, SOCIAIS E CULTURAIS – DHESC: Relatório Brasileiro sobre Direitos Humanos Econômicos, Sociais e Culturais 2003: alimentação, terra e água, meio ambiente, saúde, moradia adequada, educação e trabalho. Publicado em 2003. POMPEI, A. M.; JARDIM W. F. Especiação de Mercúrio em Águas Naturais: toxicidade aguda usando Escherichia Coli. Trabalho apresentado na 23o Reunião da Sociedade Brasileira de Química (SBQ), 2000. POTENTIAL Risks of Nanotechnologies on the Environment and the Food Chain: Disponível <www.azonano. com/details.asp?ArticleID=1007>. Acesso em: set. 2004. PROGRAMA DE COMPUTADOR CARBÓPOLIS: Disponível em: <http://www.iq.ufrgs.br/aeq/carbopp.htm>. Acesso em: dez. 2008. PUBMED. <http://www.plos.org/>. Acesso em dez. 2008. RAMOS, L. A; LUPETTI, K. O.; CAVALHEIRO, É. T. G.; FATIBELLO-FILHO, O. Utilização do extrato bruto de frutos de Solanum Nigrum L no ensino de química. Eclet. Quím. [on-line]. v. 25, p. 229-240, ISSN 0100-4670, 2000. RAVEN P. H.; EVERT, R. F.; EICHHHORN, S. E. Biologia vegetal. 5. ed. Editora Guanabara Koogan, 1996. ROCHA, A. F. G.; HABERT, J. C. Medicina Nuclear (Bases). Rio de Janeiro. Guanabara Koogan, 1979. SILVA, G. D. F. Práticas de Química Orgânica (UFMG). SÍTIO DO PROINFO – PROGRAMA NACIONAL DE TECNOLOGIA EDUCACIONAL. Disponível em:<http://portal. mec.gov.br/seed/index.php?option=content&task=view&id=136&Itemid=77>. Acesso em: dez. 2008. Materiais e Experimentos no Ensino de Química SÍTIO DA ENASA ENGENHARIA. <http://www.enasaeng.com.br>. Disponível em: <www.tratamentodeagua. com.br>. Acesso em: jan. 2009. 70 SÍTIO DA ENVIRONMENTAL CHEMISTRY. Disponível em: <http://environmentalchemistry.com/>. Acesso em: jan. 2009). SOARES, M. H.; FLORA B.; SILVA, M. V. B.; CAVALHEIRO, E. T. G. Aplicação de corantes naturais no ensino médio. Eclet. Quím. [on-line]. v. 26, p. 225-234. ISSN 0100-4670, 2001. SCIELO 10 ANOS <http://www.eventos.bvsalud.org/scielo10/presentation.php?lang=pt>. Acesso em: nov. 2008. STREIT, N. M. et al. As clorofilas. Ciência Rural. v. 35, no 3, p. 748-755, 2005. STRYER, L. Princípios de Bioquímica. 4. ed. Rio de Janeiro. Ed. Guanabara Koogan, 2002. TAAS – TREINAMENTO E ASSISTÊNCIA MÉDICA. Disponível em: <http://www.taas.com.br/v1/figuras/maior/ maior_0903100820queimaduras.JPG>. Acesso em: dez. 2008. Referências TABELA 1. Instituto de Física: Disponível em: <http://www.if.ufrgs.br/cref/radio/capitulo2.htm>. Acesso em jan. 2008. TEACHER TUBE: quebrando Tabela periódica. Em blocos <http://www.teachertube.com/view_video.php?viewkey =e0728c118c7990c24f31>. Acesso em: out. 2008. U. S. Environmental Protection Agency (EPA), STAR Progress Review Workshop. Nanotechnology and the Environment: Applications and Implications. 2002: Disponível em: <http://es.epa.gov/ncer/publications/workshop/ nano_proceed.pdf>. Acesso em: set. 2004. VALENTE, J. P. S.; PADILHA, P. M.; SILVA, A. M. M. Oxigênio dissolvido (OD) demanda bioquímica de oxigênio (DBO) e demanda química de oxigênio (DQO) como parâmetros de poluição no ribeirão Lavapés/Botucatu – SP. Eclet. Quím. [on-line]. v. 22, p. 49-66, 1997. VOET, D.; VOET, J. G.; AND PRATT, C. W. Fundamentos de Bioquímica. 2. ed. Porto Alegre. Ed. Artmed S/A. 2006. WREN, J. D. British Medical Journal. 2005, 330, 1128. YOKAICHIKA, D. K.; GALEMBECK, E.; BAYARDO T, B. Radicais livres de oxigênio: um software introdutório. Quím. Nova [on-line]. 2000, v. 23, n. 2, p. 267-269, 2000, ISSN 0100-4042. Sites recomendaddos <http://www.greenpeace.org.uk/MultimediaFiles/Live/FullReport/5886.pdf> Acesso em: set. 2004. <http://www.swissre.com/INTERNET/pwsfilpr.nsf/vwFilebyIDKEYLu/ ULUR-5YNGET/$FILE/Publ04_Nanotech_ en.pdf>. Disponível em: set. 2004. <http://www.nanotec.org.uk/finalReport.htm>.Acesso em set. 2004. Um estudo semelhante da Academia Nacional de Ciências dos EUA deve ser concluído em 2005. O relatório do UK descarta como improvável uma das nanofobias mais populares, a catástrofe gray goo, em que uma gosma cinza formada pela multiplicação desenfreada de nanorrobôs autorreplicantes cresce até o ponto de asfixiar a vida do planeta. Action Group on Erosion, Technology and Concentration: <http:// www.etcgroup.org/search.asp?theme=11>. Acesso em: set. 2004. Vide também: Águas Turbulentas da Nanotecnologia (Nano’s Troubled Waters) <http:// www.etcgroup.org/documents/GT_TroubledWater_April1.pdf>. Acesso em: set. 2004. <http://www.periodicos.capes.gov.br/portugues/documentos/ies/iesAlfa.xls>. Acesso em: dez. 2008. <http://www.eca.usp.br/njr/voxscientiae/dina_normanda14.html>. Acesso em: dez. 2008. <http://server2.iq.ufrj.br/~joab/iqb201/tutorial/cromatografia/cromatografia_em_papel.html>. Acesso ao site da UFRJ em jan. 2008. WIKIPEDIA. Disponível em: <http://pt.wikipedia.org/wiki/Chorume>. Acesso em: jan. 2009. Pós-Graduação a Distância Mais informação está disponível nos websites de organizações como: o Center for Responsible Nanotechnology <http://crnano.org>: o Center for Biological and Environmental Nanotechnology (CBEN)<http:// www.ruf.rice. edu/~cben/>, associado ao Environmental & Energy Systems Institute da Rice University <http://eesi.rice.edu/ nanotech.cfm>, mantido pela Fundação Nacional de Ciência (NSF) dos EUA; e o Foresight Institute <http://www. foresight.org/>. 71
Download