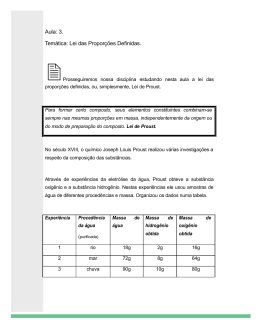
ROTEIROS DE ESTUDOS DE RECUPERAÇÃO FINAL Ensino Fundamental II – 9º Ano Professor: Mauro Disciplina: Ciências Os alunos devem responder o questionário antes e apresentar as respostas na primeira aula de recuperação de Ciências. As dúvidas em relação às questões deverão ser anotadas para serem sanadas em sala. Os alunos devem vir às aulas de recuperação com a apostila e o caderno em mãos. Questionário 1) Considere as seguintes reações químicas e a tabela de massas atômicas para responder às questões a e b a seguir: I) II) III) 2H2O ---> O2 + 2H2 H2 + Cl2 ---> 2HCl HCl + NaOH ---> H2O + NaCl Elemento Químico Hidrogênio Sódio Oxigênio Cloro Símbolo Químico H Na O Cl 1 23 16 35 Massa Atômica (u.m.a.) a) Sabendo que a massa de uma molécula pode ser considerada igual à soma das massas dos átomos que a compõem, complete a tabela abaixo, calculando a massa molecular de cada substância. Substân cia Fórmula Química Massa Molecular (u.m.a) Gás Hidrogê nio H2 Gás Cloro Cl2 Gás Ácido oxigênio Clorídrico O2 HCl Água H2O Hidróxid o de Sódio NaOH Cloreto de Sódio NaCl b) Considerando as leis de Lavoisier e Proust, complete as tabelas abaixo, referentes a reações completas I, II e III: Água (H2O) Gás hidrogênio (H2) Gás oxigênio (O2) 5g 9 kg Gás Hidrogênio (H2) Gás Cloro (Cl2) Ácido Clorídrico (HCl) 20g 280g Ácido Clorídrico (HCl) Hidróxido de Sódio (NaOH) Água (H2O) 98 g Cloreto de Sódio (NaCl) 18 g 90kg 2) Considere as seguintes reações químicas e a tabela de massas atômicas: I) 2H2O ---> O2 + 2H2 II) 2SO2 + O2 ---> 2SO3 III) SO3 + H2O ---> H2SO4 Elemento Químico Hidrogênio Enxofre Oxigênio Símbolo Químico H S O 1 32 16 Massa Atômica (u.m.a.) a. Sabendo que a massa de uma molécula pode ser considerada igual à soma das massas dos átomos que a compõem, complete a tabela abaixo, calculando a massa molecular de cada substância. Substânci a Fórmula Química Gás hidrogênio Dióxido de enxofre Gás oxigênio Trióxido de enxofre Água H2 SO2 O2 SO3 H2O Ácido sulfúrico H2SO4 Massa Molecular (u.m.a) b. Classifique as reações I, II e II, da forma como estão representadas, como sendo de síntese ou análise (decomposição). Justifique sua resposta. c. Considerando as leis de Lavoisier e Proust, complete as tabelas abaixo, referentes a reações completas I, II e III: Água (H2O) 4,5g 900 kg Gás hidrogênio (H2) Gás oxigênio (O2) Dióxido de enxofre (SO2) Gás oxigênio (O2) 128 g Trióxido de enxofre (SO3) 160 g 96 g Ácido sulfúrico (H2SO4) 98 g Trióxido de enxofre (SO3) Água (H2O) 18 g 9 kg 3) Podemos encontrar átomos de Hidrogênio com massas atômicas iguais a 1 u.m.a. , 2 u.m.a. (deutério) e 3 u.m.a. (trítio). Todos pertencem ao elemento hidrogênio, apesar de a variedade com massa atômica menor ser muito mais abundante que as demais. Explique como, apesar de terem massas atômicas diferentes estes átomos pertencem ao mesmo elemento químico? 4) Explique como as Leis ponderais da química podem ser usadas para defender a hipótese atômica. 5) Qual será o volume de gás oxigênio obtido quando 10 litros de gás hidrogênio forem produzidos pela decomposição da água a pressão e temperatura constantes? Justifique sua resposta. 6) Uma lata de refrigerante gelada foi colocada sobre outra lata quente. Descreva o que ocorrerá com elas após algum tempo em termos de trocas de calor e variações de temperatura. 7) Um objeto A e outro objeto B se encontram ambos isolados termicamente do resto do universo, mas não um do outro. Descreva o que ocorrerá com os corpos após algum tempo em termos de trocas de calor e variações de temperatura. 8) Ao projetarem uma sala de cinema, os engenheiros posicionaram o aparelho de ar condicionado próximo ao teto da sala. Haveria alteração na eficiência do aparelho se o mesmo fosse instalado junto ao chão? Justifique sua resposta em termos dos conceitos de termologia estudados. 9) Um vendedor de refrigerantes, em um dia quente de verão, mantinha sua caixa de isopor com gelo e refrigerante à sombra e sem tampa. À sombra, dizia ele, para que o sol não aquecesse a caixa e sem tampa, para não abafar o conteúdo. Comente o procedimento e justificativas do vendedor nos termos dos conceitos de termologia estudados. 10) Explique o fenômeno descrito na questão 2 em termos da Teoria do Calórico e da Teoria Corpuscular. Como definimos calor e temperatura em termos da estrutura minúscula da matéria segundo cada uma dessas teorias? 11) A temperatura de um gás é de 127oC. A quanto corresponde esse valor na escala absoluta? 12) Desenhe e explique os modelos atômicos de Thomson e Rutherford. 13) Apresente um fenômeno que justifique as diferenças entre os modelos atômicos de Dalton e Thomson. Por que o átomo não pode ser indivisível?
Baixar