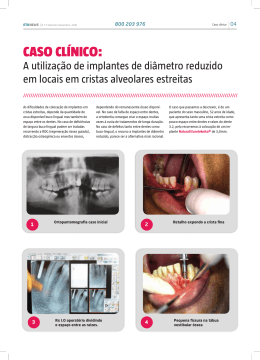
Português Componente Acetabular Cimentado DESCRIÇÃO: O Componente Acetabular Cimentado é um produto médico implantável, de concepção modular, anatômico ao osso, desenvolvido para a aplicação em artroplastia total de quadril, primária ou revisão, tendo como finalidade à substituição ou restituição da articulação coxo-femoral (quadril). O perfil externo é hemisférico, dotado de canais, sendo fixado na cavidade acetabular através do uso do Cimento Ósseo (Polimetilmetacrilato). O perfil interno, também hemisférico, tem como finalidade alojar a cabeça femoral de articulação. O Componente Acetabular Cimentado possui um anel metálico na borda externa inferior, cuja finalidade é a identificação do mesmo no exame radiográfico. O Componente Acetabular Cimentado está disponível nos seguintes modelos (tipos): Charnley, Muller e Delta conforme descritos a seguir: Componente Acetabular Cimentado tipo Charnley: O Componente Acetabular Cimentado tipo Charnley está disponível nas versões Standard e Com Flange. A versão do Componente Acetabular Cimentado tipo Charnley Com Flange possui uma aba (flange) posicionada na base do componente, que tem por objetivo promover uma melhor pressurização do Cimento Ósseo, durante o processo de implantação do mesmo. O Componente Acetabular Cimentado tipo Charnley Standard e Com Flange está disponível nas seguintes dimensões: Diâmetro Externo: 40 - 44 - 47 - 50 e 54mm. Diâmetro Interno: 22,25 - 26,0 - 28 e 32mm. Componente Acetabular Cimentado tipo Muller: O Componente Acetabular Cimentado tipo Muller está disponível nas versões Standard e Auto-Retentor. A versão do Componente Acetabular Cimentado tipo Muller Auto-Retentor possui um rebordo na base do componente, que tem como finalidade reter a cabeça femoral de articulação, sendo, portanto indicado para pacientes com musculatura flácida e alto risco de luxação da cabeça femoral. O modelo Auto-Retentor possui a desvantagem de permitir um grau de articulação menor quando comparável ao modelo Standard. O Componente Acetabular Cimentado tipo Muller Standard e Auto-Retentor está disponível nas seguintes dimensões: Diâmetro Externo: 40 - 44 - 47 - 50 e 54mm. Diâmetro Interno: 22,25 - 26,0 - 28 e 32mm. Componente Acetabular Cimentado Delta: O Componente Acetabular Cimentado Delta está disponível nas versões Displásico e Com Flange. A versão do Componente Acetabular Cimentado Delta Displásico possui uma aba posterior de 10º de inclinação para proporcionar uma melhor estabilidade da articulação coxo-femoral. A versão do Componente Acetabular Cimentado Delta Com Flange possui uma aba (flange) posicionada na base do componente, que tem como finalidade promover uma melhor pressurização do Cimento Ósseo, durante o processo de implantação do mesmo. A superfície externa do Componente Acetabular Cimentado Delta versão Displásico e Com Flange possui espaçadores de PMMA (Polimetilmetacrilato) que tem o objetivo de manter uma camada homogênea de Cimento Ósseo ao redor do implante. O Componente Acetabular Cimentado Delta Displásico e Com Flange está disponível nas seguintes dimensões: Diâmetro Externo: 40 - 42 - 44 - 46 - 48 - 50 - 52 - 54 - 56 e 58mm. Diâmetro Interno: 22,25 - 26,0 - 28 e 32mm. A matéria prima utilizada na fabricação do Componente Acetabular Cimentado modelos Charnley, Muller e Delta é o Polietileno UHMWPE ASTM F-648 ou ISO 5834-2. A matéria prima utilizada na fabricação do anel metálico da borda externa inferior do Componente Acetabular Cimentado modelos Charnley, Muller e Delta é o Aço Inoxidável Cr Ni Mo ASTM F138 ou ISO 5832-1. INDICAÇÕES: • Osteoartrite primária do quadril; • Osteoartrite pós-traumática; • Artrite reumatóide; • Doenças reumáticas que comprometam a articulação do quadril; • Seqüelas de patologias do quadril ocorridas na infância; • Necrose avascular asséptica traumática e não traumática; • Espondilite anquilosante; • Protusão acetabular idiopática ou não idiopática; • Revisão de artroplastias primárias do quadril. INSTRUÇÕES DE USO: O uso do Componente Acetabular Cimentado modelos Charnley, Muller e Delta deverá ser feito somente por cirurgiões habilitados e treinados para tal procedimento. É fundamental que seja elaborado um meticuloso planejamento pré-operatório, inclusive com o auxílio das Transparências do Componente Acetabular Cimentado nos modelos supracitados. Todos os cuidados devem ser observados na preparação da cavidade acetabular, para se obter sucesso no perfeito encaixe do Componente, evitando-se assim a presença de imperfeições que possam atrapalhar a correta cimentação do Componente. Antes de fazer a impacção definitiva do Componente Acetabular Cimentado, certifique-se que houve um correto posicionamento do mesmo. Após colocação, certifique-se que houve um perfeito encaixe e fixação mesmo. A versão do Componente Acetabular Cimentado tipo Muller Auto-Retentor requer esforço adicional no momento da redução da cabeça femoral de articulação. Certifique com absoluta certeza se o referido Componente Acetabular foi corretamente reduzido e encaixado adequadamente na cabeça femoral de articulação. Após a correta redução e encaixe, a cabeça femoral de articulação deve articular livremente, sem nenhum tipo de restrição ou risco de desacoplagem. Estão disponíveis instrumentais específicos e testes para auxiliar a implantação cirúrgica deste Componente Acetabular. É importante que o instrumental e testes utilizados sejam aqueles especificamente projetados para este sistema. Variação no projeto e dimensões de instrumentais e testes similares podem comprometer as medidas críticas requeridas para uma implantação precisa. A fim de proteger o médico e seu paciente, em eventuais problemas futuros, o hospital deve se responsabilizar pela anotação no protocolo do paciente, do código e do número do lote dos Componentes implantáveis utilizados. Esses dados são de fundamental importância para permitir a rastreabilidade dos implantes utilizados. Antes de iniciar a cirurgia certifique-se de que a coleção de implantes e o respectivo instrumental estejam íntegros e completos. NOTA: Técnica cirúrgica 9.30 e Templates 9043 disponíveis para consulta. CONTRA-INDICAÇÕES: As contra-indicações abaixo devem ser fortemente consideradas pelo cirurgião.Tais contra-indicações incluem, porém não limitam a utilização do Componente Acetabular Cimentado modelos Charnley, Muller e Delta, nos casos de: • Histórico recente de infecção sistêmica ou localizada; • Sinais de inflamação local; • Imaturidade óssea; • Osteoporose grave; • Obesidade mórbida; • Febre ou leucocitose; • Sensibilidade ou alergia ao material de implante; • Todas aquelas conhecidas para o uso de próteses cimentadas e não cimentadas; • Pacientes sem vontade ou incapazes de seguir os cuidados e as instruções do pós-operatório; • Qualquer condição médica ou cirúrgica que poderia comprometer o sucesso do procedimento; • Todo paciente deve ser alertado sobre os riscos de caminhar sem o auxílio de muleta ou bengala. CUIDADOS E PRECAUÇÕES: • Para segurança e efetividade no uso dessa prótese, o cirurgião deve estar familiarizado com os procedimentos e recomendações para o implante (veja instruções de uso). Para assegurar a implantação adequada, use apenas instrumentais e provas fabricados pela Baumer. • Em todos os casos, devem ser seguidas práticas cirúrgicas consagradas no pós-operatório. O paciente deve ser alertado sobre as limitações da reconstrução total da articulação do quadril e do histórico recente de uso dessa prática. • A correta seleção dos implantes é fundamental para o sucesso do procedimento. Por isso se torna imprescindível o planejamento pré-operatório e a utilização das Transparências. • Atividade física excessiva e traumatismos, afetando a articulação substituída, têm implicado em falha prematura da reconstrução por perda, fratura e/ou desgaste do implante. O paciente deve ser alertado para manter suas atividades de acordo com sua situação, protegendo a articulação substituída contra estresse excessivo. • Um paciente obeso ou muito pesado pode produzir sobrecarga. • O cirurgião deve estar atento quando da realização de exames de ressonância magnética, caso o paciente já possua implantes fabricados em aço inoxidável. A presença desses implantes pode distorcer os resultados do exame, prejudicando o correto diagnóstico de doenças. • O Componente Acetabular Cimentado modelos Charnley, Muller e Delta é fornecido estéril e para manter a esterilidade, o produto deverá ser aberto somente no momento da utilização e manuseado em ambientes estéreis. • Os instrumentais cirúrgicos estão sujeitos ao desgaste natural devido o uso regular dos mesmos. Instrumentais que são submetidos a uso extensivo ou força excessiva são suscetíveis a fraturas. Os instrumentais cirúrgicos devem ser utilizados somente para a função a que foram especificados ou projetados. A Baumer recomenda que todos os instrumentais sejam regularmente inspecionados quanto ao desgaste ou deformação. Atenção especial deve ser dedicada aos instrumentais de pequeno diâmetro, tais como brocas, machos e fios guias. • Uma superfície articular nunca deve ser removida e reinserida novamente durante o ato cirúrgico. Apesar de aparentemente estar intacta, pode ter sofrido alterações dimensionais que afetariam a fixação e sobrevida da mesma. • Um implante nunca deve ser reutilizado, mesmo que apresente boas condições, o estresse prévio pode ter criado imperfeições que poderão reduzir a vida útil do mesmo. POSSÍVEIS EFEITOS ADVERSOS: • Soltura, migração ou fratura dos implantes; • Soltura do Componente devido técnica inadequada de cimentação; • Infecção superficial ou profunda; • Desordens vasculares, incluindo trombose e embolia pulmonar; • Encurtamento de membro em função de reabsorção óssea; • Sensibilidade ao implante ou reação alérgica ao corpo estranho, podendo resultar em reações histológicas envolvendo vários tipos de macrófagos e fibroblastos, inclusive a possibilidade da formação de tumor e metalose; • Diminuição da densidade óssea devido à “stress shielding”; • Falha precoce ou tardia dos implantes; • Dor, desconforto ou sensações anormais em função da presença ou migração dos implantes, e também em função do procedimento cirúrgico; • Danos neurais ou neurológicos em função do trauma cirúrgico (incluindo paralisia e lesões de partes moles); • Soltura dos componentes modulares devido trauma ou impacto na zona dos implantes; • Incapacidade de executar atividades diárias normais; • Hemorragia dos vasos sanguíneos e/ou hematomas; • Escaras; • Cicatriz no local de inserção dos implantes devido à via de acesso; • Como em todas as intervenções cirúrgicas há uma incidência de enfermidade e mortalidade. O paciente deve ser alertado pelo cirurgião sobre essa incidência e de todos os riscos advindos desse tipo de cirurgia; • Alergias ou outras reações (incluindo metalose) devido a partículas ou debris metálicos e poliméricos liberados pelos implantes. EMBALAGEM: • Os Implantes desse sistema são fornecidos sob a condição “ESTÉRIL”, em duplo blister ou steribag, em uma caixa externa de papelão rígido, devidamente identificados por etiquetas adesivas, com todas as informações legais pertinentes ao produto, que garantem completa identificação e rastreabilidade dos mesmos. A embalagem deverá estar intacta no momento do recebimento (não utilize o produto caso a embalagem esteja violada). Verifique a validade da esterilização (não utilize o produto caso esteja com o prazo de esterilização vencido). O hospital deve se responsabilizar para que as etiquetas adesivas que acompanham os implantes sejam afixadas no prontuário do paciente, com a finalidade de manter a identificação e a rastreabilidade dos componentes utilizados. Antes do uso, certifique-se que a coleção de implantes esteja íntegra e completa. • Os Instrumentais desse sistema são fornecidos sob a condição “NÃO ESTÉRIL”. Para a cirurgia, os instrumentais devem ser acondicionados de forma segura e organizada, em gavetas ou bandejas especialmente projetadas para esta finalidade. Antes do uso, certifique-se que a coleção de instrumentais esteja íntegra e completa. Métodos de limpeza e descontaminação recomendados: Todos os instrumentais devem ser limpos e descontaminados antes da esterilização. Antes da esterilização, os instrumentais devem ser limpos utilizando um produto bactericida e antifungicida de largo espectro. NÃO USE agentes de limpeza agressivos, tais como ácidos minerais fortes (sulfúrico, nítrico...). NÃO USE escovas de metal, polidores ou produtos abrasivos. ESTERILIDADE: • Todos os Implantes desse sistema são fornecidos sob a condição “ESTÉRIL”. Para manter a esterilidade, o produto deverá ser aberto somente no momento da utilização e manuseado em ambientes estéreis. Antes do uso verifique a validade da esterilização. Não utilize o implante, caso a embalagem esteja violada ou com o prazo de esterilização vencido. • Todos os Instrumentais desse sistema são fornecidos sob a condição “NÃO ESTÉRIL”, devendo esses ser esterilizados antes do uso cirúrgico. Recomendamos a esterilização através de autoclavagem a vapor. Use as instruções do fabricante do equipamento de esterilização (conforme o tipo de equipamento, tipo e número de produtos utilizados) e métodos de acordo com as normas internas do hospital. Considerando que a Baumer não é conhecedora dos métodos, equipamentos, métodos de limpeza e bioburden (biocarga) utilizados pelo hospital, a Baumer não pode assumir a responsabilidade pela esterilidade dos instrumentais, ainda que as respectivas normas sejam seguidas. GARANTIA: A garantia será aplicada para os implantes e instrumentais desse sistema, desde que sejam utilizados de acordo com o estabelecido e definido nas seções acima: INDICAÇÕES, INSTRUÇÕES DE USO, CONTRAINDICAÇÕES, CUIDADOS E PRECAUÇÕES, POSSÍVEIS EFEITOS ADVERSOS, EMBALAGEM E ESTERILIDADE. Desde que sejam seguidas as recomendações da Técnica Cirúrgica do Componente Acetabular Cimentado modelos Charnley, Muller e Delta. As Técnicas Cirúrgicas estão disponíveis e devem ser solicitadas ao distribuidor Baumer autorizado. RECLAMAÇÃO: Todo cliente ou usuário desse sistema, que desejar reclamar caso não esteja satisfeito com os serviços e produtos oferecidos pela Baumer, tais como: Identificação, rastreabilidade, segurança, eficácia, performance, deverá contatar o distribuidor Baumer autorizado. Algum defeito, suspeita de defeito, ou problemas nos componentes implantados desse sistema, devem ser imediatamente reportado a Baumer ou ao distribuidor Baumer autorizado. Algum efeito adverso sério que afete a saúde ou segurança do paciente ou usuário, tal como, mau funcionamento ou prejuízo do componente, problema grave ou morte causada por ou associada ao uso desse sistema, deve ser reportado a Baumer. REMOÇÃO DO IMPLANTE: Em caso de remoção e envio dos componentes implantáveis ao fabricante para análise, este deverá ser previamente limpo e desinfectado pelo usuário (médico / hospital / enfermeiro). Portanto, o usuário deverá proceder de acordo com os métodos citados abaixo, ou qualquer outro conhecido e validado: Dispositivo Implantável / Desinfecção de Componentes ortopédicos poliméricos: Método de limpeza: Enxágüe intensamente com água, 70% a 80% de etanol aquoso ou isopropanol com tratamento ultra-sônico subseqüente ou, enzima proteolítica ou, solução 1:100 de hipoclorito de sódio. Método de desinfecção ou esterilização: Esterilização por óxido de etileno. Para envio desses componentes removidos ao fabricante, deve-se utilizar embalagens que mantenham a integridade do mesmo. Na embalagem devem constar informações sobre condições desses componentes, tais como: métodos de limpeza e desinfecção utilizados, assim como, a identificação do mesmo. Nota Importante: Para informações complementares, consulte o distribuidor autorizado Baumer ou acesse o site: www.ortopedia.ind.br Registro ANVISA: 10345500055 BAUMER S.A. FÁBRICA - Avenida Prefeito Antonio Tavares Leite, 181 - Parque da Empresa - CEP: 13.803-330 - Mogi Mirim - SP - Brasil - Indústria Brasileira - Resp. Técnico: Eng. Carlos Dal Gallo - CREA nº 064.180.680 - CNPJ: 61.374.161/ 0001-30 - Vendas - Tel:(11) 3670.0000 - Fax:(11) 3670.0053 - Email:[email protected] Baumer S.A. Vendas / Customer Service: 55 (11) 3670.0000 • Fax: 55 (11) 3670.0053 • www.baumer.com.br • e-mail: [email protected] Fábrica / Factory: Av. Prefeito Antonio Tavares Leite, 181 • Parque da Empresa • 13.803-330 • Mogi Mirim • SP • Tel: 55 (19) 3805.7655 • Fax: 55 (19) 3805.7551 • CNPJ: 61.374.161/0001-30 Resp. Téc.: Eng. Carlos Dal Gallo • CREA nº 064.180.680 203169- Rev.2007.10
Baixar