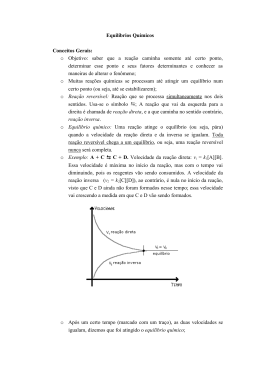
PRISE II QUÍMICA EQUILÍBRIO QUÍMICO I (Equilíbrio Químico Homogêneo) I. CONDIÇÕES DE EQUÍLIBRIO QUÍMICO - Ocorre somente em reações reversíveis ( ou - Dinâmico; - Autônomo; - Inacabado. ); II. REAÇÕES REVERSÍVEIS São aquelas onde os reagentes se transformam em produtos, e estes na medida são formados, regeneram-se voltando a tornarem reagentes. A reação que ocorre da esquerda para a direita chamase REAÇÃO DIRETA. A reação que ocorre da direita para a esquerda chamase REAÇÃO INVERSA. Ex1: N2O4(g) Reação direta Reação inversa 2 NO2(g) III. ESTADO DE EQUILÍBRIO QUÍMICO No início da reação a velocidade direta é máxima, pois temos uma maior concentração do reagente e, a velocidade da reação inversa é nula, pois não temos, ainda, um produto. À medida que a reação se processa a velocidade da reação direta diminui e da reação inversa aumenta. # I.P.C.: No Equilíbrio Químico! - A rapidez da reação direta é igual a rapidez da reação inversa; - Reagentes e produtos permanecem com concentrações constantes; - Reagentes e produtos são consumidos e formados constantemente, tornando o processo dinâmico; - As propriedades macroscópicas (cor, estado físico, cheiro,...) do sistema são constantes. IV. TIPOS DE EQUILÍBRIO QUÍMICO A) EQUILIBRIO QUÍMICO HOMOGÊNIO: são aqueles em que todos os reagentes e produtos da reação formam um sistema homogêneo, ou seja, apenas um estado físico (gasoso e líquido) Ex2: H2(g) + I2(g) 2HI(g) 2SO2(g) + O2(g) 2SO3(g) HCl(aq) H+(aq) + Cl¯(aq) B) EQUILÍBRIO QUÍMICO HETEROGÊNIO: são aqueles em que reagentes e produtos não estão no mesmo estado físico. Ex3: C(s) + O2(g) CO2(g) Fe(OH)3(s) Fe3+(aq) + 3OH¯(aq) Mg(OH)2(s) Mg2+(aq) + 2OH¯(aq) V. GRAU DO EQUÍLIBRIO QUÍMICO É o quociente entre a quantidade em mols que reagiu e a quantidade de mols total inicial. Lembrete ! = No momento em que as duas velocidades se igualam dizemos que a reação química atingiu o EQUILÍBRIO QUÍMICO e, as concentrações dos seus participantes permanecem constantes. Portanto, EQUILÍBRIO QUÍMICO é o estado em que as velocidades das reações direta e inversa são nreage ninicial n= m MM O grau de equilíbrio químico é utilizado para saber a quantidade de reagentes que reagiram para formação do produto. - próximo de 1 indica que grande quantidade de reagente reagiu; - próximo de 0 (zero) indica que poucos reagentes conseguiram reagir; Exercício1: Partindo-se de 1 mol de CO, e 1 mol de NO2, para a formação de CO2 e NO, após 40 min. Chega-se ao equilíbrio em que existem 0,20 mols de CO e 0,45 mols de NO2 sem reagir. Calcule o grau de equilíbrio para o CO e NO2 respectivamente. a) 0,8 e 0,55 d) 0,45 e 0,55 b) 0,8 e 0,45 e) 0,20 e 0,8 c) 0,8 e 0,20 Exercício2: Para a seguinte reação H2(g) + I2(g) 2HI(g) partindo de 1 mol de H2. Calcule o grau de equilíbrio em porcentagem sabendo que sobraram 0,1 mols de H 2. a) 50% d) 90% b) 70% e) 10% c) 80% iguais. 1 VI. CONSTANTE DE EQUILÍBRIO QUÍMICO Considerando a reação hipotética abaixo: aA + bB cC + dD - Sabendo que V = K [Reagentes] - No equilíbrio V1 = V2: V1 = V2 K1.[A]a.[B]b = K2.[C]c.[D]d K1 = [C]c.[D]d K2 = [A]a.[B]b Keq. = [C]c.[D]d [A]a.[B]b A constante de equilíbrio pode ser escrita em termos de concentração (chamada de Kc) e em termos de pressão (chamada de Kp, esta só para sistemas gasosos). Constante em termos de Concentração (Kc): Kc = [C]c.[D]d [A]a.[B]b Constante em termos de Pressão (Kp) para sistemas gasosos: Kp = PCc.PDd PAa.PBb Observe que Kc corresponde a uma expressão em que no numerador aparecem as concentrações dos produtos e no denominador as dos reagentes. Obs1: - O valor de KC depende da reação considerada e da temperatura, e independe das concentrações iniciais dos reagentes. - A constante de equilíbrio é tratada comum número puro, isto é, sem unidades. Líquidos (solventes) e sólidos puros, que não fazem parte de solução, não constam da expressão da constante de equilíbrio. - A expressão da constante de equilíbrio em função das suas concentrações em mol/L é também chamada de Lei da ação das massas ou Lei de Guldberg-Waage. - Com as constantes de equilíbrio podemos identificar se um sistema está em equilíbrio ou não, calcular as concentrações em mol/L dos participantes da reação. - A constante de equilíbrio da reação inversa é o inverso da constante da reação direta: Keq.(inversa) = Relação entre Kc e Kp: Kp = Kc . (R.T)n n = (c + d) – (a + b) R = Constante dos Gases (0,082 ) ⁄ T = Temperatura em Kelvin (K). Lembrete! P.V = n.R.T P = [ ].R.T TK = T°C + 273 Exercício3: (FEI-SP) Calcule a constante de equilíbrio em termos de concentração, para a reação representada pela equação química abaixo, sabendo que nas condições de temperatura e pressão em que se encontra o sistema existem as seguintes concentrações dos compostos presentes no equilíbrio: [SO3]=0,1 mol/L; [O2]=1,5 mol/L [SO2]=1,0 mol/L. 2 SO2 + O2 2 SO3 a) 0,0066 mol/L d) 0,0058 mol/L b) 0,067 mol/L e) 0,087 mol/L c) 0,0087 mol/L Exercício4: (UnB-DF) O pentacloreto de fósforo é um reagente muito importante em química Orgânica. Ele é preparado fase gasosa através da reação: PCl3(g) + Cl2(g) PCl5(g) Um frasco de 3 L contém as seguintes quantidades de equilíbrio, a 200°C 0,120 mol de PCl5; 0,600 mol de PCl3; e 0,0120 mol Cl2. Calcule o valor da constante de equilíbrio, em (mol/L)-1, a essa temperatura. a) 0,50 d) 40 b) 0,40 e) 50 c) 30 Exercício5: Temos representado no gráfico abaixo as concentrações dos reagentes e dos produtos de uma mesma reação do tipo: A+BC+D Ocorrendo no sentido à direita a partir do zero. Tem-se sempre [A] = [B] e [C] = [D], estando estes valores representados no gráfico. A constante de equilíbrio da reação será igual a: a) 16 b) c) 4 d) 5 e) Exercício6: (Faap-SP) Em um recipiente de 500mL, encontram-se, em condições de equilíbrio, 0,48g de NO2 e 2g N2O4. Calcule a constante de equilíbrio, em termos de concentração, para a reação abaixo (massas atômicas: N=14; O=16). 2 NO2 N2O4 a) 0,01 d) 0,02 b) 0,001 e) 0,002 c) 0,10 Exercício7: A constante de equilíbrio Kp para a reação N2O4(g) 2NO2(g) é igual 0,14. Numa mistura em equilíbrio, a pressão parcial do NO2 é igual a 0,7 atm. A pressão parcial do N2O4 é: a) 0,5 atm. d) 2,5 atm. b) 0,7 atm. e) 3,5 atm. c) 1,5 atm. Exercício8: No equilíbrio químico: 2 CO + O2 2CO2 Kc vale 2,24.1022, a 727°C. Qual o valor do Kp nessa temperatura? (adote R=0,082 ) ⁄ 22 a) 2,73.10 d) 5,92.1022 22 b) 2,68.10 e) 4,97.1022 22 c) 4,83.10 2 # Exercícios de confirmação do equilíbrio: Exercício10: (Mackenzie-SP) Na tabela abaixo: Exercício9(Resolvido): Em um recipiente de 2,0L foram colocados, a 448°C, 1,0.10-2mol de H2 3,0. 10-2mol de I2 e 2,0.10-2mol de HI. Considerando que naquela temperatura, a constante de equilíbrio da reação: H2(g) + I2(g) 2 HI vale Kc=50,5. Perguntamos se as quantidades mencionadas estão em equilíbrio: 1º Passo: Para sabermos se uma reação está em equilíbrio devemos calcular seu COEFICIENTE REACIONAL (QR) que é dado pelo quociente entre a concentração molar dos produtos dividido pela concentração molar dos reagentes: QR = [Produtos] [Reagentes] Portanto, como no exercício 9 foi dado as quantidades de matéria dos componentes da reação e o volume, calcula-se a concentração molar utilizando a expressão: M= n1 MH2 = V n1 MH2 = V 1,0.10-2 2 MH2 = 0,5.10-2 M MI2 = 3,0.10-2 2 MI2 = 1,5.10-2 M MHI = 2,0.10-2 2 Em seguida calcula-se o coeficiente reacional: [Produtos] [Reagentes] SISTEMA II III IV 2,9 1,2 1,0 0,54 0,3 0,4 [HI]2 [I2].[H2] (1,0.10-2)2 (1,5.10-2).(0,5.10-2) 1,0.10-4 0,75.10-2 1,333 2º Passo: Fazer a relação com a constante de equilíbrio dada, da seguinte maneira: QR = Kc o sistema está em equilíbrio. QR < Kc conclui-se que o sistema ainda não atingiu o equilíbrio, pois há mais reagentes que produtos. # Exercícios do Kc a partir de dados gerais sobre o equilíbrio: Exercício11(Resolvido): Um mol de hidrogênio e 1 mol de Iodo são misturados a 500°C. As substâncias reagem e, após certo tempo, chega-se a um equilíbrio, em que constata a presença de 0,22 mols de hidrogênio residual. Qual é a constante de equilíbrio (Kc) nessas condições? 1° Passo: Para simplificar a resolução deste e de alguns problemas que estão por vir, construiremos uma tabela de cálculo, para obter as concentrações em mol/L no equilíbrio, que serão usadas na fórmula do Kc. Essa tabela deverá conter uma coluna para cada componente da equação química (reagentes e produtos) e 4 linhas como descrita abaixo: Quantidade inicial de mols. Quantidade de mols que reagem e que são produzidos. Quantidade de mols no equilíbrio. Concentração em mol/L no equilíbrio. + I2 2 HI Mols que reagem Mols que são produzidos (essa linha obedece a equação e é obtida por cálculo estequiométrico) Para simplificar os cálculos, essa tabela será sempre preenchida em mols e obedecerá aos seguintes critérios: I. Preencha a primeira linha da tabela com os dados expressos na questão transformando-os em mols se necessário; H2 Quantidade inicial de mols. + 1 mol I2 1 mol 2 HI zero II. Para preencher a segunda linha da tabela, basta obedecer à estequiometria da própria equação química; - O problema informa que no inicio 1 mol de cada reagente e que restaram após algum tempo 0,22 mols de hidrogênio, portanto, reagiram 0,78 mols (1 mol – 0,22 mols = 0,78 mols); H2 QR > Kc conclui-se que o sistema ultrapassou o equilíbrio, pois há mais produtos e menos reagentes do que o esperado, porém essa condição não pode acontecer, pois o estado de equilíbrio químico é autônomo, portanto, teria obrigação de voltar para o estado de equilíbrio. Então: QR < Kc 1,333 < 50,5 sendo assim a reação não está em equilíbrio. V 2,4 1,2 Para a reação AB(g) 2 CD(g), constante de equilíbrio é igual a 0,4 a 100°C. Na tabela acima, constam as concentrações de AB e CD, em cinco sistemas diferentes, todos a 100°C. Dentre eles, qual o único sistema que se encontra em equilíbrio? a) I d) IV b) II e) V c) III H2 MHI = 1,0.10-2 M QR = [ ] mol/L AB CD I 0,9 0,6 Quantidade inicial de mols. Quantidade de mols que reagem e que são produzidos. + I2 2 HI 1 mol 1 mol zero 0,78 mols 0,78 mols 1,56 mols 3 III. Para preencher a terceira linha é só subtrair os valores da linha 1 pela linha 2 nos reagentes e nos produtos é só somar a linha 1 com a linha 2; H2 Quantidade inicial de mols. Quantidade de mols que reagem e que são produzidos. Quantidade de mols no equilíbrio. + I2 2 HI 1 mol 1 mol zero 0,78 mols 0,78 mols 1,56 mols 0,22 mols 0,22 mols 1,56 mols IV. A quarta linha é obtida dividindo-se os valores da terceira linha (mols no equilíbrio) pelo volume total do sistema da reação, ou seja, calcula-se usando a expressão da concentração em mols (M= ⁄ ). H2 Quantidade inicial de mols. Quantidade de mols que reagem e que são produzidos. Quantidade de mols no equilíbrio. Concentração em mol/L no equilíbrio. + I2 2 HI 1 mol 1 mol zero 0,78 mols 0,78 mols 1,56 mols 0,22 mols 0,22 mols 1,56 mols M= M= M= M = 0,22 M = 0,22 M = 1,56 mol/L mol/L Exercício14: (PUC-RS) Um equilíbrio envolvido na formação da chuva ácida está representado pela equação: 2 SO2(g) + O2(g) 2 SO3(g) Em um recipiente de 1 litro, foram misturados 6 mols de dióxido de enxofre e 5 mols de oxigênio. Depois de algum tempo o sistema atingiu o equilíbrio; o número de mols de trióxido de enxofre medido foi 4. O valor aproximado da constante de equilíbrio é: a) 0,53 d) 1,33 b) 0,66 e) 2,33 c) 0,75 # Cálculos envolvendo grau de equilíbrio (): Exercício15(Resolvido): Aqueceram-se 2 mols de PCl5 em um recipiente fechado, com capacidade de 2L. Atingindo o equilíbrio, o PCl5 estava 40% dissociado em PCl3 e Cl2. Calcule a constante de equilíbrio. 1° Passo: Montar a tabela mostrada no exemplo 15, porém usaremos o grau de equilíbrio para preenchermos a segunda linha, pois é na segunda linha que indica a quantidade de mols que reagiram, portanto: = 40% 0,40 = nreage ninicial nreage = 0,8 mols Obs2: caso o problema não forneça o volume adote o volume de 1 L. Kc = [HI]2 [H2].[I2] (1,56)2 0,22 . 0,22 PCl5 Quantidade inicial de mols. Quantidade de mols que reagem e que são produzidos. Quantidade de mols no equilíbrio. 2,43 0,04 Concentração em mol/L no equilíbrio. Exercício13: O valor do Kc para a reação em equilíbrio químico: 2 CO (g) + O2 (g) 2 CO2 (g) Utilizando os dados da tabela abaixo, é em mols/L: a) 2,22. b) 0,22. c) 3,22. d) 0,32. e) 0,44. PCl3 + Cl2 2 mol zero zero 0,8 mols 0,8 mols 0,8 mols 1,2 mols 0,8 mols 0,8 mols M= M= M= M = 0,6 M = 0,4 M = 0,4 mol/L Kc = 50,30 Exercício12: Foram colocados em um recipiente fechado, de capacidade 2,0 litros, 6,5 mols de CO e 5 mols de NO2. À temperatura de 200°C o equilíbrio foi atingido e verificou-se que haviam sido formados 3,5 mols de CO2. Podemos dizer que o valor de Kc para o equilíbrio dessa reação é: CO + NO2 CO2 + NO a) 4,23. d) 1,96. b) 3,84. e) 3,72. c) 2,72. nreage = 2 . 0,40 mol/L 2º Passo: Escrever e calcular a expressão da constante de equilíbrio com as concentrações calculadas na tabela. nreage = ninicial . mol/L mol/L 2º Passo: Escrever e calcular a expressão da constante de equilíbrio com as concentrações calculadas na tabela. Kc = [PCl3].[ Cl2] [PCl5] 0,4 . 0,4 0,6 Kc = 0,26 Obs3: Sendo dado o grau de equilíbrio é só multiplicar o grau de equilíbrio pelo número de mols iniciais para obter o número de mols que reage e assim preencher a tabela. Exercício16: Um método proposto para coletar energia solar consiste na utilização desta energia para aquecer, a 800°C, trióxido de enxofre, ocasionando a reação: 2 SO3(g) 2 SO2(g) + O2(g) Os compostos SO2(g) e O2(g), assim produzidos, são introduzidos em um trocador de calor de volume correspondente a 1,0 L e se recombinam, produzindo SO3 e liberando calor. Se 5,0 mols de SO3 sofrem 60% de 4 dissociação nesta temperatura, marque o valor correto de Kc. a) 1,1. d) 6,7. b) 1,5. e) 9,0. c) 3,4. Exercício17: Em um recipiente de 400 mL são introduzidos 2 mols de PCl5 gasoso a uma determinada temperatura. Esse gás se decompõe segundo a reação abaixo, e, o equilíbrio foi alcançado, quando 20% do pentacloreto de fósforo reagiram (% em mols). A constante de equilíbrio, Kc, nessas condições, vale: PCl5(g) PCl3(g) + Cl2(g) a) 4,0. d) 0,25. b) 1,0. e) 0,025. c) 0,5. Exercício18: (UFPR) Considere os sistemas químicos descritos a seguir: Sistema A: Uma mistura de hidrogênio, iodo e iodeto de hidrogênio é introduzida em um recipiente aquecido a 783 K. Cada um dos componentes da mistura se encontra no estado gasoso e na concentração de 2,0.10-3 mol/L. Neste sistema ocorre a seguinte reação: H2(g) + I2(g) 2 HI(g) cuja a constante de equilíbrio é igual a 46. Sistema B: Uma mistura de N2(g), O2(g) e NO(g) é introduzida num recipiente a 800 K. A concentração de cada um de seus componentes é igual a 2,0.10-3 mol/L. Neste sistema ocorre a seguinte reação: N2(g) + O2(g) 2 NO(g) cuja a constante de equilíbrio é igual a 3,4.10-21. Sobre os sistemas A e B é correto afirmar? I. As constantes de equilíbrio indicam que a velocidade da reação do sistema A é maior que a velocidade no sistema B; II. Quando o sistema A atinge o estado de equilíbrio químico, predomina o composto HI; III. Quando o sistema B atinge o estado de equilíbrio químico, predomina o composto NO; IV. No sistema A ocorre o consumo de gás hidrogênio até que o estado de equilíbrio seja atingido; V. No sistema B, a concentração do gás nitrogênio aumenta até que o estado de equilíbrio seja atingido; VI. No sistema B, após o equilíbrio ser atingido, a concentração de oxigênio é igual a concentração de nitrogênio. Estão corretas, a) I, II, IV e VI. d) II, V e VI. b) II, III, IV e V. e) II, IV e VI. c) II, III e IV. # Cálculos das quantidades dos componentes em equilíbrio a partir do valor do Kc: Obs4: em muitos problemas desse tipo, a resolução nos leva a equações matemáticas de 2º grau. Lembramos então a equação genérica do 2º grau: ax2 + bx + c = 0 E para a resolução de equações desse tipo, temos a seguinte fórmula geral: – √ Exercício19(Resolvido): Na esterificação de 1 mol de ácido acético com 1 mol de álcool etílico é atingido com o Kc = 4. Quais são as quantidades em mols das substâncias presente no equilíbrio? 1º Passo: Neste exercício é dado o valor de Kc, pedindose agora as quantidades de matéria das substâncias, ou seja, os valores da terceira linha da tabela explicada no exercício 11. Portanto, a tabela deve ser preenchida de acordo com as explicações anteriores, usando-se, porém, valores incógnitos (x, y, n,...). CH3COOH + C2H5OH CH3COOC2H5 + H2O Quantidade inicial de mols. Quantidade de mols que reagem e que são produzidos. Quantidade de mols no equilíbrio. Concentração em mol/L no equilíbrio. 1 mol 1 mol zero zero x x x x 1-x 1-x x x - M= M= - M= M= Note que na segunda linha é usado a incógnita x pois, não temos o mol que reage e nem o grau de equilíbrio, por isto que se escreve de maneira literal. 2º Passo: Escreva a equação da constante de equilíbrio e substituir os valores dados no problema e encontrados na tabela; Kc = 4= 4= 4= [CH3COOC2H5].[H2O] [CH3COOH].[C2H5OH x.x (1 – x).(1 – x) x2 (1 – x)2 x2 (12 – 2.1.x + x2) (1 – 2x + x2).4 = x2 4 – 8x + 4x2 = x2 4x2 – x2 – 8x + 4 = 0 3x2 – 8x + 4 = 0 (Eq. do 2º grau) 3º Passo: Sendo uma equação do 2º grau em x. Resolvendo-a, chegaremos aos valores de duas raízes: √ – √ – – √ 84 x= 6 ’ ’’ – 5 An l s n o s íz s ob s, o p m o sul o x’) é absurdo, pois no início tínhamos apenas 1 mol de CH3COOH e 1 mol de C2H5OH, portanto é impossível reagirem 2 mols se só tínhamos 1 mol no início. Consequentemente só poderemos aceitar a segunda raiz x’’ 0,666 mols 4º Passo: Calcular os valores referentes a terceira linha (quantidade de mols no equilíbrio) utilizando 0,666 como valor de x. Quantidade de mols no equilíbrio. CH3COOH C2H5OH CH3COOC2H5 H2O 1 – 0,666 = 0,334 mols 1 – 0,666 = 0,334 mols 0,666 mols 0,666 mols Exercício20: (Fuvest-SP) Um recipiente fechado de 1 litro contendo inicialmente, à temperatura ambiente, 1 mol de I2 e 1 mol de H2 é aquecido a 300°C. Com isso estabelecese o equilíbrio H2(g) + I2(g) 2 HI(g) Cuja constante é igual a 1,0.102. Qual a concentração, em mol/L, de cada uma das espécies H2(g), I2(g) e HI(g), nessas condições? a) 0, 0, 2 d) ⁄ , ⁄ , ⁄ b) 1, 1, 10 e) ⁄ , ⁄ , As concentrações das substâncias presentes equilíbrio; A pressão do sistema em equilíbrios gasosos; A temperatura. no A) EFEITO DA CONCENTRAÇÃO O aumento da concentração de uma substância desloca o equilíbrio químico no sentido oposto, ou seja, na reação direta a adição de reagentes ou a retirada de produtos deslocará o equilíbrio para a direita. A diminuição da concentração de uma substância desloca o equilíbrio químico no mesmo sentido, ou seja, na reação direta a adição de produto ou a retirada de reagentes deslocará o equilíbrio para a esquerda. Ex3: Considere a reação: H2 + I2 2HI Se adicionarmos I2, a reação deslocará para a direita, aumentando a concentração de HI. ⁄ c) ⁄ , ⁄ , ⁄ Exercício21: Considere um equilíbrio a 25°C: PCl5(g) PCl3(g) + Cl2(g) Conhecendo as concentrações iniciais [PCl 5] = 0,100 mol/L; [PCl3] = 0 mol/L e [Cl2] = 0,020 mol/L e a constante de equilíbrio (Kc = 0,030 mol/L) para a decomposição de PCl5 à mesma temperatura, a concentração de PCl3 no equilíbrio é igual a: a) 0,035 d) 0,120 b) 0,050 e) 0,230 c) 0,065 Exercício22: Em um recipiente fechado e mantido a temperatura constante goram introduzidos o monóxido de carbono e vapor de água em quantidades tais que suas pressões parciais eram iguais e valiam 0,856 atm cada uma. Após certo tempo, estabeleceu-se o equilíbrio: CO(g) + H2O(g) CO2(g) + H2(g). Medindo-se então a pressão parcial de CO, obteve-se 0,580 atm. Qual o valor da constante de equilíbrio Kp? a) 0,226 d) 0,792 b) 0,445 e) 0,931 c) 0,653 VII. DESLOCAMENTO DE EQUILÍBRIO QUÍMICO # I.P.C: PRINCÍPIO DE LE CHATELIER Quando um agente externo age sobre um sistema em equilíbrio, o sistema desloca-se no sentido de anular a referida ação, atingindo um novo estado de equilíbrio químico (restauração espontânea do equilíbrio químico). Os únicos fatores que podem provocar deslocamento de equilíbrio químico são: No entanto, se adicionarmos HI, a reação deslocará para a esquerda. B) EFEITO DA PRESSÃO EM EQUILÍBRIOS GASOSOS O aumento da pressão total de um sistema desloca o equilíbrio no sentido de menor volume gasoso, pois a redução do volume minimiza o efeito da pressão aplicada. A redução da pressão total de um sistema desloca o equilíbrio no sentido de maior volume gasoso, pois o aumento do volume minimiza a redução da pressão. Ex4: Considere a reação abaixo: N2 + 3 H2 1 mol + 3 mol 4 mols de volume 2 NH3 2 mol 2 mols de volume Aumentando a pressão total desloca o equilíbrio para o lado de menor volume (menor quantidade total de mols). Reduzindo a pressão total desloca o equilíbrio para o lado de maior volume (maior quantidade total de mols). 6 C) EFEITO DA TEMPERATURA Para observarmos o efeito da temperatura nos equilíbrios, devemos verificar se a reação é exotérmica ou endotérmica. Ex5: Exo. N2(g) + O2(g) 2 NO(g) H = – 88 kJ Endo. O aumento da temperatura desloca o equilíbrio no sentido endotérmico (esquerda). A diminuição da temperatura desloca o equilíbrio no sentido exotérmico (direita). # I.P.C: A constante de equilíbrio químico varia com te per tur p i é regid pe ei d “r pidez” das reações químicas. # RESUMINDO: PERTURBAÇÃO DESLOCAMENTO Kc e Kp [ ] componente No sentido oposto Não Sim [ ] componente No mesmo sentido Não Sim Pressão total No sentido de volume Não Sim Pressão total No sentido de volume Não Sim Temperatura No sentido endotérmico Sim Sim Temperatura No sentido exotérmico Sim Sim Adição do Catalisador Não Não Não Exercício23: O metanol, apesar de tóxico, é muito importante em laboratórios, indústrias e também como combustível. Pode ser sintetizado a partir de monóxido de carbono e gás hidrogênio através da reação de equação: CO(g) + 2H2(g) CH3OH(g) ∆H < O rendimento na produção de álcool é favorecido: a) a baixas pressões b) a altas temperaturas c) pelo aumento da concentração de H2 d) pela adição de catalisador e) pela diminuição da concentração de CO Exercício24: Uma das condições que desloca o equilíbrio químico: 2SO3(g) 2SO2(g) + O2(g) ∆H>O para a direita é: a) aumento da temperatura ou adição de catalisador. b) aumento da temperatura ou remoção de SO3(g). c) adição de O2(g) ou aumento da pressão. d) adição de catalisador ou adição de SO2(g). e) remoção de SO2(g) ou diminuição da pressão. Exercício25: O equilíbrio N2(g) + 3 H2(g) 2 NH3(g) é deslocado para os produtos com o aumento da pressão e com a diminuição da temperatura. Pode-se concluir que a reação de formação do gás amoníaco é: a) Exotérmica e ocorre com o aumento de volume. b) Exotérmica e ocorre com a conservação do volume. c) Exotérmica e ocorre com a diminuição do volume. d) Endotérmica e ocorre com aumento de volume. e) Endotérmica e ocorre com diminuição de volume. Exercício26: Na química ambiental, particularmente no controle da ocorrência da chuva ácida, têm particular importância as reações entre os gases dióxido de enxofre e oxigênio para originar o trióxido de enxofre, o qual, combinando-se com água, forma o ácido sulfúrico, segundo as reações assim equacionadas: A) 2 SO2(g) + O2(g) 2 SO3(g) + 46 kcal B) SO3(g) + H2O(l) → H2SO4(aq) Observe com atenção os fatores a seguir. I. injeção de O2 II. elevação da temperatura III. redução da temperatura IV. redução da pressão V. elevação da pressão Ao se processarem as reações representadas em um recipiente fechado, assinale a opção cujos fatores, atuando sobre a reação A, tendem a aumentar a produção de ácido sulfúrico na reação B: a) I e II apenas d) I, III e V b) I e III apenas e) II, IV e V c) II e IV apenas Exercício27: É muito comum as donas-de-casa, após a limpeza do peixe, usarem limão para remover o cheiro deixado em suas mãos. A maioria delas não tem uma explicação científica para o fato. Entretanto, sabe-se que o cheiro é causado pelo composto metilamina, de fórmula CH3–NH2, cuja equação de equilíbrio é representada a seguir: CH3-NH2(aq) + H2O(L) CH3-NH3+(aq) + OH–(aq) Segundo o princípio de Le Chatelier, o cheiro desaparece porque: a) A adição do limão (H+) neutraliza íons OH¯ deslocando o equilíbrio para a direita, consumindo a metilamina. b) A adição do limão (H+) neutraliza o íon OH¯, deslocando o equilíbrio para a direita, consumindo o CH3–NH3+. c) A adição do limão (H+) neutraliza o íon, deslocando o equilíbrio para a esquerda, formando solução aquosa. d) A adição do limão (H+) neutraliza o íon OH¯, deslocando o equilíbrio para a esquerda, retirando a metilamina. e) A adição do limão (H+) neutraliza o íon OH¯, deslocando o equilíbrio para a esquerda, diminuindo a concentração de H2O. Exercício28: Os refrigerantes são conhecidos como bebidas carbonatadas, em que ocorre o equilíbrio: H2CO3(aq) H2O + CO2(g) Com garrafa fechada, o equilíbrio de reação é mantido pela pressão de CO2 gasoso no interior da garrafa. Após a abertura da garrafa, ocorre perda de CO2 (deslocamento de equilíbrio), alterando o sabor do refrigerante. Qual a maneira mais eficiente de deslocar o equilíbrio da reação em sentido contrário, reduzindo o desprendimento do gás? a) Utilizar uma tampa que injeta ar no interior da garrafa. b) Deformar o recipiente para reduzir o volume ocupado pelo gás. c) Substituir a tampa da garrafa por colher e mantê-la na geladeira. d) Guardar a garrafa deitada. e) Introduzir pequenos cristais de gelo no interior da garrafa. 7
Download