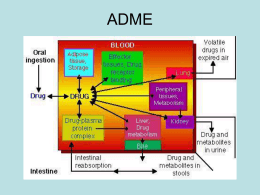
LIPOSSOMAS: PREPARAÇÃO E CARACTERIZAÇÃO FosfolipÍdeos Grupos de cabeça polar Glicerol de 3 carbonos O Que é um lipossoma? – Vesícula esférica com uma bicamada fosfolipídica Hidrofilico Hidrofobico Membrana celular Usos de Lipossomas Terapia de quelação para tratamento de envenenamento com metais pesados Substituição de enzimas Imagens para diagnostico de tumores Cosmeticos Estudos de membranas Liberação de fármacos Por que usar lipossomas em liberação de fármacos? Farmacos de alvos dirigidos Inativo: Lipossomas não modificados junto a sistemas de tecidos específicos do sistema reticuloendotelial Ativo: Lipossoma com alteração da superfície com ligantes (anticorpos, enzimas, proteína A, açucares) Físicos: temperatura ou lipossomas sensíveis a pH Dirigidos ao sitio da ação Por que usar lipossomas em liberação de fármacos? Farmocinética-eficacia e toxicidade Mudanças na biodistribuição Liberar o fármaco na forma desejada Resistência multifarmacos Proteção Diminui os efeitos colaterais Mudanças onde o fármaco é acumulado no corpo Protege o fármaco Por que usar lipossomas em liberação de fármacos? Liberação Afeta o tempo no qual o fármaco é liberado Tempo prolongado-aumenta a duração da ação e diminui a administração Depende do fármaco e das propriedades do lipossoma Composição do lipossoma, pH e gradiente osmótico e do ambiente Modos de interação de Lipossomas/Células Adsorção Endocitose Fusão Transferência de lipídeos Classes de Lipossomas Convencional Circulação extendida Imuno Catiônico APLICAÇÕES Formulação de Ajuda Liberação de Drogas Intracelular Liberação Sustentada e Controlada de Drogas Terapia Genética Liberação em locais à serem evitados Sítio Alvo Específico APLICAÇÕES Formulação de Ajuda Drogas hidrofóbicas tais como Ciclosporina e Paclitaxel, são formuladas em surfactantes e co-solventes orgânicos para administração sistêmica em humanos.Estes solventes podem causar toxicidde na dose necessária para liberar o fármaco. APLICAÇÕES Liberação de Drogas Intracelular –Drogas com receptores e alvo intracelular são necessários para a atividade farmacológica. –A liberação de drogas que entram normalmente nas células por “pinocitose” podem ser muito efetivas (Sharma,1994) porque os lipossomas podem conter grandes concentrações da droga se comparado com o fluido extracelular. APLICAÇÕES Liberação Sustentada e Controlada de Drogas Os sistemas de controle e sustentação são necessários para drogas tais como Citosina Arabinoside ( Ara-C) que são removidos in vivo e necessitam de concentração de plasma como nível terapêutico para um efeito de período prolongado APLICAÇÕES Terapia Genética –Falta de enzimas/fatores ou defeitos genéticos. Liberação em locais à serem evitados –Drogas usadas no tratamento de doenças como o câncer, usualmente tem um índice terapêutico (TI) e pode SER altamente tóxico para os tecidos normais.Tem sido mostrado que a encapsulação dessas drogas em lipossomas , reduz significativamente a toxicidade da droga.(Szoka, 1991) APLICAÇÕES Local alvo específico –O primeiro conceito proposto por Paul Ehrlich(1960) na liberação da droga no local específico, envolveu a liberação de uma grande fração de drogas no sítio alvo, o que reduziu a exposição do tecido normal. –Esta liberação pode ser realizada por meio Ativo e Passivo LIMITAÇÕES –Questão da estabilidade: podem ser vencidos por liofilização - Criopectante e é reconstituído com veículo imediatamente antes da administração. A liofilização aumenta o tempo de prateleira do produto. –Método de esterilização: filtração através da membrana estéril 0,22 µm. Entretanto não é adequada para vesículas grandes e também não é capaz de remover vírus. * autoclave sem perda da substância e/ou degradação dos fosfolipídeos. LIMITAÇÕES –Controle do tamanho da partícula –Produção de grandes grupos –Vesículas circulantes com meia pequena vida PREPARAÇÃOES DE FARMACOS LIPOSSOMAIS Tipo de agente Anticancer ígeno Anti bacterial Antiviral Material DNA Enzimas Radionucleoideos Fungicidas Vacinas Exemplos Duanorubicin, Doxorubicin*, Epirubicin Methotrexate, Cisplatin*, Cytarabin Triclosan, Clindamycin hydrochloride, Ampicillin, peperacillin, rifamicin AZT cDNA - CFTR* Hexosaminidase A Glucocerebrosidase, Peroxidase In-111*, Tc-99m Amphotericin B* Malaria merozoite, Malaria sporozoite Hepatitis B antigen, Rabies virus glycoprotein *Atualmente em Ensaios Clinicos ou Aprovados para uso Clínico Reguladores de conductãncia transmebrana de fibrosis cistica Terapia gênica Liveração de cDNA de “Cystic Fibrosis Transmembrane Conductance Regulator (CFTR)” para tecidos epitelial do sistema respiratorio Lipossomas cationicos Fusão a membrana celular e incorpora cDNA na célula (Complementary DNA (cDNA) is a doublestranded DNA version of an mRNA molecule) Agora tratando virus adeno associados Doxil Quimioterapia da doxorubina Anemia, danos as veias e tecidos na ejeção, diminui plaquetas e leucócitos, tóxico ao Trata lesões de sarcoma de Kaposi ou tumores cancerosos Modificação de lipossomas furtidos(“stealth”) permite doxorubina no sangue por 50 h em vez de 20 minutos concentrasse nas lesões KS e tumores *Aprovado pela FDA em 1999* Amphotericin B Infecções sistêmicas fúngicas em pacientes imuno comprometidos AmB – mata células fúngicas contendo ergosterol, também mata células humanas contendo colesterol Efeitos colaterais: Nefrotoxicidade, calafrios e febre Fungizone - AmB com deoxicolato Formulação Lipossomal de AmB Razão Fosfolipideo:AmB AmB Colesterol – somente poucos %moles Lipid Mecanismo exato de lipossomas ainda não totalmente entendido Difusão Transferência de lipídeos Diminui a toxicidade Não diminui a efetividade do fármaco contra o fungo LIPOSSOMAS: PROPRIEDADES E APLICAÇÕES Exemplos de lipideos formadores de bicamadas Exemplos de lipídeos formadores de bicamadas Fosfolipídeos naturais (fosfatidilcolina, lecitina). Fosfolipídeos sintéticos (diesteraoilfosfatidilcolina). Colesterol Composição e propriedades fisico-químicas Capacidade de encapasulação de ativos Substâncias farmacologicamente ativas podem ser incorporadas seja no compartimento aquoso interno (substâncias hidrossolúveis), seja nas membranas dos lipossomas (substâncias lipofílicas ou anfifílicas). A taxa de encapsulação de uma substância em lipossomas e a relação substância encapsulada/lipídeo são dois parâmetros importantes que devem ser considerados na escolha do método de preparação, sobretudo quando se procura desenvolver uma composição farmacêutica. Esses parâmetros podem ser otimizados através da escolha do método de encapsulação e da manipulação da composição lipídica da membrana. A taxa de encapsulação deverá ser maximizada, pois é inversamente relacionada à quantidade de substância não encapsulada que é perdida na maioria das vezes. A relação fármaco/lipídeo deverá também ser maximizada, visto que determina a quantidade de lipídeo a ser administrada ao paciente. Assim, quanto menor for a quantidade de lipídeo veiculada, menor serão os riscos de efeitos colaterais associados aos mesmos. Teoricamente, taxas de encapsulação próximas de 100% podem ser obtidas com substâncias lipofílicas incorporadas na membrana dos lipossomas. É o caso da anfotericina B que, no produto farmacêutico AmBisome, é associada a lipossomas pequenos (4580 nm de diâmetro) formados de fosfatidilcolina hidrogenada, colesterol e de diestearoil-fosfatidilglicerol (relação molar 2:1:0,8 e relação fármaco/lipídeo = 1/10). Vale ressaltar que a capacidade de substâncias lipofílicas serem incorporadas na membrana de lipossomas não é uma regra geral; no processo de encapsulação, deve ser verificado se a substância está efetivamente incorporada na membrana e não simplesmente adsorvida na sua superfície ou autoassociada na forma de microcristais em suspensão com os lipossomas. No caso das substâncias hidrossolúveis, como os antimoniais pentavalentes, é teoricamente impossível atingir níveis de encapsulação de 100%, por causa da necessária co-existência dos compartimentos aquosos interno e externo. ARMAZENAMENTO O armazenamento na forma de suspensão aquosa é incompatível com a estabilidade para produtos farmacêuticos. O armazenamento na forma liofilizada representa uma alternativa viável, entretanto deve ser incluído um agente crioprotetor para evitar a fusão das membranas desidratadas e evitar a liberação do ativo no momento da reidratação. Administração em organismos vivos Quando administrado em organismos vivos os lipossomas interagem com os componentes dos fluidos biológicos o que pode alterar a permeabilidade de sua membrana e a velocidade de liberação do ativo encapsulado. Oral: Sais biliares são incorporadas na membrana-transiçào laminar a micelar As membranas em fase cristal-liquido serão desestabilizadas. So em fase gel resistem parcialmente Endovenosa: Lipoproteinas plasmáticas. So se tem colesterol 30% serão estaveis Interação lipossomas/células: Influencia na biodisponibilidade da substancia encapsulada Enquanto a liberação do ativo em condições de armazenamento é passiva e espontânea, sua liberação in vivo a partir de lipossomas estáveis será mediada essencialmente por células com atividade endocitária. Logo, a manipulação das características de superfície representa um dos meios para controlar sua interação com as células e a velocidade de liberação do ativo nos organismos vivos Lipossomas convencionais: fosfatidilcolina ou de surfactantes não iônicos e de colesterol Aspectos tecnológicos dos antimoniais taxas maiores: fosofolipideos de alta temperatura de transição de fase (dipalmitoilfosfatidilcolina) de colesterol e de fosfolipideo negativos Reverse phase evaporation vesicles Dehydration rehydration vesicles LIPOSSOMAS PRODUÇÃO REFERÊNCIAS Journals Allen, Theresa M. "Liposomal Drug Formulations: Rationale for Development and What We Can Expect for the Future." Drugs 56: 747-756, 1998. Allen, Theresa M. "Long-circulating (sterically stabilized) liposomes for targeted drug delivery." TiPs 15: 214-219, 1994. Allen, Theresa M. "Opportunities in Drug Delivery." Drugs 54 Suppl. 4: 8-14, 1997 Janknegt, Robert. "Liposomal and Lipid Formulations of Amphotericin B." Clinical Pharmacokinetics. 23(4): 279-291, 1992. Kim, Anna et al. "Pharmacodynamics of insulin in polyethylene glycol-coated liposomes." International Journal of Pharmaceutics. 180: 75-81, 1999. Quilitz, Rod. "Oncology Pharmacotherapy: The Use of Lipid Formulations of Amphotericin B in Cancer Patients." Cancer Control.5:439-449, 1998. Ranade, Vasant V. "Drug Delivery Systems: Site-Specific Drug Delivery Using Liposomes as Carriers.“ Pharmacology. 29: 685-694, 1989. Storm, Gert and Daan J.A. Crommelin. "Liposomes:quo vadi?" PSTT 1: 19-31, 1998. Taylor, KMG and JM Newton. "Liposomes as a vecicle for drug delivery." British Journal of Hospital Medicine. 51: 55-59, 1994 REFERENCIAS Websites James, John S. "Doxil Approved for KS." www.immunet. org.imminet/atn.nsf/page/a-235-03. Wasan, Ellen. "Targeted Gene Transfer." Member.tripod.com/~rrishna/lipos1.html "Introduction to Controlled Drug Delivery Systems." www5.bae.ncsu.edu/bae/reearch/blak… k/otherprojects/drugDeliver_97/ http://www. Mssm.edu/medicine/thrombosis/phosphol.html "Doxorubicin." http://tirgan.com/adria.htm "Clinical Pharmacology Online." http://www.cponline.gsm.com/scripts/fullmono/showmono. "Drugstore.com" http://www.drugstore.com/pharmacy/prices/Amphotec. "Sequus' Doxil Becomes First Liposome Product Approved In U.S." www.slip.net/~mcdavis/ database/doxor_1 "Liposomes." www.collabo.com/liposom0.htm Paustin, Timothy. “Cellular Membranes.”www.bact.wisc.edu/microtextbook/bacterialstructure/Membranegen. html www.cbc.umn.edu/~mwd/cell_www/chapter2/membrane.html#PHOSPHOLIPIDS
Baixar