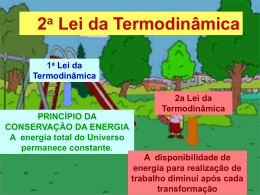
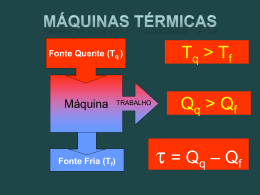
LOQ - 4007 Físico-Química Capítulo 4: A Segunda Lei: Conceitos Atkins & de Paula (sétima edição) Profa. Dra. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia – LOT E-mail: [email protected] ou [email protected] Fone: 3159-5027 Cap 4–A Segunda Lei: Conceitos • 1. O sentido da mudança espontânea – 4.1. A dispersão da energia – 4.2. Entropia – 4.3.Variação de entropia em alguns processos – 4.4. A terceira lei da termodinâmica Próximas aulas 2. Funções do sistema – 4.5. As energia de Helmholtz e de Gibbs – 4.6. Energia de Gibbs molar padrão LISTA DE EXERCÍCIOS capítulo 4 – Atkins (sétima edição) Cap. 4 - A Segunda Lei - Conceitos Conceitos importantes: abordagem • • • • • • • • • • • • • Transformação espontânea Segunda lei da termodinâmica O sentido da mudança espontânea Dispersão de energia Entropia Ciclo de carnot Eficiência de uma máquina térmica Desigualdade de Clausius Temperatura de transição normal, Ttrs Regra de Trouton Extrapolação de Debye Teorema do calor de Nernst Terceira lei da termodinâmica Entropias da terceira lei Entropia padrão (da terceira lei) Entropia padrão de reação Energia de Helmholtz Energia de Gibbs Energia de Gibbs molar padrão Energia de Gibbs padrão da reação Energia de Gibbs padrão de formação Primeira Lei vs. Segunda Lei Primeira lei da Termodinâmica: A energia do universo é constante – conserva-se a energia • Esta lei não nos diz nada sobre a espontaneidade das transformações fisícas e químicas Considere a formação da água: Usando a primeira lei, é fácil calcular ∆U e ∆H associados com esta reação espontânea – podemos também calcular ∆U e ∆ H para a reação reversa, a qual sabemos que não ocorre espontanteamente (agradecidamente!!) E sobre gases? Nós sabemos que os gases se expandem espontaneamente para encher um recipiente - sabemos que o contrário não acontece - a menos que algum tipo de trabalho é feito para provocar essa mudança inversa. Nem sinal, nem a magnitude de ∆U e ∆H nos diz qual caminho ocorrerá a reação - no entanto, podemos obter essa informação a partir da Segunda Lei da Termodinâmica Primeira Lei vs. Segunda Lei A primeira lei não nos dá nenhuma pista dos processos que ocorrerão ou não. Nesse sentido, por que todos não acontecem? O universo é um sistema isolado. Não há variação da energia interna. Não há calor transferido dentro ou para fora e nenhum trabalho é feito sobre ou pelo sistema como um todo. Sem a primeira lei, e sem a segunda lei O universo é um lugar chato Sim, O universo é um lugar chato : # Estrelas nascem e explodem no esquecimento # Planetas são criados e atirados ao redor de estrelas # A vida evolui em meio a toda essa turbulência nesses planetas Por quê? O que está levando tudo isso? Estes processos não levam a uma diminuição de energia no universo como um todo. Então, o que está acontecendo? Afirmativas da Segunda Lei Elementos em um sistema fechado tendem a procurar a sua distribuição mais provável, em um sistema fechado a entropia sempre aumenta. 1. Clausius (1822-1888) É impossível que, no final de um ciclo de mudanças, o calor ser transferido de um corpo mais frio para um corpo mais quente, sem ao mesmo tempo, converter uma certa quantidade de trabalho em calor. 2. Lord Kelvin (1824-1907) Em um processo (ciclo), é impossível transferir calor de um reservatório quente e convertê-lo todo em trabalho, sem, ao mesmo tempo transferir uma certa quantidade de calor do corpo mais quente para o corpo mais frio. 3. Ludwig Boltzmann (1844-1906) Para um sistema fechado adiabaticamente, a entropia nunca pode diminuir. Portanto, um alto nível de organização é muito improvável. 4. Max Planck (1858-1947) A máquina de movimento perpétuo do segundo tipo é impossível. 5. Caratheodory (1885-1955) Arbitrariamente perto de um determinado estado existem estados que não podem ser alcançados por meio de processos adiabáticos. A Segunda lei da Termodinâmica* A segunda lei da termodinâmica possui diversos enunciados equivalente; um deles foi formulado por Lord Kelvin e diz: :Não é possível um processo que tenha como único resultado a absorção de calor de um reservatório térmico e a sua completa conversão em trabalho Toda máquina térmica tem uma fonte quente e um sumidouro frio, em que um pouco do calor é sempre rejeitado e não convertido em trabalho O motor do lado esquerdo viola a segunda lei isso é equivalente a uma bola inicialmente em repouso sobre uma superfície aquecida começando a saltar (ou seja, o calor absorvido pela superfície é convertido em trabalho ordeiro) - isto não tem sido observado O que determina como os processos físicos e químicos procedem espontaneamente? Energia? Tendência para a energia mínima? Não é nenhum desses, como veremos *simpsons ... Processos Simples Processo 1: Cumprimento da Primeira Lei # Uma bola perfeitamente elástica no vácuo caí de uma certa altura com uma energia potencial. # Quando ela atinge o solo, toda energia é convertida em energia cinética # A bola pula de volta para a altura original, onde toda energia cinética é convertida novamente na energia potencial inicial. Processo 2: Porquê o ovo não pula? # Um ovo cai da mesma altura da bola #Os estados inicial e final não são os mesmos – parece que ocorreu perda de energia # Primeira lei: Energia não se perde – Então onde ela foi? - Foi convertida em movimento molecular aleatório e calor - Temos assim uma forma mais desorganizada da matéria O universo tende a estados mais aleatórios e desorganizados Dispersão de energia* Transformações espontâneas são acompanhadas pela dispersão de energia a uma forma mais desordenada. Bola quicando: # O sentido da mudança espontânea para uma bola que quica sobre uma superfície. Em cada pulo da bola, parte da energia cinética do movimento é degradada em movimento térmico dos átomos da superfície e há dispersão da energia. Em escala macroscópica, o processo inverso não é nunca observado. A interpretação molecular da irreversibilidade expressa pela segunda lei. a) Uma bola em repouso sobre uma superfície quente, os átomos tem movimento térmico (vibrações caóticas, neste caso) como mostra as setas. b) Para que a bola suba no ar, parte do movimento caótico de vibração teria que se transformar em movimento organizado, dirigido. Esta conversão é muito pouco provável**. *happy **Paradoxo de Boltzmann: poderia acontecer! Ironia da Segunda Lei: Entropia O universo caminha para estados mais aleatórios e desorganizados. Esta é uma declaração bastante geral da segunda lei da termodinâmica e a nossa forma de quantificação da desordem e movimento aleatório em um estado contra outro é uma função de estado chamada entropia: Aumento na entropia significa crescente desordem e movimento aleatório. Ponto de vista melodramático: Cada estrela que queima, todos os planetas cuja órbita está lentamente se deteriorando, Cada respiração que você dá e calorias que você metaboliza traz o universo cada vez mais perto do momento em que a entropia é maximizada, movimento organizado de qualquer tipo cessa, e nada acontece novamente. Não há como escapar. Não importa o quão magnífica e avançada a vida no universo se torna o aumento lento da entropia não pode ser interrompido - o universo acabará por morrer. Ironia da Segunda lei: Sem a segunda lei, nada jamais iria acontecer. Com ela, o universo está condenado. Darn. Pensamentos Gerais sobre a Segunda Lei Orientação para transformação espontânea: Direção da mudança que leva à dispersão caótica geral da energia total de um sistema isolado # A bola pula e repousa # O gás se expande espontaneamente, mas não se contrai espontaneamente # Objetos não se tornam aquecidos mais do que suas vizinhanças por nenhuma razão- movimentos aleatórios dos átomos não levará a um excesso de movimento térmico (vibração aleatória de átomos de repente não vai levar a um excesso de movimento térmico (e, portanto, de aquecimento) - no entanto, o objeto faz espontaneamente liberação de energia para o ambiente como movimento térmico (conseqüência do caos ...) Pensamento Intrigante : A queda na desordem pode resultar em substâncias altamente organizadas, tais como cristais, proteínas, vida! Etc.. Estruturas organizadas e padrões podem emergir como energia e matéria dispersa (ou seja, a entropia aumenta) O sentido da vida: aumentar a entropia do universo Espontaneidade e Reversibilidade Espontâneo: Tem pouco a ver com um gesto improvisado, um provérbio espirituoso ou compras impulsivas. Isso significa um processo que resulta em uma mudança de um estado para outro de forma irreversível. Tudo o que acontece no universo que resulta em uma mudança irreversível no estado é espontâneo. Transformação Reversível (Não Espontânea): Processos verdadeiramente reversíveis não acontecem na realidade, porque em um processo verdadeiramente reversível todas as forças seriam perfeitamente equilibradas e não haveria força motriz para o sistema se mover. Pelo movimento das coisas de forma muita lenta mantemos sempre as forças próximas ao perfeito equilíbrio, e podemos aproximar processos reversíveis em qualquer grau que nós quisermos. Por exemplo, durante expansão reversível de um gás, podemos manter as pressões essencialmente as mesmas no interior e no exterior - se isso fosse rigorosamente verdade, o gás não teria qualquer força motriz para expandir e nada iria acontecer. No entanto, podemos torná-lo tão perto da verdade desejada, fazendo o desequilíbrio tão pequeno como nós quisermos. Transformação Irreversível (Espontâneo): Todos os processos que realmente acontecem são irreversíveis; a força motriz do processo estão substancialmente fora de equilíbrio Segunda Lei e Entropia A lei usada para identificar transformação espontânea, pode ser quantificada em termos de uma função de estado conhecida como entropia, S Primeira Lei Utiliza a inergia interna, U,para identificar as transformações permissíveis Segunda lei Utiliza a entropia, S, para identificar as mudanças espontâneas (irreversíveis) entre as transformações permissíveis A entropia de um sistema isolado aumenta no decorrer da mudança espontânea onde Stot é a entropia total de um sistema e suas vizinhanças. A entropia é uma medida de desordem molecular em um sistema, permitindo-nos avaliar se um estado é acessível a partir de outro através de mudança espontânea Definição Termodinâmica de Entropia* Uma mudança na entropia é infinitesimal, dS, e isso pode ocorrer como resultado de um processo químico ou físico. A definição termodinâmica da entropia: Mudança infinitesimal Mudança mensurável Se executarmos algum processo longo de um caminho reversível, então a entropia produzida deve ser proporcional à quantidade de calor produzida (ou consumida) e inversamente proporcional à temperatura Diferença de entropia entre dois estados mensuráveis, Encontre um caminho reversível e em cada etapa deste caminho e calcule o calor fornecido dividido pela temperatura em que o calor foi fornecido Por que isso? A mudança na medida em que a energia se dispersa de forma aleatória desordenada depende da quantidade de energia transferida como calor (cria-se movimento aleatório"térmico"). Trabalho não é acompanhado por aumento no movimento aleatório, mas sim, implica em movimento uniforme, e portanto, não é acompanhado por mudanças na entropia. *bouncing - 2ndlaw Exemplo de Entropia: Expansão isotérmica* Considere reversível isotérmico expansão de um gás perfeito (pV = nRT) Em uma expansão isotémica Uma vez que T Constante: Sabemos que o trabalho deste tipo de expansão, de modo Assim, segue-se que Probabilidade simples: as moléculas ocuparem aleatoriamente o espaço que está disponível no sistema – tendência delas explorarem todos os estados disponíveis. *de lado: S = k ln W Vizinhanças Vizinhanças são tratadas de forma semelhante ao sistema, exceto as vizinhanças que são grandes e que as consideramos isotérmicas e (geralmente) a pressão constante. Portanto, o calor transferido para o ambiente é igual a uma função de estado e é independente do caminho que o calor faz para sair ao ambiente: este foi transferido por um caminho reversível. Uma outra visão: assume-se que o ambiente geralmente não se altera de estado quando acontece algo no sistema,portanto, transferência de calor do ambiente e para o ambiente é efetivamente reversível (já que não há mudança de estado, não podemos dizer que a mudança seja irreversível): dSsur ' dqsur, rev ' Tsur Desde que as vizinhanças sejam isotérmica: qsur )Ssur ' dqsur Tsur Assim para qualquer mudança adiabática (qviz = 0): Tsur )Ssur ' 0 Entropia como função de estado A fim de provar que a entropia é uma função de estado, a integral dS deve ser independente do caminho: Onde o círculo na integral significa integração em um caminho fechado (ciclo). Se a integração da equação acima sobre de um ciclo arbitrário (sistema cíclico) for zero, isto mostra que a entropia do sistema nos estados inicial e final é a mesma, independentemente do caminho tomado. No ciclo termodinâmico, a mudança global em uma função de estado é zero, e é independente do caminho. Ciclo de Carnot O ciclo de Carnot, nomeado depois de Sadi Carnot, Tem quatro estágios reversíveis 1. Expansão isotémica revervível de A para B a é o calor fornecido pela fonte quente, e é positiva 2. Expansão adiabática reversível de B para C, calor não deixa o sistema temperatura cai de Th para Tc, onde Tc é a temperatura do sumidouro frio 3. Compressão isotémica reversível de C para D, é o calor liberado para o sumidouro frio, e é negativo 4. Compressão adiabática reversível de D para A, não entra calor no sistema a temperatura aumenta de Tc para Th Mudança na entropia Isto é zero total no ciclo de desde que: Carnot: ∆S=0 para o Ciclo de Carnot Lembre-se para a expansão isotérmica reversível de um gás perfeito E para processos reversíveis adiabáticos c VATh ' c VDTc c c ' Recall: VfTf c ' ViTi c ' c Multiplicando-se as expressões em conjunto : c c c c VAVCTh Tc E simplificando: ' VDVBTh Tc VA ' VD qc ' nRTc ln VA VB Temos: VC VB Portanto: qh qc ' & Th Tc CV, m R Eficiência O mesmo cálculo acabamos de completar para gases se aplica a todos os tipos de materiais e sistemas. Nós definimos a eficiência, ε, de uma máquina térmica: g ' work performed ' heat absorbed *w* qh Quanto maior for a produção de trabalho a partir de um determinado abastecimento de calor, maior será a eficiência do motor Trabalho realizado pelo motor é a diferença entre o calor fornecido pela fonte quente e retornou para o sumidouro frio: g ' qh % qc qh Since qc < 0, grev ' 1 & ' 1% Tc Th qc qh Ciclos de Carnot e Máquinas Segunda Lei: todos os motores reversíveis têm a mesma eficiência, independentemente da construção - Dois motores A e B, assume-se que A seja mais eficiente do que B, acoplados juntos e usando os mesmos reservatórios A: leva calor qh, libera calor qc , B: leva calor qc1 e libera calor qh ¹ Como A é mais eficiente do que B, nem todo trabalho produzido por A será necessário para este processo, e a diferença pode ser utilizada para fazer o trabalho Resultado líquido: reservatório frio permaneceu o mesmo e o reservatório quente perdeu energia, e o trabalho foi produzido. Máquina equivalente Problema: o calor (movimento térmico desordenado) foi convertido diretamente para trabalho (movimento molecular ordenado sem a necessidade de um resfriado no reservatório - pressuposto de que os motores reversíveis A e B podem ser diferentes a eficiência é falsa! Relação entre as transferências de calor e temperaturas deve ser independente Ciclos de Carnot: S é uma função de Estado* Qualquer ciclo reversível pode ser pensado como um conjunto de ciclos de Carnot -esta aproximação torna-se exata como os ciclos se tornam infinitesimais. Variação de entropia em torno de um ciclo individual é zero Soma das variações de entropia sobre todos os ciclos é zero No interior, a mudança de entropia ao longo de qualquer caminho é cancelada pela mudança de entropia ao longo do o caminho compartilhado com o vizinhança Assim, todas as alterações na entropia cancelam-se exceto ao longo do perímetro do ciclo - mas a soma dos caminhos ao longo de todo perímetro, como são infinitesimais em tamanho, coincidem exatamente com o ciclo global, por isso: j all qrev ' T j perimeter qrev ' 0 T dqrev ' 0 n T dS é uma diferencial exata e, portanto, S é uma função de estado *Carnot engine A desigualdade de Clausius Expansão isotérmica de um gás perfeito: wisothermal,irrev ' &pf )V wisothermal,rev ' &nRT ln Vf Vi '& nRT )V Vf ' &nRT )V Vf #Se Vf = 2Vi, wirrev = -(0.5)nRT, e wrev = -(0.693)nRT (mais trabalho é realizado sobre a vizinhança em uma expansão reversível) # Deste que na expansão isotérmica, ∆U = ∆H, and q = -w # Isto mostra que qrev > qirrev # Ssist é uma função de estado, independente do caminho, ∆Ssist = qrev/T = (0.693)nR # Sviz depende da quantidade de calor transferido: Sviz, rev = -(0.693)nR, )Sviz, irrev = -(0.5)nR A desigualdade de Clausius, 2 # No caso reversível, Uma vez em que a variação de entropia do sistema e vizinhanças terão sinais opostos # No caso irreversível, Este é um resultado geral: todas as reações irreversíveis são espontâneas e tem uma variação de entropia total que é maior que zero Para o sistema em contato mecânico e térmico com o ambiente, a uma temperatura, T, pode não estar em equilíbrio mecânico. Qualquer mudança no Estado altera dSsis (sistema) e dSviz (vizinhanças). O processo pode ser irreversível, a entropia total aumentará!!! dSsys % dSsur $ 0, or dSsys $ &dSsur Desde que ∆Sviz = qviz/Tvizr, dSviz = -dq/T, onde dq é o calor fornecido ao sistema durante o processo, e dqviz = -∆dq. Então, para qualquer mudança dSsys $ dq T dSsys $ 0 (sistema isolado da vizinhanças) A desigualdade de Clausius, 3 Este é o nosso sinal de mudança espontânea: em um sistema isolado a entropia do sistema por si só não pode diminuir, devido à mudança espontânea Example 1: Mudança adiabática irreversível, dq = 0, and ˆ dS $ 0 Entropia do sistema aumenta, entropia da vizinhança permanece constante (uma vez que não ocorreu a transferência de calor ), dStot $ 0 Exemplo 2: Expansão isotérmica irreversível de um gás perfeito: dq = -dw Se for no vácuo, w = q = 0, assim dS ≥0, dSsur = 0 and dStot ≥ 0 Exemplo 3: Resfriamento espontâneo dS > 0, uma vez que Th > Tc, assim o resfriamento é espontâneo- se as duas temperaturas são iguais, dStot = 0
Download