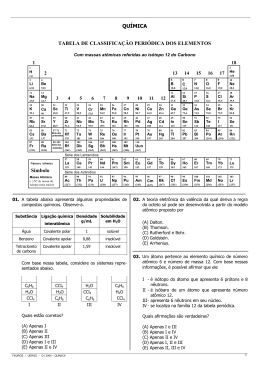
COLÉGIO PRIME CENTRO TAREFA DE SEXTA Química Aluno (a): 1) Considere o elemento de número atômico 13. No estado fundamental, qual a configuração eletrônica do íon estável que esse elemento pode formar? EM – 2ª Série 2º BIM DATA 22/05/2015 As melhores cabeças estudam aqui. conversão e a escala de cores apresentados a seguir, determine o comprimento de onda e a cor da luz emitida pelo OLED de [Al(quinolina)3]. 2) Com relação à configuração eletrônica de um 23 átomo de sódio que apresenta 11 Na , convencionando-se que para o primeiro elétron de um orbital S 1 / 2 , assinale o que for correto. 01. Um elétron no orbital 2s terá o mesmo valor de energia que um elétron no orbital 2p. 02. A configuração eletrônica no estado fundamental é: 1s22s22p63s1. 04. A configuração eletrônica 1s22s22p66s1 representa a configuração de um átomo de Na no estado excitado. 08. O Na apresenta 11 prótons, enquanto Na+ apresenta 12 prótons. 3) As telas de televisão plana e de telefones celulares usam como visores os chamados OLED, que são equivalentes a “microlâmpadas” coloridas formadas por camadas de compostos metalorgânicos depositadas entre dois eletrodos. Um dos metais mais utilizados como emissor de fótons é o alumínio, ligado a um composto orgânico, a quinolina [Al(quinolina)3]. a) Em sistemas semelhantes, pode-se variar a cor da luz emitida substituindo-se o alumínio por outro metal de mesma valência. Escreva a configuração eletrônica do íon A3+ e indique, entre os íons da lista a seguir, qual poderia substituir o alumínio nesses sistemas. K+, Ca2+, Sc2+, Ti4+, V5+, Mn4+; Fe3+; Co2+; Ni2+; Cu2+. Dado: Al (Z = 13) b) A emissão de luz nesses dispositivos pode ser explicada pelo modelo de Bohr. O diagrama de energia a seguir refere-se ao OLED de [Al(quinolina)3]. Com base no diagrama de energia referente ao OLED de [Al(quinolina)3] e utilizando o gráfico de 4) Os sais de Cr6+ são em geral, solúveis no pH biológico e, portanto, têm fácil penetração . Daí a sua toxicidade para os serres humanos. Por outro lado, os compostos de Cr3+ são pouco solúveis nesse pH, o que resulta em dificuldade de passar para o interior das células . Indique a opção que corresponde á configuração eletrônica do íon Cr3+. Dado: [Ar] argônio (Z = 18) 5) Cálcio metálico reage com hidrogênio gasoso, em elevadas temperaturas, para formar o hidreto de cálcio. a) Descreva a equação química balanceada para este processo. b) Descreva as configurações eletrônicas dos elementos, tal como encontram-se no produto da reação. 6) (Mackenzie/SP) - Dadas as equações termoquímicas, I e II, (I) C(s) + O2(g) CO2(g) H = – 94 kcal/mol (II) C(s) + 1/2O2(g) CO(g) H = – 26 kcal/mol, a variação de entalpia da reação CO2(g) + C(s) 2CO(g) é: a) + 68 kcal. b) + 42 kcal. c) – 120 kcal. d) – 42 kcal. e) – 68 kcal. 7) (UEL/PR) – A pirolusita é um dos mais importantes minérios que contêm o dióxido de manganês (MnO2). Na indústria metalúrgica, o manganês puro pode ser obtido por processo térmico a partir da pirolusita, através da reação: 3 MnO2 (s) + 4 Al (s) 2 Al2O3 (s) + 3 Mn (s) Entalpias de formação a 25°C e 1 atm em kJ/mol: MnO2(s) = - 521,0; Al2O3(s)= - 1676,0 Massa molar (g/mol): Mn = 55,0 Com base nessas informações, é correto afirmar que na produção de 11,0 g de manganês puro, a partir das entalpias de formação das substâncias, ocorre: a) Absorção de 358 kJ de energia. b) Liberação de 358 kJ de energia. c) Absorção de 119 kJ de energia. d) Liberação de 119 kJ de energia. e) Liberação de 146 kJ de energia. 8) (UFPiauí/PI) – Dentre os diversos efeitos nocivos da poluição ambiental, destaca-se o “efeito estufa”, uma vez que as conseqüências deste são sentidas em períodos de tempo inferiores a uma geração (< 50 anos). O aumento na temperatura média global, como resultado do “efeito estufa”, tem influência direta, por exemplo, sobre o equilíbrio de + – dissociação da água, 2H2O(l) H3O (aq) + OH (aq), por causar redução no pH da água neutra. Pode-se dizer, portanto, que a reação de dissociação da água é: a) exotérmica. b) nuclear. c) trimolecular. d) irreversível. e) endotérmica. 9) (Vunesp/SP) – Em uma cozinha, estão ocorrendo os seguintes processos: I. gás queimando em uma das “bocas” do fogão e II. água fervendo em uma panela que se encontra sobre esta “boca” do fogão. Com relação a esses processos, pode-se afirmar que: a) I e II são exotérmicos. b) I é exotérmico e II é endotérmico. c) I é endotérmico e II é exotérmico. d) I é isotérmico e II é exotérmico. e) I é endotérmico e II é isotérmico. 10) (UFSCar/1ª Fase) – Considere as equações: Ca2+(g) + 2Cl–(g) CaCl2(s) H = – 2 260 kJ/mol Ca2+(g) Ca2+(aq) H = – 1 657 kJ/mol Cl–(g) Cl–(aq) H = – 340 kJ/mol A entalpia de dissolução, em kJ/mol, do cloreto de cálcio em água, é: a) + 714. b) + 263. c) + 77. d) – 77. e) – 263. 11) (Uniube/MG) Assinale a alternativa que apresenta exemplos de moléculas que formam interações do tipo ponte de hidrogênio intermolecular. a) H2O2, CH3OH, NH3 b) H2O, CH4, CH3-O-CH3 c) H2O, HF, CH3CHO d) CHF3, H2O2, HF 12) (Unesp/SP) Os elementos químicos O, S, Se e Te, todos do grupo 16 da tabela periódica, formam compostos com o hidrogênio, do grupo 1 da tabela periódica, com fórmulas químicas H2O, H2S, H2Se e H2Te, respectivamente. As temperaturas de ebulição dos compostos H2S, H2Se e H2Te variam na ordem mostrada na tabela. A água apresenta temperatura de ebulição muito mais alta que os demais. Essas observações podem ser explicadas, respectivamente: a) pela diminuição das massas molares e aumento nas forças das interações intramoleculares. b) pela diminuição das massas molares e diminuição nas forças das interações intermoleculares. c) pela diminuição das massas molares e pela formação de ligações de hidrogênio. d) pelo aumento das massas molares e aumento nas forças das interações intramoleculares. e) pelo aumento das massas molares e pela formação de pontes de hidrogênio. 13) (ITA/SP) Considere as seguintes comparações de calores específicos dos respectivos pares das substâncias indicadas. I – tetracloreto de carbono (l; 25o C) > metanol (l; 25o C). II– água pura (l; –5o C) > água pura (s, –5o C). III– alumina (s, 25o C) > alumínio (s, 25o C). IV– isopor (s, 25o C) > vidro de janela (s, 25o C). Das comparações feitas, está(ão) CORRETA(S) a) apenas I e II b) apenas I, II e III c) apenas II d) apenas III e IV e) apenas IV 14) (UFMS/MS) Tem-se um sistema de três componentes (solução de I2(s), dissolvido em H2O(l), e CCl4(l)), em duas situações distintas, (a) e (b). A situação (a) representa o CCl4(l) em repouso, seguido da adição cuidadosa da solução aquosa de iodo, sem agitação, e (b) representa o mesmo sistema, após agitação de (a) seguido da acomodação das fases, conforme a figura abaixo. Com os dados das densidades da água (1,00 g/mL), do tetracloreto de carbono (1,59 g/mL) e a observação cuidadosa da figura abaixo, é correto afirmar que: Agitação (a) (b) 01. o I2(s) interage com a água, formando com ela ligações de hidrogênio. 02. as densidades da H2O(l) e do CCl4(l) são irrelevantes, quando esses líquidos são colocados em contato. 04. não ocorre qualquer tipo de interação intermolecular entre H2O(l) , CCl4(l) e I2(s) . 16. I2(s) é mais solúvel em CCl4(l) do que em H2O(l). 32. H2O(l) , CCl4(l) e I2(s) são, respectivamente, compostos polar, polar e apolar. 15) (Fuvest/SP) - Examinando-se as estruturas moleculares do álcool benzílico e do tolueno, CH2OH Álcool Benzílico CH3 Tolueno pode-se afirmar corretamente que: a) o álcool benzílico deve ter ponto de ebulição maior do que o tolueno, ambos sob mesma pressão. b) o álcool benzílico deve ser menos solúvel em água do que o tolueno, ambos à mesma temperatura. c) o álcool benzílico e o tolueno, ambos à mesma temperatura, têm a mesma pressão de vapor. d) o álcool benzílico e o tolueno possuem moléculas associadas por ligações de hidrogênio. e) o álcool benzílico apresenta atividade óptica, enquanto o tolueno não.
Baixar