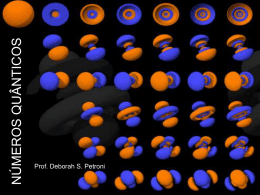
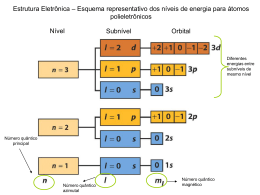
O Átomo e o Mundo Quântico Surgimento da Mecânica Quântica: Século XX Natureza ondulatória da Luz Modelo de Bohr - 1913 Relacionou as idéias quânticas de Planck e Einstein e explicou os espectros dos átomos excitados e acrescentou 3 postulados ao modelo atômico de Rutherford. * O átomo é formado por um núcleo e níveis de energia quantizada, nos quais os elétrons estão distribuídos. Surgimento da Mecânica Quântica Natureza da Luz (radiação eletromagnética) Consiste de campos elétricos e magnéticos oscilantes λ.ν = c 2 ciclos completos 3x108m/s (c-velocidade da luz). Exercícios 1. Duas ondas eletromagnéticas são representadas abaixo: (I) (II) (a) Qual a onda tem a maior freqüência? (b) Se uma onda representa a luz visível e a outra, a radiação infravermelha, qual é uma e qual é outra? Resposta (a) A onda (I) tem comprimento de onda mais longo (maior distância entre os picos). - Quanto maior o comprimento de onda, menor a frequência (ν=c/λ). Portanto a onda (I) tem frequência menor e a onda (II) tem frequência maior. (b) O espectro eletromagnético indica que a radiação IV tem comprimento de onda mais longo do que a luz visível. Assim, a onda (I) seria a radiação infravermelho. Exercício 2. A Luz amarela emitida por uma lâmpada de vapor de sódio usada para iluminação pública tem um comprimento de onda de 589 nm. a) Qual é a freqüência dessa radiação (dados: velocidade da luz = 3x108m/s). b) Quantos fótons de luz amarela são gerados pela lâmpada em 1 s? Resposta C = 3x108m/s). ν=c/λ ν= 3x108m/s /589 nm Grandezas com unidades diferentes Converter λ em namometro (nm) para metro (m) ν= ((3x108m/s)/589 nm)(1nm/10-9m) ν = 5,09 x 1014 s-1 Exercício 3. Calcule os comprimentos de onda (em nm) das luzes de trânsito. Suponha que as frequências sejam: Verde (5,75 x 1014 Hz); amarelo (5,15 x 1014 Hz); vermelho (4,27 x 1014 Hz). Resposta ν=c/λ Verde (5,75 x 1014 Hz); amarelo (5,15 x 1014 Hz); vermelho (4,27 x 1014 Hz) 1Hz = 1s-1 C = 3x108m/s Verde = 521 nm Amarelo = 582 nm Vermelho = 702 nm Evolução da Teoria Atômica Quântica Postulados de Planck: A energia só pode ser liberada (ou absorvida) por átomos em certos pedaços de tamanhos mínimos, chamados quantum. A relação entre a energia e freqüência é dada por: E = hν onde h é a constante de Planck (6,626 x 10-34 J s). E, de acordo com a teoria de Planck, a energia é sempre emitida e absorvida pela matéria em múltiplos inteiros de hν, 2hν, 3hν e assim sucessivamente. Exemplo: Se a quantidade de energia emitida por um átomo for 3hν, dizemos que foram emitidos 3 quanta de energia. E, que as energias permitidas são quantizadas, isto é, seus valores são restritos a determinadas quantidades. Quantização de energia Para entender a quantização, considere a subida em uma rampa versus a subida em uma escada: na rampa, há uma alteração constante na altura (aumenta de maneira uniforme e contínua). enquanto na escada, há uma alteração gradual e quantizada na altura. Evolução da Teoria Atômica Quântica O efeito fotoelétrico e fótons O efeito fotoelétrico fornece evidências para a natureza de partícula da luz “quantização”. Einstein supôs que a luz trafega em pacotes de energia denominados fótons. A energia do fóton é dada por: E = hν Evidências do Comportamento Quântico do Átomo Espectro da Luz Branca Emitida por um Filamento Aquecido Espectro de um Tubo de descarga preenchido com Hidrogênio Evidências do Comportamento Quântico do Átomo Espectros de Emissão Atômica do H, Hg e Ne Os elementos gasosos excitados emitem luz, cujos espectros são únicos para aquele átomo (impressão digital do átomo). Técnica poder ser usada para identificação de elementos. Os Espectros Atômicos • Balmer: descobriu que as linhas no espectro de linhas visíveis do hidrogênio se encaixam em uma simples equação matemática. • Mais para: tarde, Rydberg generalizou 1 RH = λ h a equação de Balmer 1 − 1 2 n1 n22 onde RH é a constante de Rydberg (1,096776 x 107 m-1), n1 e n2 são números inteiros (n2 > n1). Diagrama de níveis de energia do hidrogênio: transições de Paschen, Balmer e Lyman O Modelo Atômico de Bohr - 1913 Um elétron, enquanto em movimento em uma órbita fechada, não absorve nem emite radiação. Bohr admitiu que para cada elétron existe mais de uma órbita estável correspondente a um nível energético diferente. Somente são permissíveis as órbitas eletrônicas para as quais o momento angular do elétron é um múltiplo inteiro de h/2π, em que h é a constante de Planck. O momento angular de uma partícula movendo-se em órbita circular é dado por mvr, em que m é a massa, v a velocidade e r o raio do círculo. O segundo postulado requer que as órbitas estacionárias satisfaçam a condição mvr = nh / 2π O Modelo Atômico de Bohr - 1913 O elétron pode saltar de uma órbita para outra, desde que a passagem seja acompanhada da emissão ou absorção de um quantum de energia radiante, cuja freqüência é determinada pela relação: h.ν = Ei - Ef onde Ei - Ef representam os valores da energia do átomo no estado inicial e final, respectivamente . Como os estados de energia são quantizados, a luz emitida por átomos excitados deve ser quantizada e aparecer como espectro de linhas. Bohr mostrou que: ( E = − 2 . 18 × 10 −18 ) 1 J 2 n onde n é o número quântico principal (por exemplo, n = 1, 2, 3, … ) O Modelo Atômico de Bohr - 1913 • A primeira órbita tem n = 1, é a mais próxima do núcleo e convencionou-se que ela tem energia negativa. • A órbita mais distante no modelo de Bohr tem n próximo ao infinito e corresponde à energia zero. • Os elétrons no modelo de Bohr podem se mover apenas entre órbitas através da absorção e da emissão de energia em quantum (hν). ∆E = hν = hc λ ( = − 2 . 18 × 10 − 18 1 1 J 2 −f 2 n n i f f i ) Quando ni > nf, a energia é emitida. Quando nf > ni, a energia é absorvida Exercício Calcule o comprimento de onda (em nm) de um fóton emitido pelo átomo de hidrogênio quando um elétron decai de um estado onde o n = 5 para um estado onde o n = 3. Este fóton encontra-se em qual região do espectro eletromagnético? h= 6,63 x 10-34J.s Resposta ∆E = hν = hc λ ( = − 2 . 18 × 10 − 18 1 1 J 2 −f 2 n n f fi i ) 1 1 Efóton = -2,18 x ( n2 ) 2 ni f Efóton = - 2,18 x 10-18 J x (1/9 - 1/25) 10-18 J Efóton = ∆E = -1,55 x 10-19 J (negativo para indicar que libera energia) Efóton = h x c / λ λ = h x c / Efóton λ = 6,63 x 10-34 (J•s) x 3,00 x 108 (m/s)/1,55 x 10-19J λ = 1280 nm Região do Infravermelho Comportamento Ondulatório da Matéria Sabendo que a luz pode se comportar como partícula, será que a matéria pode apresentar natureza ondulatória? L. de Broglie (1892-1987) De Broglie, utilizando as equações de Einstein e de Planck, mostrou que se os objetos são pequenos os conceitos de onda e partículas podem ser resumidos como: h λ= mv O momento, p= mv, é uma propriedade de partícula, enquanto λ é uma propriedade ondulatória. Partícula Função de onda Exercício Qual é o comprimento de onda (em nm) de De Broglie associado ao movimento de uma bolinha de pingue-pongue de 2,5 g viajando a 15,6 m/s? h= 6,63 x 10-34 J.s 1J = Kg. m2.s-2 Resposta λ = h/m.v λ = 6,63 x 10-34 / (2,5 x 10-3 x 15,6) λ = 1,7 x 10-32 m = 1,7 x 10-23 nm Comprimento de onda muito pequeno para ser detectado O Princípio da Incerteza de Heisenberg Na escala de massa de partículas atômicas, não podemos determinar exatamente a posição, a direção do movimento e a velocidade simultaneamente. • Para os elétrons: não podemos determinar seu momento e sua posição simultaneamente. • Se ∆x é a incerteza da posição e ∆mv é a incerteza do momento, então: h ∆x·∆mv ≥ 4π W. Heisenberg 1901-1976 O Modelo Atômico Quântico Em 1926, Schröndinger escreveu uma equação que descrevia o comportamento partícula/onda do elétron no átomo de Hidrogênio: Η Ψ = EΨ E. Schrödinger 1887-1961 A função de onda (Ψ) descreve a energia de um determinado elétron e a probabilidade de encontrá-lo em um determinado volume do espaço. Essa equação resulta em inúmeras soluções matemáticas, chamadas de função de onda. Para cada FUNÇÃO DE ONDA existe uma ENERGIA associada. A equação só pode ser resolvida exatamente para o átomo de hidrogênio. Para átomos multi-eletrônicos, a solução é aproximada. O Modelo Atômico Quântico • Somente certas vibrações podem ser observadas numa corda vibrante. Por analogia o comportamento do elétron no átomo é descrito da mesma forma – somente são permitidas certas funções de onda. Quantização surge naturalmente....(analogia com as cordas) • Cada função de onda (Ψ) corresponde a energia permitida para o elétron e concorda com o resultado de Bohr para o átomo de H. • Cada função de onda (Ψ) pode ser interpretada em termos de probabilidade e (Ψ2) dá a probabilidade de encontrar o elétron numa certa região do espaço. • A solução da equação ou função de onda (Ψ) descreve um estado possível para o elétron no átomo denominado de ORBITAL. • Cada função de onda, ou seja, cada Orbital, é descrito por NÚMEROS QUÂNTICOS, que nos informam ENERGIA, FORMA E TAMANHO Os Números Quânticos A equação de Schrödinger necessita de quatro números quânticos: Ψ = fn (n, l, ml, ms) 1 - Número quântico principal, n. Este é o mesmo n de Bohr. À medida que n aumenta, o orbital torna-se maior e o elétron passa mais tempo mais distante do núcleo. n = 1, 2, 3, 4, 5 ... n=1 n=2 n=3 n=4 Os Números Quânticos 2 - O número quântico azimutal, l. Esse número quântico depende do valor de n e representa a forma espacial da subcamada do orbital. Os valores de l começam de 0 e aumentam até n-1. Normalmente utilizamos letras para designar o l (s, p, d e f para l = 0, 1, 2, e 3). Valor de l símbolo da subcamada nº elétrons 0 s (sharp) 2 1 p (principal) 6 2 d (diffuse) 10 3 f (fundamental) 14 Os Números Quânticos – Formatos dos Orbitais s l = 0 (orbital s) • Todos os orbitais s são esféricos. • À medida que n aumenta, os orbitais s ficam maiores. • À medida que n aumenta, aumenta o número de nós. • Um nó é uma região no espaço onde a probabilidade de se encontrar um elétron é zero. • Em um nó, Ψ2 = 0 • Para um orbital s, o número de nós é n-1. Os Números Quânticos – Formatos dos Orbitais p l = 1 (orbital p) Quando l = 1, existe um plano NODAL que passa pelo núcleo. Plano Nodal: Ψ passa pelo zero • Existem três orbitais p, px, py, e pz. • Os três orbitais p localizam-se ao longo dos eixos x-, y- e z- de um sistema cartesiano. • As letras correspondem aos valores permitidos de ml, -1, 0, e +1. • Os orbitais têm a forma de halteres. • À medida que n aumenta, os orbitais p ficam maiores. • Todos os orbitais p têm um nó no núcleo Os Números Quânticos – Formatos dos Orbitais d l = 2 (orbital d) Quando l = 2, existem dois planos NODAIS que passam pelo núcleo • Existem cinco orbitais d • Três dos orbitais d encontram-se em um plano bissecante aos eixos x-, y- e z. • Dois dos orbitais d se encontram em um plano alinhado ao longo dos eixos x-, y- e z. • Quatro dos orbitais d têm quatro lóbulos cada. • Um orbital d tem dois lóbulos e um anel. Os Números Quânticos – Formatos dos Orbitais f l = 3 (orbital f) Os Números Quânticos 3 - O número quântico magnético, ml. Esse número quântico depende de l. O número quântico magnético tem valores inteiros entre -l e +l. Fornecem a orientação do orbital no espaço. Existem 2l+1 valores diferentes de ml para cada valor de l e, portanto, 2l+1 orbitais em uma subcamada de número quântico l. Ex: l = 1 – ml = +1, 0, -1 l = 2 – ml = +2, +1, 0, -1, -2 Orbitais e Números Quânticos Os Números Quânticos 4 - O número quântico de spin, ms. Experimentos mostraram que as linhas espectrais do H e outros elementos se desdobravam quando submetidos a um campo magnético. O elétron se comportava como se tivesse uma rotação (spin) própria em torno do seu eixo ms = +½ ms = -½ Paramagnetismo e Diamagnetismo •Sal de cozinha, giz, tecidos – são repelidos pela aproximação de um imã: Diamagnéticos Paramagnético Elétrons desemparelhados 2p Diamagnético Todos elétrons emparelhados 2p •Metais – são atraídos pela aproximação de um imã: Paramagnéticos Os Números Quânticos - Resumo A Energia dos Orbitais • Um orbital pode ser ocupado por no máximo 2 elétrons • Pelo princípio da exclusão de Pauli: dois elétrons não podem ter a mesma série de 4 números quânticos. Portanto, dois elétrons no mesmo orbital devem ter spins opostos. • De acordo com as regras de Hund: - Os orbitais são preenchidos em ordem crescente de n. - Dois elétrons com o mesmo spin não podem ocupar o mesmo orbital (Pauli). - Para os orbitais degenerados (de mesma energia), os elétrons preenchem cada orbital isoladamente antes de qualquer orbital receber um segundo elétron (regra de Hund). A Energia dos Orbitais em um Átomo Monoeletrônico Energia depende apenas do número quântico n n=3 n=2 En = -RH ( n=1 1 n2 ) SINAL NEGATIVO: significa que a energia do elétron em um átomo é MENOR que a energia do elétron livre A Energia dos Orbitais em um Átomo Polieletrônico Energia depende de n e l n=3 l = 2 n=3 l = 1 n=3 l = 0 n=2 l = 0 n=1 l = 0 n=2 l = 1 A Energia dos Orbitais em um Átomo Polieletrônico A que se deve essa ordem de energia dos orbitais em átomos polieletrônicos? 1 - Efeito de penetração dos orbitais: s > p > d > f ....... Quanto maior a probabilidade de encontrar o elétron perto do núcleo, mais ele é atraído pelo núcleo, maior o poder de penetração do orbital 2 - Efeito de blindagem: elétrons mais internos blindam os elétrons mais externos da atração pelo núcleo Quanto maior o poder de penetração do orbital, os seus elétrons exercem maior blindagem sobre os elétrons mais externos Ordem de Preenchimento dos Orbitais Diagrama de Pauling (Aufbau) 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s Notação da Configuração Eletrônica Notação spdf - espectroscópica Notação em caixa Ex: H, Z = 1 1 1s Valor de n Ex: He, Z = 2 no. de elétrons Valor de l 1s Configuração eletrônica: • descreve o arranjo dos elétrons em um átomo • o arranjo do estado fundamental é aquele que apresenta a menor energia possível • o arranjo de menor energia é o mais estável Direção das setas indicam a orientação do spin dos elétrons Configuração Eletrônica na Tabela Periódica L tio - Li Lítio Grupo 1A Z=3 1s22s1 ---> 3 elétrons 3p 3s 2p 2s 1s Ber lio - Be Berílio Grupo 2A Z=4 1s22s2 ---> 4 elétrons 3p 3s 2p 2s 1s Boro -B Grupo 3A Z=5 1s2 2s2 2p1 ---> 5 elétrons 3p 3s 2p 2s 1s Carbono -C Grupo 4A Z=6 1s2 2s2 2p2 ---> 6 elétrons 3p 3s 2p 2s 1s Por quê não emparelhar o elétron? Regra de HUND Nitrogênio - N Grupo 5A Z=7 1s2 2s2 2p3 ---> 7 elétrons 3p 3s 2p 2s 1s Oxigênio -O Grupo 6A Z=8 1s2 2s2 2p4 ---> 8 elétrons 3p 3s 2p 2s 1s Fluor - F Grupo 7A Z=9 1s2 2s2 2p5 ---> 9 elétrons 3p 3s 2p 2s 1s Neônio - Ne Chegamos no final do segundo período!!!!! Grupo 8A Z = 10 1s2 2s2 2p6 ---> 10 elétrons 3p 3s 2p 2s 1s Sódio - Na Grupo 1A Z = 11 1s2 2s2 2p6 3s1 or “elétrons internos do Ne” + 3s1 [Ne] 3s1 (notação de gás nobre) Iniciou-se um novo período Todos os elementos do grupo 1A tem a configuração [elétrons internos] ns1. Elétrons de valência Alumínio - Al Grupo 3A Z = 13 1s2 2s2 2p6 3s2 3p1 [Ne] 3s2 3p1 Elétrons de valência 3p 3s 2p 2s 1s Fósforo - P Grupo 5A Z = 15 1s2 2s2 2p6 3s2 3p3 [Ne] 3s2 3p3 3p 3s 2p 2s 1s Formação de Cátions e Ânions – Elementos Representativos Na [Ne]3s1 Na+ [Ne] Ca [Ar]4s2 Ca2+ [Ar] Al [Ne]3s23p1 Al3+ [Ne] Átomo ganha elétrons de modo que o ânion venha a ter configuração de gás nobre Átomo perde elétrons de modo que o cátion venha a ter uma configuração eletrônica de gás nobre. H 1s1 H- 1s2 ou [He] F 1s22s22p5 F- 1s22s22p6 ou [Ne] O 1s22s22p4 O2- 1s22s22p6 ou [Ne] N 1s22s22p3 N3- 1s22s22p6 ou [Ne] Metais de transição Todos os elementos do 4º período tem configuração [Ar]nsx(n - 1)dy e, portanto, são elementos do bloco d. Orbitais 3d usados do Sc-Zn Distribuição Eletrônica para Metais de Transição Z=21 - [Ar] 4s2 3d1 -------Sc Z=22 - [Ar] 4s2 3d2 -------Ti Por quê o orbital 4s é preenchido antes do 3d? O orbital s é mais penetrante e, conseqüentemente, os elétrons sentem menos a presença dos outros. Por estar mais próximo ao núcleo, a energia é mais baixa (mais negativa), fazendo com que um elétron 4s tenha energia menor do que um 3d. Z=23 - [Ar] 4s2 3d3 --------V Z=24 - [Ar] 4s1 3d5 --------Cr Z=25 - [Ar] 4s2 3d5 -------Mn Z=26 - [Ar] 4s2 3d6 --------Fe Z=27 - [Ar] 4s2 3d7 --------Co Z=28 - [Ar] 4s2 3d8 --------Ni Z=29 - [Ar] 4s1 3d10 -------Cu Z=30 - [Ar] 4s2 3d10 -------Zn Por quê o orbital 4s do Cr e Cu é semi-preenchido ? Distribuição Eletrônica para Metais de Transição A resposta à esta questão está na estabilidade extra que uma camada cheia (ou semi-cheia) proporciona. Camada semi-cheia d5 Ocupação simétrica Camada cheia d10 O emparelhamento de elétrons em um mesmo orbital envolve repulsão a qual aumenta a energia do orbital. Estabilidade extra Por essa razão, o elétron ocupa os orbitais d vazios, gerando uma camada semi-cheia (ou cheia) e, assim, ganha estabilidade extra devido a diminuição de energia. Distribuição Eletrônica para Metais de Transição Na formação de cátions, inicialmente são removidos elétrons da camada ns e depois elétrons da camada(n - 1). Ex: Fe [Ar] 4s2 3d6 perde inicialmente 2 elétrons ---> Fe2+ [Ar] 4s0 3d6 Fe2+ Fe 4s 3d 4s 3d Fe3+ 4s 3d Distribuição Eletrônica para Lantanídeos Todos estes elementos tem configuração [elétrons internos]nsx(n - 1)dy(n - 2)fz e são chamados de elementos do bloco f Orbitais 4f usados para Ce - Lu e 5f para Th - Lr Configuração Eletrônicas dos Elementos
Download