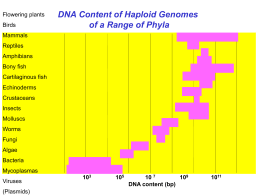
DETERMINAÇÃO DO
SEXO
Prof. MSc. Hélio Alves
Sexo do embrião:
• determinado no momento
da fecundação
• depende de o
espermatozóide conter um
cromossomo X ou um
cromossomo Y.
No início da embriogênese
humana não existem
diferenças evidentes - a não
ser ao microscópio
eletrônico - entre um feto de
sexo feminino e um de sexo
masculino.
5 semanas
Expressão do gene SRY nos
fetos XY:
• as futuras gônadas iniciam
uma serie de eventos que
determinam mudanças
citológicas, histológicas e
funcionais características
dos testículos.
Determinação Sexual
Os testículos secretam dois
hormônios:
• hormônio anti-Mülleriano
• testosterona
A ação destes hormônios
provoca a masculinização
dos esboços dos órgãos
genitais internos e externos
Diferenciação Sexual Fetal
• proceso de diferenciação
dos genitais
DESENVOLVIMENTO DOS
ÓRGÃOS GENITAIS
Pouco se conhece hoje
sobre os mecanismos que
induzem as gônadas a tomar
o caminho ovárico no feto
XX.
Sabe-se que a falta dos
hormônios testiculares
resultam em feminização dos
genitais internos e externos,
independentemente da
existência ou ausência de
ovários.
DESENVOLVIMENTO DOS ÓRGÃOS
GENITAIS
DIFERENCIAÇÃO
SEXUAL
Até a 5ª semana de
gestação é impossível
distinguir um embrião
masculino de um feminino
por características
anatômicas ou histológicas
= Período Indiferenciado.
Gonadonefrótomos do
mesoderma intermediário:
• Mesonefro
• cristas urogenitais
• cristas gonadais
• cristas urinárias
As gônadas
indiferenciadas podem
evoluir para testículos ou
ovários.
As células germinativas
primordiais ♀ ou ♂ se
originam do saco vitelínico
ao final da 3ª semana de
desenvolvimento,
migrando entre a 5ª e 6ª
semanas até as cristas
gonadais.
• ducto mesonéfrico (ducto
de Wolf)
• ducto paramesonéfrico
(ducto de Müller)
Os órgãos genitais
externos se originam a
partir de derivados da
cloaca e da membrana
cloacal.
DIFERENCIAÇÃO SEXUAL
DOS ESBOÇOS DAS
GÔNADAS E DOS
GENITAIS
Ao final da 7ª semana do
desenvolvimento, no
individuo XY as cristas
gonadais se diferenciam
formando os testículos
fetais.
• formam-se os cordões
testiculares, futuros tubos
seminíferos
• população de células
somáticas - células de
Sertoli
• população de células
germinativas primordiais
Alguns dias depois surgem,
no interstício, as células de
Leydig.
célula
de
Leydig
As gônadas dos fetos XX
permanecem com um
aspecto indiferenciado
mais tempo.
Por ação dos andrógenos
testiculares, os ductos
mesonéfricos de Wolff dão
origem, no feto masculino
aos epidídimos, ductos
deferentes e vesículas
seminais.
No sexo feminino, ante a
ausência do hormônio antiMülleriano (AMH), os
ductos paramesonéfricos
de Müller formam as tubas
uterinas, o útero e o terço
superior da vagina.
Os ductos de Wolff
degeneram no feto XX por
falta de andrógenos e os
ductos de Müller regridem
no feto XY por ação do
AMH.
A testosterona produzida
pelas células de Leydig
une-se a seu receptor
específico que viriliza os
ductos de Wolff e
masculiniza o seio
urogenital.
A testosterona é
transformada pela 5reductase em
dihidrotestosterona (DHT)
que se une ao mesmo
receptor, com mais
afinidade, e masculiniza os
genitais externos.
As células de Sertoli
secretam hormônio antiMülleriano (AMH) que
provoca a regressão dos
ductos de Müller.
No feto XX, a falta de
andrógenos permite que a
genitália se diferencie em
feminina.
DETERMINAÇÃO SEXUAL
MECANISMOS
MOLECULARES DO
DESENVOLVIMENTO
TESTICULAR
Há várias décadas se sabe
que é a presença de um
cromossomo Y o fator
determinante do
desenvolvimento sexual da
gônada fetal.
O número de cromossomos
X não tem nenhuma
influência neste
mecanismo.
O gene SRY (Sexdetermining Region Ychromosome) está presente
no braço curto do
cromossomo Y.
O gene SRY induz a
proliferação do epitélio
celômico das cristas
gonadais e a migração de
células mesonéfricas para a
crista gonadal.
Células mióideas
peritubulares - parecem ser
determinantes para que as
futuras células de Sertoli
se organizem junto às
células germinativas
primordiais formando
estruturas cordonais.
A interação entre as células
mesonéfricas e as células
do epitélio celômico
provocaria a diferenciação
destas em células de
Sertoli.
As células de Sertoli passam
a mostrar um padrão de
expressão específico:
• ↑ de SOX9 (outra proteina
da familia do SRY) e do AMH
• ↓ de DAX1 (fator repressor
dos genes testiculares)
Não se conhecem com
precisão os mecanismos
moleculares pelos quais
atua o SRY.
Existem evidências
experimentais que o SRY e o
DAX1, cujo gene se
encontra no cromossomo X,
atuem em períodos
específicos do
desenvolvimento das cristas
gonadais.
No individuo XY, existe um
só alelo do gene SRY e um
só alelo do gene DAX1: se
entende então que há uma
só "dose" de proteína SRY e
uma "dose" de proteína
DAX1.
Nestas condições o SRY
parece ser predominante e
permite a diferenciação
testicular com a
consequente expressão de
genes tipicamente
testiculares, como SOX9 e
AMH.
Em certas condições
anormais, a existência de 2
doses ativas de DAX1
parece ser responsável por
niveis elevados de DAX1
que impediriam o
desenvolvimento testicular.
1. no feto XX normal e no
feto XY com uma mutação
ou deleção do SRY, os
fatores anti-testiculares
(DAX1) iniben o
desenvolvimento
testicular.
Fator repressor de genes
testiculares (DAX1)
Genes testiculares
(SOX9, AMH)
Mulher XX
Ovários
2. no feto XY normal, o SRY
bloqueia a ação dos
fatores anti-testiculares,
permitindo que as
gônadas se desenvolvam
no sentido testicular e
expressem genes como
SOX9 e AMH, específicos
da gônada masculina.
Fator repressor de genes
testiculares (DAX1)
SRY
Genes testiculares
(SOX9, AMH)
Homem XY
Testículos
3. Em fetos XY com uma
dose dupla DAX1, uma só
dose de SRY não pode
bloquear o efeito
antitesticular de duas
doses de DAX1 “fêmea
XY”.
Fator repressor de genes
testiculares (2x DAX1)
SRY
Genes testiculares
(SOX9, AMH)
Mulher XY
Ovários
4. no feto XX com uma
alteração nos genes
antitesticulares, as
gônadas poderiam se
desenvolvem no sentido
testicular mesmo na
ausência de SRY : “macho
XX” sem SRY.
Fator repressor de genes
testiculares (0x DAX1)
Genes testiculares
(SOX9, AMH)
Homem XX
Testículos
Não somente os níveis de
SRY, mas a cronologia de
sua expressão é
importante.
Um atraso na expressão de
SRY permitiría uma ação
anti-testicular do DAX1,
resultando na formação de
ovotestes ou de gônadas
disgenéticas.
O SRY não é o único gene
responsável pelo
desenvolvimento testicular,
outros genes autosômicos
também estão envolvidos no
desenvolvimento normal da
gônada masculina.
Em indivíduos XX, a
ausência de SRY resulta em
aumento dos níveis de
DAX1 na gônada, que se
diferencia no sentido
ovárico.
Aparentemente o DAX1 não
é essencial para o
desenvolvimento do ovário
pois ratos XX com um
invalidação ("knock-out“) de
DAX1 apresentam ovários.
Se conhece muito pouco
dos mecanismos envolvidos
no desenvolvimento
ovárico.
Teoria Clássica: a simples
ausência de SRY resulta no
desenvolvimento do ovario.
Parece lógico imaginar que
deva existir uma correta
expressão de genes "proováricos", até hoje
desconhecidos.
Contrariamente ao que
ocorre no testículo, a
presença de células
germinativas é essencial
para a manutenção e
desenvolvimento da gônada
feminina.
As moléculas envolvidas na
proliferação, manutenção e
na apoptose das ovogônias
e ovócitos durante a vida
fetal estão relacionadas,
indiretamente, no
desenvolvimento do ovário.
Download