Fundação Oswaldo Cruz
Instituto de Pesquisa Clínica Evandro Chagas
Pós-Graduação em Pesquisa Clínica em Doenças Infecciosas
Dissertação de Mestrado
Estudo comparativo de sistemas reveladores em ensaios
imunoenzimáticos para detecção de anticorpos específicos no
diagnóstico da leishmaniose tegumentar americana
Lílian Dias Nascimento
Rio de Janeiro
2007
Curso de Pós-Graduação em Pesquisa Clínica em Doenças Infecciosas
Estudo comparativo de sistemas reveladores em ensaios
imunoenzimáticos para detecção de anticorpos específicos no
diagnóstico da leishmaniose tegumentar americana
Lílian Dias Nascimento
Orientador:
Dr. Mauro Célio de Almeida Marzochi
Co-orientadora:
Dra. Sonia Regina Lambert Passos
Dissertação apresentada ao Instituto de
Pesquisa Clínica Evandro Chagas como
requisito parcial para obtenção do título de
Mestre em Ciências e desenvolvida no Serviço
de Parasitologia (IPEC - FIOCRUZ).
Rio de Janeiro
2007
ii
Curso de Pós-Graduação em Pesquisa Clínica em Doenças Infecciosas
Esta Dissertação intitula-se:
“Estudo comparativo de sistemas reveladores em ensaios imunoenzimáticos
para detecção de anticorpos específicos no diagnóstico da
leishmaniose tegumentar americana”
Apresentada por:
Lílian Dias Nascimento
Orientador: Dr. Mauro Célio de Almeida Marzochi
Co-orientadora: Dra. Sonia Regina Lambert Passos
Local: Auditório do Pavilhão de Ensino do Instituto de Pesquisa Clínica
Evandro Chagas
Data: 27/04/2007.
Horário: 9 horas
Banca Avaliadora
Dra. Rosely Maria Zancopé Oliveira - IPEC/FIOCRUZ (Presidente)
Dra. Graziela Maria Zanini - IPEC/FIOCRUZ
Dr. Valmir Laurentino Silva - ENSP/FIOCRUZ
Dra. Maria de Fátima Madeira - IPEC/FIOCRUZ (Suplente)
iii
FICHA CATALOGRÁFICA
Nascimento, Lílian Dias
Estudo comparativo de sistemas reveladores em ensaios
imunoenzimáticos
para
detecção
de
anticorpos
específicos
no
diagnóstico da leishmaniose tegumentar americana / Lílian Dias
Nascimento - Rio de Janeiro, 2007.
75 p.: il.
Dissertação (Mestrado) - Curso de Pós-Graduação em Pesquisa
Clínica em Doenças Infecciosas, Instituto de Pesquisa Clínica Evandro
Chagas - IPEC, FIOCRUZ.
1. Leishmania (Viannia) braziliensis 2. Imunoensaio 3. Sistemas
Reveladores 4. Validação I. Marzochi, Mauro Célio de Almeida
(Orient.) II. Passos, Sonia Regina Lambert (Co-orient.) III. Título
iv
AGRADECIMENTOS
Ao meu orientador, Dr. Mauro Célio de Almeida Marzochi, a quem admiro pela
sua sabedoria, competência, profissionalismo e atenção a mim dedicada;
À minha co-orientadora, Dra. Sonia Regina Lambert Passos, pela orientação,
incentivo, paciência e dedicação durante a realização deste trabalho;
À “chefe” Msc. Eliame Mouta Confort pelo apoio, incentivo e confiança sempre
a mim dispensada;
À Dra. Maria de Fátima Madeira e equipe pela colaboração na realização das
culturas;
Às “meninas” da sorologia, Marta, Andréia, Flávia, Patrícia, Elaine e Jamyra, e
também Viviane e Tatiana pela ajuda e principalmente amizade nas horas
difíceis (amigas.... obrigada por ter pessoas como vocês ao meu lado);
A todos do Serviço de Parasitologia - IPEC, pelo constante apoio que
contribuíram para a realização deste trabalho;
Aos colegas de Mestrado, pela convivência e amizade nos momentos em que
passamos juntos;
À Coordenação de Pós-Graduação, em especial ao secretário Marcelo
Eduardo Timóteo, por me receber com atenção, estando sempre disponível a
ajudar;
Aos professores do Curso de Pós-Graduação que contribuíram com novos
conhecimentos;
A todas as pessoas que me apoiaram direta ou indiretamente na realização
deste trabalho.
i
LISTA DE ABREVIATURAS E SIGLAS
ABTS - 2,2’-azino-bis-3-etilbenzotiazolina-6-ácido sulfônico
AP - Fosfatase Alcalina
AUC - Area under the ROC curve (Área sob a curva ROC)
BHI - Brain Heart Infusion
BL - Blank
CEP - Comitê de Ética em Pesquisa
CN - Controle Negativo
CP - Controle Positivo
CRLeish - Centro de Referência em Leishmanioses
DNA - Ácido desoxirribonucléico
DO - Densidade Óptica
ELISA - Enzyme-Linked Immunosorbent Assay
FIOCRUZ - Fundação Oswaldo Cruz
HIV - Vírus da Imunodeficiência Humana
HPPA - 3 - p - hidroxifenil ácido propiônico
HRP - Horseradish Peroxidase
HSP - Heat Shock Protein (Proteína de choque térmico)
IC - Intervalo de Confiança
ICC - Intraclass Correlation Coefficient (Coeficiente de Correlação Intraclasse)
IDRM - Intradermorreação de Montenegro
IPEC - Instituto de Pesquisa Clínica Evandro Chagas
IFI - Imunofluorescência indireta
IgA - Imunoglobulina A
IgG - Imunoglobulina G
IgM - Imunoglobulina M
LC - Leishmaniose cutânea
LCD - Leishmaniose cutânea difusa
LCM - Leishmaniose cutânea-mucosa
LM - Leishmaniose mucosa
LT - Leishmaniose tegumentar
LTA - Leishmaniose tegumentar americana
ii
LV - Leishmaniose visceral
MS - Ministério da Saúde
MUP - 4-Metilumbeliferilfosfato
Nm - Nanômetro
OMS - Organização Mundial de Saúde
OPD - O-fenilenodiamino
PBS - Salina tamponada com fosfatos
PBS-T - PBS pH 7,2 com 0,05% de Tween 20
PBS-TL - PBS-T com 1% de leite desnatado
PCR - Reação em cadeia da polimerase
pH - Potencial Hidrogeniônico
PMP - Monofosfato de fenolftaleína
pNPP - p-nitrofenil fosfato
RFC - Reação de fixação de complemento
RFU - Relative Fluorescence Units
ROC - Receiver Operator Characteristic
RV+ - Razão de Verossimilhança para o teste positivo
RV- - Razão de Verossimilhança para o teste negativo
SFB - Soro Fetal Bovino
SPSS - Statistical Package for the Social Science
STARD - Standards for Reporting of Diagnostic Accuracy
SUS - Sistema Único de Saúde
TAD - Teste de aglutinação direta
Th1 - Células TCD4+ secretoras do padrão 1 de citocinas
Th2 - Células TCD4+ secretoras do padrão 2 de citocinas
TMB - 3,3’,5,5’-Tetrametilbenzidina
VPN - Valor Preditivo Negativo
VPP - Valor Preditivo Positivo
WHO - World Health Organization
iii
LISTA DE TABELAS
Tabela 1: Freqüência (%) dos diagnósticos no grupo controle. ....................... 28
Tabela 2: Razões entre as médias dos controles positivos (CP) e as médias
dos controles negativos (CN) para cada diluição do conjugado e substrato. ... 35
Tabela 3: Resultados positivos e negativos do imunoensaio para os diferentes
grupos segundo os três substratos. ................................................................. 38
Tabela 4: Valores de sensibilidade, especificidade, VPP, VPN, RV+ e RV- com
seus respectivos IC de 95% para cada substrato. ........................................... 39
Tabela 5: Comparação das áreas sob a curva (AUC) do ensaio enzimático com
os diferentes substratos ................................................................................... 40
iv
LISTA DE FIGURAS
Figura 1: Reação do o-fenilenodiamino com horseradish peroxidase - peróxido
de hidrogênio.................................................................................................... 15
Figura 2: Reação da 3,3’,5,5’-tetrametilbenzidina com horseradish peroxidase peróxido de hidrogênio..................................................................................... 15
Figura 3: Reação do 4-metilumbeliferilfosfato com fosfatase alcalina.............. 16
Figura 4: Diluições do conjugado anti-IgG HRP para o cromógeno OPD. ....... 34
Figura 5: Diluições do conjugado anti-IgG HRP para o cromógeno TMB. ....... 34
Figura 6: Diluições do conjugado anti-IgG AP para o fluorógeno MUP............ 35
Figura 7: Distribuição das Densidades Ópticas no ELISA com o cromógeno
OPD nos dois grupos - LTA (N= 189) e controle (N= 189)............................... 36
Figura 8: Distribuição das Densidades Ópticas no ELISA com o cromógeno
TMB nos dois grupos - LTA (N= 189) e controle (N= 189). .............................. 37
Figura 9: Distribuição das Unidades Relativas de Fluorescência nos ensaios
imunoenzimáticos com o fluorógeno MUP nos dois grupos -
LTA (N= 189)
e controle (N= 189)........................................................................................... 37
Figura 10: Áreas sob a curva ROC dos três sistemas reveladores .................. 40
v
RESUMO
O presente trabalho tem como objetivo comparar a acurácia e confiabilidade de
três sistemas reveladores de ensaios imunoenzimáticos na detecção de
anticorpos IgG específicos para o diagnóstico da LTA causada por Leishmania
(Viannia) braziliensis. Trata-se de um estudo diagnóstico, mascarado, com
repetições independentes, em população total de 378 pacientes de um
ambulatório de referência no Rio de Janeiro, dos quais 189 amostras de soro
de pacientes com diagnóstico parasitológico positivo para LTA e 189 com
diagnóstico confirmado para outras doenças cutâneas do espectro de
diagnóstico diferencial de LTA. Nos ensaios imunoenzimáticos foram
empregados antígenos parcialmente solúveis obtidos de formas promastigotas
de L. (V.) braziliensis e na revelação, dois cromógenos, 1,2-ortofenilenodiamino
(OPD)
e
3,3’,5,5’-tetrametilbenzidina
(TMB)
e
um
fluorógeno,
4-
metilumbeliferilfosfato (MUP). O desempenho de cada sistema revelador foi
comparado através dos seus parâmetros de acurácia, Coeficiente de
Correlação Intraclasse (ICC) e as áreas sob a curva ROC (Receiver Operating
Characteristic). A sensibilidade foi idêntica (97,4%) para todos os sistemas. A
confiabilidade foi excelente (ICC = 98,61%; 98,74% e 99,11%) e a
especificidade variou de 93,7%, 95,8% a 97,4% para OPD, MUP e TMB,
respectivamente, sem significância estatística. A não diferença entre as
excelentes performances dos três reveladores sugere que se utilize o TMB por
possuir vantagens de ordem operacionais como baixo custo referente ao
equipamento de leitura, fácil manipulação, estabilidade e menor toxicidade.
vi
ABSTRACT
The present work has the objective to compare accuracy and reliability of three
revealing systems of immunoenzymatic assays in the detection of specific IgG
antibodies for the diagnosis of ATL caused by Leishmania (Viannia) braziliensis.
This is a diagnostic, masked study, with independent repetitions, in a total
population of 378 patients of a reference clinic in Rio de Janeiro, of which 189
serum samples of patients with positive parasitological diagnosis for ATL and
189 with diagnostic confirmed for other cutaneous pathologies of the spectrum
of differential diagnosis with ATL. The immunoenzymatic assays was performed
using partially soluble antigens obtained from promastigote forms of L. (V.)
braziliensis and as substrates, two chromogenics, 1,2-o-phenylenediamine
(OPD) and 3,3',5,5' - tetramethylbenzidine (TMB) and one fluorogenic, 4methylumbelliferyl phosphate (MUP). Performance of each revealing system
was compared through its accuracy parameters, Intraclass Correlation
Coefficient (ICC) and the areas under the ROC curve (Receiver Operating
Characteristic). Sensitivity was identical (97.4%) for all systems. Reliability was
excellent (ICC = 98.61%, 98.74% and 99.11%) and specificity varied of 93,7%,
95.8% and 97.4% for OPD, MUP and TMB, respectively, without statistically
significance. The lack of difference between the excellent performances of
these three substrates suggests the usage of TMB because its operational
advantages like low cost of the reading equipment, easy manipulation, stability
and less toxicity.
vii
SUMÁRIO
AGRADECIMENTOS .......................................................................................... i
LISTA DE ABREVIATURAS E SIGLAS ..............................................................ii
LISTA DE TABELAS ..........................................................................................iv
LISTA DE FIGURAS .......................................................................................... v
RESUMO............................................................................................................vi
ABSTRACT ....................................................................................................... vii
1.
INTRODUÇÃO ............................................................................................ 1
1.1. O PARASITA E SUA TRANSMISSÃO............................................................. 1
1.2. A APRESENTAÇÃO CLÍNICA NO HOMEM ...................................................... 1
1.3. EPIDEMIOLOGIA ...................................................................................... 3
1.4. DIAGNÓSTICO DA LTA............................................................................. 4
1.4.1. Diagnóstico Parasitológico............................................................ 6
1.4.2. Diagnóstico Sorológico ................................................................. 8
1.4.2.1.
Resposta imune a Leishmania............................................... 8
1.4.2.2.
Testes sorológicos................................................................. 9
1.4.2.2.1. Ensaios Imunoenzimáticos ........................................................... 12
1.5. AVALIAÇÃO DE TESTES DIAGNÓSTICOS .................................................. 16
1.5.1. Roteiro para determinar a validade de um teste diagnóstico ...... 20
2.
JUSTIFICATIVA ........................................................................................ 23
3.
OBJETIVOS .............................................................................................. 25
3.1.
3.2.
4.
OBJETIVO GERAL ................................................................................. 25
OBJETIVOS ESPECÍFICOS ...................................................................... 25
SUJEITOS E MÉTODOS .......................................................................... 26
4.1. DELINEAMENTO DO ESTUDO .................................................................. 26
4.2. SUJEITOS DA PESQUISA ........................................................................ 26
4.2.1. População do Estudo.................................................................. 26
4.2.2. Tamanho Amostral...................................................................... 26
4.2.3. Critérios de elegibilidade e seleção da amostra.......................... 27
4.3. PARASITAS E ANTÍGENOS UTILIZADOS NOS TESTES .................................. 28
4.3.1. Cultura axênica de L. (V.) braziliensis......................................... 28
4.3.2. Preparação antigênica ................................................................ 29
4.4. PROTOCOLO TÉCNICO DO ENSAIO IMUNOENZIMÁTICO ............................... 30
4.5. CONFIABILIDADE E MASCARAMENTO....................................................... 31
4.6. ANÁLISE ESTATÍSTICA ........................................................................... 31
4.7. ASPECTOS ÉTICOS ............................................................................... 32
5.
RESULTADOS.......................................................................................... 33
5.1. DILUIÇÕES DOS CONJUGADOS ANTI-IGG ................................................. 33
5.2. ENSAIOS IMUNOENZIMÁTICOS ................................................................ 36
5.2.1. Definição dos pontos de cortes (cut-off) ..................................... 36
5.2.2. Acurácia dos testes..................................................................... 38
5.2.3. Comparação do desempenho dos três reveladores utilizando a
curva ROC ................................................................................................ 39
viii
5.3.
CONFIABILIDADE DOS ENSAIOS IMUNOENZIMÁTICOS ................................. 41
6.
DISCUSSÃO ............................................................................................. 42
7.
CONCLUSÃO ........................................................................................... 47
8.
REFERÊNCIAS......................................................................................... 48
9.
ANEXOS ................................................................................................... 60
ANEXO 2 - TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO .......................... 66
ANEXO 3 - TERMO DE COMPROMISSO E RESPONSABILIDADE .............................. 73
ANEXO 4 - APROVAÇÃO NO CEP/IPEC ............................................................ 74
ix
1. INTRODUÇÃO
1.1.
O parasita e sua transmissão
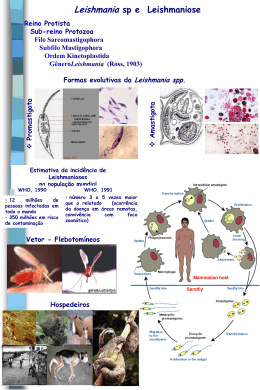
As leishmanioses constituem um complexo de doenças amplamente
distribuídas nos países do Novo e Velho Mundo com uma importante
diversidade clínica e epidemiológica (Desjeux, 1996).
As leishmanioses são antropozoonoses causadas por protozoários
flagelados pertencentes ao gênero Leishmania da ordem Kinetoplastida e
família Trypanosomatidae. Estes protozoários são parasitas intracelulares
obrigatórios e heteroxênicos, necessitando de pelo menos dois hospedeiros
para completar seu ciclo biológico. Apresentam duas formas morfologicamente
distintas: promastigota, presente no trato digestivo do vetor, e amastigota,
encontrada nas células fagocíticas do hospedeiro vertebrado (Lainson et al.,
1987a; Killick-Kendrick, 1990a). As formas promastigotas são transmitidas ao
hospedeiro através da picada de fêmeas de dípteros da sub-família
Phlebotominae, pertencentes aos gêneros Phlebotomus no Velho Mundo e
Lutzomyia no Novo Mundo (Killick-Kendrick, 1990b).
1.2.
A apresentação clínica no homem
Dependendo da espécie de Leishmania envolvida e da relação do
parasita com seu hospedeiro, a doença pode apresentar diferentes formas
clínicas variando de lesões autoresolutivas ou persistentes que acometem, seja
isolada ou concomitantemente, a pele e mucosas do nariz, boca, faringe e
laringe e, por isso, recebem o nome de leishmaniose tegumentar (LT) até um
1
comprometimento visceral acometendo principalmente o baço e fígado (Saravia
et al., 1989; Grimaldi & McMahan-Pratt, 1991).
A leishmaniose visceral (LV) é a forma sistêmica da doença em que os
parasitas apresentam acentuado tropismo por células do sistema fagocítico
mononuclear do baço, fígado, medula óssea e tecidos linfóides. Também
conhecida como Calazar, a LV se caracteriza por febre irregular, perda de peso,
hepatoesplenomegalia, linfadenopatia e anemia, podendo ser fatal antes ou
mesmo após o tratamento (Desjeux, 1996).
Pelo envolvimento cutâneo e de mucosas no continente americano, a
leishmaniose
tegumentar
americana
(LTA)
pode
ser
classificada
em
leishmaniose cutânea (LC), leishmaniose mucosa (LM), leishmaniose cutâneomucosa (LCM) e leishmaniose cutânea difusa (LCD) (Marzochi & Marzochi,
1994).
A LC é a forma clínica mais freqüente que produz exclusivamente lesões
cutâneas, ulcerosas ou não, porém limitadas. Esta forma inicia-se geralmente
como uma pápula no local da picada do inseto, progredindo para uma úlcera
cutânea arredondada ou ovóide com bordas elevadas bem delimitadas e
eritrematosas com fundo granuloso (Marsden & Nonato, 1975; Marsden, 1985;
Costa et al., 1987). As lesões podem ser múltiplas ou uma única curando-se
espontaneamente ou após tratamento terapêutico específico (Marzochi &
Marzochi, 1994; Oliveira-Neto et al., 2000). Cerca de 3 a 5% dos casos de LC
progridem para a forma cutâneo-mucosa (Marsden et al., 1986).
A LCM é classicamente descrita como secundária e metastática, com a
possibilidade de ocorrer acometimento da mucosa por contigüidade a lesões de
2
pele ou por inoculação direta do parasita (Marzochi & Marzochi, 1994). A
mucosa nasal, isoladamente ou associada a outras áreas, constitui a
localização mais comum. Esta forma não tende a evoluir para a cura
espontânea e as lesões são mais resistentes à terapêutica antimonial (Marsden
et al., 1986; Oliveira-Neto et al., 1998).
A LCD é a forma anérgica da doença que se caracteriza por lesões
cutâneas múltiplas, não ulceradas, ricas em parasitas, formadas distantes do
local da picada do inseto, estendendo-se por grande área da superfície corporal
e de difícil tratamento (Marzochi & Marzochi, 1994). Na LTA, as principais
espécies relacionadas à doença são L. (Leishmania) amazonensis, L. (L.)
mexicana, L. (Viannia) peruviana, L. (V.) guyanensis, L. (V.) panamensis e L.
(V.) braziliensis, sendo esta última encontrada em todas as regiões endêmicas
do Brasil (Lainson et al., 1987b; Marzochi & Marzochi, 1994; Desjeux, 1996;
Weigle & Saravia, 1996).
1.3.
Epidemiologia
Segundo
a
Organização
Mundial
de
Saúde
(OMS/WHO),
as
leishmanioses são endêmicas em 88 países, 21 do Novo Mundo e 66 do Velho
Mundo. Estima-se que aproximadamente 350 milhões de pessoas no mundo
estejam expostas a fatores de risco para as infecções, com uma incidência de
dois milhões de novos casos por ano, sendo que 1,5 milhões de LT e 500 mil
de LV. Do número total de casos de LT, 90% ocorrem em apenas seis países:
Afeganistão, Arábia Saudita, Irã, Síria, Brasil e Peru (World Health
Organization, 1998).
3
Nos últimos 20 anos, a incidência de LTA no Brasil vem aumentando em
praticamente todos os Estados. A existência de surtos epidêmicos nas regiões
Sudeste, Centro-Oeste, Nordeste e mais recentemente na região Amazônica
está relacionada à mudança nos perfis epidemiológicos da doença, que era
considerada predominantemente silvestre. Com o processo migratório,
urbanização de áreas adjacentes a ambientes rurais e ocupação de encostas
nas periferias urbanas, a transmissão passou também a ocorrer no peridomicílio
e no intradomicílio, condicionado à adaptação de algumas espécies de
flebotomíneos ao meio ambiente urbano e envolvendo animais domésticos,
principalmente o cão, como reservatórios (Dias et al., 1977; Oliveira-Neto et al.,
1988; Marzochi & Marzochi, 1994).
A LTA constitui um problema de saúde pública em nosso país e sua
importância reside não somente na sua alta incidência e ampla distribuição
geográfica, mas também na possibilidade da existência de lesões destrutivas,
desfigurantes e até incapacitantes, com grande repercussão no campo
psicossocial do indivíduo (Gontijo & Carvalho, 2003).
1.4.
Diagnóstico da LTA
O diagnóstico da LTA abrange aspectos epidemiológicos, clínicos e
laboratoriais. Freqüentemente a associação de alguns desses elementos é
necessária para se chegar ao diagnóstico final.
Diante do amplo espectro de lesões produzidas pela LTA, o diagnóstico
clínico nem sempre se torna simples e imediato, mas pode ser realizado com
base nas características dessas lesões associadas a anamnese, onde os
4
dados epidemiológicos são de grande importância (Saravia et al., 1989). No
entanto, existem diversas doenças cujas formas cutâneas se assemelham às
da leishmaniose tegumentar. Dentre elas estão as úlceras traumáticas,
piodermites,
paracoccidioidomicose,
neoplasias
cutâneas,
hanseníase,
tuberculose cutânea e esporotricose, fazendo-se necessário o diagnóstico
diferencial antes do início do tratamento adequado (Furtado, 1980; Kar, 1995;
Ministério da Saúde, 2006; Barros et al., 2005).
O teste cutâneo, a intradermorreação de Montenegro (IDRM) é
largamente utilizada na rotina ambulatorial e possui um grande valor presuntivo
no diagnóstico da LTA, sendo também bastante útil nos inquéritos
epidemiológicos de áreas endêmicas (Shaw & Lainson, 1975). Esse teste
detecta reações de hipersensibilidade tardia uma vez que a resposta imune
característica da LT é do tipo celular (Carvalho et al., 1995). No entanto, a
IDRM apresenta restrições quanto a ausência de discriminação entre doença e
infecção; doença atual e pregressa, podendo permanecer positiva mesmo após
o tratamento (Montenegro, 1926); e ainda em pacientes com leishmaniose
cutânea difusa e em imunodeprimidos, o resultado tende a ser negativo. Um
outro problema apresentado em alguns pacientes foi a alergia ao diluente do
reagente do teste, o que acarretou em um resultado falso positivo na IDRM,
levando ao fabricante a trocar o thimerosal utilizado como veículo pelo fenol
(Marzochi et al., 1998; Paranhos-Silva et al., 2001; Fagundes et al., 2003).
5
1.4.1. Diagnóstico Parasitológico
Na LTA, o diagnóstico parasitológico é considerado diagnóstico de
certeza ou definitivo, pois se baseia na evidenciação do parasita através de
pesquisa direta ou indireta (Garham, 1971; Furtado, 1972).
A pesquisa direta é o procedimento de primeira escolha, por ser rápido,
de fácil execução e ter baixo custo. O material é obtido da lesão por
escarificação, punção aspirativa ou biópsia da borda (imprint), fixado em uma
lâmina de vidro e corado pelas técnicas de Giemsa ou Leishman para a
posterior visualização das formas amastigotas. A sensibilidade do método
apresenta valores que variam entre 42% (Pirmez et al., 1999), 56,4% (Weigle
et al., 2002) e 77% (Lopez et al., 1993b), devido à espécie de Leishmania
envolvida, à escassez de parasitas na lesão e também pode ser ainda menor
em lesões onde o tempo de evolução é superior a um ano (Ministério da
Saúde, 2007).
Na pesquisa indireta é realizado o cultivo dos parasitas, o qual pode ser
in vitro ou in vivo. No cultivo in vitro, o material de biópsia da lesão deve ser
inoculado diretamente em meios de cultura apropriados, estéreis, para se
tentar o isolamento do parasita, pois a freqüente contaminação fúngica e
bacteriana pode impossibilitar o diagnóstico. No cultivo in vivo, o parasita pode
ser isolado através da inoculação em animais de laboratório. Desvantagens
como o longo tempo necessário para a evolução da doença no animal, a
exigência de um espaço físico adequado para a manutenção desses animais e
a eficácia do isolamento variar conforme a espécie de Leishmania faz com que
6
não se utilize essa técnica para o diagnóstico (Melo, 1981; Ministério da Saúde,
2007).
Sob o ponto de vista histológico, as lesões de LTA, tanto cutâneas
quanto mucosas, são descritas como uma reação inflamatória crônica
granulomatosa. O infiltrado dérmico é constituído sobretudo por linfócitos,
plasmócitos e histiócitos, onde os parasitas são dificilmente encontrados
(Pessôa & Barretto, 1948; Magalhães et al., 1986). No entanto, o diagnóstico
histopatológico de certeza só é possível mediante a detecção do parasita. Caso
contrário, as alterações serão somente sugestivas do diagnóstico (Gontijo &
Carvalho, 2003).
Baixa sensibilidade, tempo elevado para a execução e necessidade de
técnicos treinados são limitações dos métodos para a evidenciação da
Leishmania. Por isso, novas técnicas para a identificação do parasita vêm
sendo utilizadas como a técnica da reação em cadeia da polimerase (PCR)
(Pirmez et al., 1999; Oliveira et al., 2003). Esta técnica consiste na amplificação
do DNA ribossomal e DNA do minicírculo do cinetoplasto provenientes de
materiais como sangue periférico e biópsias de lesões de pacientes, sendo
esses os alvos ideais pois estão presentes em múltiplas cópias e possuem
regiões conservadas e regiões variáveis (Bruijn & Barker, 1992; Meredith et al.,
1993; Uliana et al., 1994). Por ser um método com altos índices de
sensibilidade que variam de 80% (Lopez et al., 1993b), 94% (Pirmez et al.,
1999) a 100% (Oliveira et al., 2003), espera-se que a utilização dessa
ferramenta possa auxiliar em situações onde a escassez do parasita inviabilize
o isolamento, em pacientes com infecção subclínica ou em inquéritos
7
epidemiológicos (Lopez et al., 1993a; Coutinho et al., 2002; Leontides et al.,
2002). Entretanto, as exigências técnicas e o custo relativamente elevado ainda
reduzem seu emprego na rotina laboratorial.
1.4.2. Diagnóstico Sorológico
1.4.2.1. Resposta imune a Leishmania
Em 1970, Bryceson postulou que na leishmaniose experimental a
resistência à infecção é dependente da imunidade celular envolvendo linfócitos
e macrófagos. Além disso, que a interação entre estas células, associada à
produção local de fatores solúveis, poderia resultar em um efeito citotóxico
sobre os macrófagos parasitados na lesão e concomitantemente destruição
dos parasitas.
A resolução da infecção é dependente da espécie de Leishmania
envolvida e da resposta imune do hospedeiro (Coutinho et al., 1987). A partir
da década de 80, estudos mostraram a importância dos linfócitos T, CD4+ e
CD8+, na resolução da infecção (Mitchell et al., 1980; Milon et al., 1995). O
balanço entre as respostas do tipo Th1 e Th2 são fundamentais para o curso
da infecção, sendo a resistência mediada por Th1 e a susceptibilidade por Th2
(Coutinho et al., 1998; Rocha et al., 1999).
Na resposta imune humoral, a produção de anticorpos específicos antiLeishmania, independente da forma clínica, é predominantemente constituída
por imunoglobulina G (IgG). Estudos relatam baixas concentrações séricas de
imunoglobulina A (IgA) anti-Leishmania em pacientes com leishmaniose
cutâneo-mucosa (LCM), níveis moderados de imunoglobulina M (IgM) anti-
8
Leishmania nos dois primeiros meses de infecção e assim como a correlação
entre a dosagem de subclasses de IgG (IgG1, IgG2, IgG3 e IgG4) com os
diferentes perfis clínicos da doença (Guimarães et al., 1989; Guimarães et al.,
1990; O'Neil et al., 1993; Ulrich et al., 1995; Souza et al., 1998).
1.4.2.2.
Testes sorológicos
Apesar das controvérsias na literatura a respeito da sensibilidade e
especificidade das técnicas aplicadas ao imunodiagnóstico, do seu valor
limitado devido aos baixos níveis séricos de anticorpos específicos na
leishmaniose tegumentar e das reações cruzadas que ocorrem freqüentemente
com amostras de pacientes portadores de outras doenças infecciosas, os
testes sorológicos são as principais ferramentas utilizadas no diagnóstico em
situações onde a evidenciação do parasita não é possível (Roffi et al., 1980;
Teixeira & Vexenat, 1996).
Em 1919, Moses descreveu a reação de fixação de complemento (RFC),
o primeiro teste sorológico para a leishmaniose visceral. A RFC foi utilizada em
inquéritos soro-epidemiológicos e considerada importante no diagnóstico
precoce da doença e no monitoramento da eficácia do tratamento (Pampiglione
et al., 1974; Bettini et al., 1977). No entanto, o teste apresentava reações
cruzadas com outras doenças parasitárias e infecções micóticas (Manuel &
Behin, 1982).
O teste de hemaglutinação indireta foi utilizado por Cascio et al. (1963)
em pacientes também com leishmaniose visceral. Além de não haver diferença
na resposta às diversas espécies de Leishmania, o teste possui reação
9
cruzada com soros de pacientes de outras doenças como a malária,
esquistossomose, doença de chagas entre outras (Bray & Lainson, 1967;
Antunes et al., 1972).
Chaffee (1963) descreveu padrões diferentes de precipitação obtidos
através da imunodifusão dupla de Ouchterlony a partir de preparações
antigênicas de Leishmania donovani, L. tropica e L. braziliensis, porém sem
especificidade na resposta do soro com o antígeno homólogo (Bray & Lainson,
1966). A contraimuneletroforese é mais sensível que a imunodifusão e o tempo
de execução do teste é menor (Kar, 1995).
Outro teste sorológico utilizado no diagnóstico da leishmaniose é o teste
de aglutinação direta (TAD) descrito por Allain e Kagan (1975). No diagnóstico
da LV, o TAD possui limitações no que diz respeito à não distinção entre
infecção recente, de cura e reações cruzadas com soros de pacientes com
tripanosomíase africana (Harith et al., 1987). A simplicidade no preparo do
antígeno, a facilidade na execução e estabilidade dos reagentes permitiu a
recomendação deste teste quando outras técnicas não estivessem disponíveis
(Barral-Netto et al., 1986).
Diferentemente da LV, os anticorpos circulantes na leishmaniose
tegumentar não estão em concentrações suficientemente elevadas para
permitirem um excelente desempenho dos testes sorológicos acima descritos.
Por isso, somente após o advento de técnicas de marcação, como as reações
de imunofluorescência e os ensaios imunoenzimáticos, é que o papel dos
anticorpos específicos anti-Leishmania foi melhor estudado (Behforuz et al.,
1976; Anthony et al., 1980).
10
A partir de sua descrição na década de 60 por Oddo e Cascio (1963), a
reação de imunofluorescência indireta (IFI) vem sendo amplamente utilizada no
diagnóstico da LT, em área de L. (V.) braziliensis, devido à sua boa
sensibilidade, 76,4% (Souza et al., 1982), e especificidade, 85,6% e 86,2%
(Guimarães et al., 1991; Barroso-Freitas, 2006), embora apresente reações
cruzadas com pacientes de leishmaniose visceral e tripanosomíases (Camargo
& Rebonato, 1969; Furtado, 1980). Em área de L. (V.) guyanensis e em casos
isolados de infecção por L. (L.) amazonensis, a sensibilidade da IFI é menor
(Silveira et al., 1999; Ministério da Saúde, 2007).
Vários estudos foram realizados utilizando como antígenos de IFI
diferentes espécies de Leishmania tanto nas formas promastigotas quanto nas
amastigotas (Convit & Pinardi, 1969; Guimarães et al., 1974; Badaro et al.,
1983), comparando o uso de antígeno homólogo e heterólogo em relação ao
agente infeccioso (Shaw & Voller, 1964) e também a utilização de soros não
diluídos ou em diluições muito baixas visando avaliar a ocorrência de reações
cruzadas com soros de pacientes de outras doenças endêmicas (Araujo &
Mayrink, 1968).
Diversos autores observaram que os níveis dos anticorpos circulantes na
leishmaniose tegumentar diminuem ou desaparecem após o tratamento
específico ou na vigência de regressão espontânea. Esse fato possibilita a
utilização da IFI no monitoramento terapêutico e no controle de cura (Chiari et
al., 1973; Walton, 1980; Souza et al., 1982; Schubach et al., 1998).
No Brasil, o Ministério da Saúde (MS) preconiza a utilização da IFI, no
Sistema Único de Saúde (SUS), como teste de referência para o diagnóstico
11
sorológico da leishmaniose visceral humana e canina. Na LTA, a IFI e o ensaio
imunoenzimático são úteis nos casos de lesões extensas ou múltiplas e nos
casos de lesões mucosas, e devem ser realizados preferencialmente em
centros de referência (Ministério da Saúde, 2007).
1.4.2.2.1. Ensaios Imunoenzimáticos
Nos últimos anos, vários ensaios imunoenzimáticos vêm sendo descritos
para a detecção de anticorpos específicos na leishmaniose. Métodos como o
Dot-ELISA (Enzyme-Linked Immunosorbent Assay), cujo antígeno é adsorvido
em papel de nitrocelulose e o aparecimento de cor na superfície do papel
indicando positividade é facilmente observado, possui grande utilidade em
inquéritos epidemiológicos para LV podendo mesmo ser usado nas áreas
endêmicas (Pappas et al., 1983); e o immunoblotting que além de ter elevadas
sensibilidade (91%) (Brito et al., 2000) e especificidade (100%) (Brito et al.,
2000; Gonçalves et al., 2002), permite identificar perfis de proteínas antigênicas
da Leishmania reconhecidos pelos soros de indivíduos infectados. Entretanto,
seu emprego no diagnóstico é restrito por ser uma técnica que necessita de
equipamentos e reagentes próprios, sua execução é demorada e não existe
uma padronização do perfil antigênico das espécies de Leishmania.
O teste de ELISA é o mais empregado por ser um teste rápido, que
permite
automação,
possui
desempenho
semelhante
à
reação
de
imunofluorescência indireta (Engvall & Perlmann, 1972; Voller et al., 1976) e
ainda possibilita a utilização de extratos solúveis de Leishmania como antígeno
(Hommel et al., 1978; Anthony et al., 1980).
12
Os antígenos utilizados nos ensaios imunoenzimáticos são de
importância crucial para a acurácia do teste. Autores descrevem que a
utilização no ELISA de antígenos homólogos em substituição a antígenos
heterólogos no diagnóstico da LTA pode aumentar a sensibilidade e a
especificidade (Nascimento et al., 2003; Barroso-Freitas, 2006). No entanto, o
mesmo não ocorreu quando Guimarães et al. (1991) compararam extratos
antigênicos de L. braziliensis e L. major-like, não mostrando diferença na
performance entre ambos.
Ainda em relação aos antígenos, alguns estudos identificaram certas
moléculas com propriedades imunogênicas como a proteína de choque térmico
(HSP) 60 (Rey-Ladino et al., 1997), HSP83 (Celeste et al., 2004) e a
glicoproteína 63 (Bouvier et al., 1985), sendo algumas destas espécieespecíficas, como potenciais candidatas a sua utilização no imunodiagnóstico,
porém ainda não houve comprovação da eficácia dessas frações antigênicas.
Outro
parâmetro
que
pode
afetar
o
desempenho
do
ensaio
imunoenzimático é o limiar de detecção do sistema revelador. Geralmente, a
utilização de reveladores cromogênicos nos imunoensaios é sensível o
suficiente para ser usada na rotina sorológica. Todavia, quando os
constituintes-alvo estão presentes em pequenas concentrações, como os
baixos níveis de anticorpos na LTA, é necessário o uso de procedimentos
capazes de amplificar o sinal enzimático (Avrameas, 1992).
Um desses mecanismos é a utilização de reveladores que geram
produtos fluorescentes ou luminescentes. Compostos fluorescentes podem ser
13
detectados
mesmo
estando
presentes
em
quantidades
extremamente
pequenas (Avrameas & Guilbert, 1971; Ishikawa, 1973).
Na década de 60 os sistemas reveladores utilizavam radioisótopos como
moléculas de detecção. No decorrer dos anos outras moléculas foram
desenvolvidas e atualmente as mais utilizadas são as enzimas que convertem
substratos incolores em coloridos ou moléculas não fluorescentes em
fluorescentes. O ensaio é quantitativo e a intensidade da cor gerada é
proporcional à quantidade da enzima presente.
As enzimas mais utilizadas são a horseradish peroxidase (HRP) e a
fosfatase alcalina (AP). A HRP é uma glicoproteína pertencente ao grupo de
ferroprotoporfirinas e é composta por uma cadeia polipeptídica com quatro
pontes dissulfídricas e 18% de carboidratos. O pH ótimo para sua atividade é
aproximadamente 5,0, onde se liga ao peróxido de hidrogênio (H2O2)
resultando em um complexo que oxida uma variedade de aminas e fenóis
doadores de hidrogênio (Shannon et al., 1966).
O-fenilenodiamino (OPD) (C6H8N2 . HCl) é um cromógeno cuja oxidação
pela HRP-H2O2 produz 2,3-diaminofenazina (Figura 1), um composto solúvel
cuja cor varia de laranja a marrom, e após a adição de ácido sulfúrico ou
clorídrico sua intensidade pode ser medida em espectrofotômetro a 492 nm
(Bovaird et al, 1982).
14
Figura 1: Reação do o-fenilenodiamino com horseradish peroxidase peróxido de hidrogênio.
2,3-diaminofenazina
3,3’,5,5’-tetrametilbenzidina (TMB) (C16H20N2) é o cromógeno mais
utilizado nos imunoensaios onde a enzima catalisadora da reação é a HRP.
Sua oxidação (Figura 2) produz um composto de cor azul que com a
acidificação torna-se amarelo cuja absorbância é obtida a 450 nm (Frey et al.,
2000).
Figura 2: Reação da 3,3’,5,5’-tetrametilbenzidina com horseradish
peroxidase - peróxido de hidrogênio.
Fonte: Frey, A., Meckelein, B., Externest, D. and Schmidt, M. A. 2000. A stable and highly sensitive 3,3',5,5'-tetramethylbenzidine-based substrate
reagent for enzyme-linked immunosorbent assays. J Immunol Methods, 233 (1-2): 47-56.
15
Outra enzima utilizada nos ensaios imunoenzimáticos é a fosfatase
alcalina, uma metaloenzima com dois átomos de zinco por molécula. 4metilumbeliferilfosfato (MUP) (C10H9O6P) é um substrato cuja hidrólise pela
fosfatase alcalina gera um composto, 4-metilumbeliferone (Figura 3), que é
intensamente fluorescente em pH 10,3, com emissão de fluorescência a 448
nm e excitação máxima a 364 nm (Fernley & Walker, 1965) .
Figura 3: Reação do 4-metilumbeliferilfosfato com fosfatase alcalina.
Fosfatase Alcalina
4-metilumbeliferilfosfato
1.5.
4-metilumbeliferone
Avaliação de Testes Diagnósticos
Os médicos dedicam grande parte de seu tempo determinando
diagnóstico para as queixas ou anormalidades de seus pacientes. A maioria
dos bons clínicos usa juízo crítico, conhecimento amplo da literatura e um tipo
de abordagem empírica de como organizar a informação diagnóstica.
Entretanto, estabelecer um diagnóstico é um processo imperfeito resultando
em probabilidade e não em certeza de se estar correto e a utilização das leis
de probabilidade auxilia na interpretação do testes diagnósticos (Fletcher et al.,
1996).
16
Clínicos e epidemiologistas sempre solicitam exames sorológicos para o
diagnóstico e esperam resultados que sejam confiáveis, porém, em alguns
casos, os exames podem gerar informações que nem sempre são compatíveis
com o diagnóstico.
A grande quantidade de métodos e técnicas empregados nos exames
sorológicos é uma indicação da dificuldade de obtenção de resultados com
absoluta acurácia. Essa finalidade poderia ser atendida por um método
altamente sensível e específico, mas que inexiste (Teixeira & Vexenat, 1996).
Na avaliação da qualidade de testes diagnósticos são utilizados dois
conceitos: a precisão e a validade de um “teste” (OPAS, 1997).
A precisão ou confiabilidade não constitui um atributo do desenho da
investigação como um todo, e sim uma qualidade exclusiva dos instrumentos
de coleta de dados (Almeida Filho & Rouquaryol, 2002). Portanto, refere-se à
concordância dos resultados de um exame ou de um instrumento na mão de
diferentes avaliadores, em momentos distintos. A confiabilidade marca a
variação da medida, definindo a estabilidade ou consistência da mensuração.
Outras terminologias utilizadas são reprodutibilidade, quando o teste é
realizado em laboratórios e com avaliadores distintos, e repetibilidade, quando
o mesmo avaliador realiza o teste em momentos diferentes.
Os resultados gerados pelos ensaios imunoenzimáticos expressos sob a
forma de densidade óptica (DO) são variáveis contínuas e a confiabilidade
destas é medida através do Coeficiente de Correlação Intraclasse (ICC Intraclass Correlation Coefficient). O ICC combina informações sobre
correlação e diferenças sistemáticas entre leitores ou aferições, ele varia de -1
17
a 1 e quanto maior o ICC, menor a contribuição dos erros no processo de
medida na variação total .
Validade ou acurácia de um teste refere-se ao grau em que o exame é
capaz de determinar o verdadeiro valor do que está sendo medido, informa se
os resultados representam a “verdade” ou o quanto se afastam dela. Para tal,
comparam-se os resultados do teste com um “padrão-ouro”, este é o indicador
mais fiel da verdade e pode ser o verdadeiro estado do paciente, um conjunto
de exames julgados mais adequados ou uma outra forma de diagnóstico que
sirva de referência (OPAS, 1997).
Da mesma forma que o descrito para a confiabilidade, a acurácia pode
ser medida através de propriedades inerentes ao teste diagnóstico como:
•
Sensibilidade: É a capacidade do teste de detectar a doença quando
ela está de fato presente, ou seja, expressa a probabilidade de um
teste dar positivo na presença da doença (verdadeiros positivos);
•
Especificidade: É a capacidade do teste de afastar a doença quando
ela está ausente, ou seja, expressa a probabilidade de um teste dar
negativo na ausência da doença (verdadeiros negativos);
•
Valores preditivos: É a probabilidade de doença dados os resultados
de um teste diagnóstico. O valor preditivo positivo (VPP) expressa a
probabilidade de um paciente com o teste positivo ter a doença e o
valor preditivo negativo (VPN), a probabilidade de um paciente com
teste negativo não ter a doença;
•
Razão de Verossimilhança (Likelihood Ratio): É a razão entre a
probabilidade de um determinado resultado de um teste diagnóstico
18
em indivíduos portadores da doença e a probabilidade do mesmo
resultado em indivíduos sem a doença. A razão de verossimilhança
para o teste positivo (RV+) expressa quantas vezes é mais provável
encontrar um resultado positivo em pessoas doentes quando
comparado com pessoas não doentes e razão de verossimilhança
para o teste negativo (RV-), quantas vezes é mais provável encontrar
um resultado negativo em pessoas doentes quando comparado com
pessoas não doentes.
Um teste sensível é o teste de escolha quando a penalidade por deixar
de diagnosticar a doença é grande ou na fase inicial de um processo
diagnóstico onde um grande número de possibilidades está sendo considerado
e se quer reduzi-lo. Um teste específico é útil para confirmar um diagnóstico
sugerido por outros dados e é necessário quando os resultados falsos positivos
podem lesar o paciente física, emocional ou financeiramente.
Sem dúvida, é desejável dispor de um teste 100% sensível e 100%
específico que raramente é encontrado na prática, pois na tentativa de
melhorar a sensibilidade freqüentemente resulta na piora da especificidade
(OPAS, 1997). Assim, para um teste como o ensaio imunoenzimático no qual
se utilizam medidas contínuas é necessário determinar um ponto de corte (cutoff) entre os valores considerados positivos e negativos.
Uma maneira de expressar a relação entre sensibilidade e especificidade
é através da construção da curva ROC (Receiver Operator Characteristic).
Desenvolvida na década de 1950 para a análise de detecção de sinal de
radares e introduzida na área médica na década de 1960, a curva ROC se
19
tornou uma importante ferramenta na avaliação de testes diagnósticos (Zweig
& Campbell, 1993).
A curva ROC é construída plotando-se a taxa de verdadeiros positivos
(sensibilidade) contra a taxa de falsos positivos (1-especificidade) ao longo de
uma faixa de pontos de corte. Os valores nos eixos vão de uma probabilidade
de 0 a 1 (0 a 100%). Testes de bom poder discriminatório concentram-se no
canto superior esquerdo da curva ROC e testes de menor poder discriminatório
têm curvas mais próximas à diagonal que vai da esquerda inferior à direita
superior. Esta diagonal mostra a relação entres a taxa de resultados
verdadeiros positivos e falsos positivos que seria obtida por um teste que não
traz nenhuma informação diagnóstica (Fletcher et al., 1996).
Além de auxiliarem na identificação do melhor ponto de corte, as curvas
ROC são muito utilizadas para comparar dois ou mais testes diagnósticos para
a mesma doença. Nesse caso, o poder discriminatório do teste pode ser
mensurado através do cálculo da área sob a curva ROC (AUC - Area under the
ROC curve), quanto maior a AUC melhor será o teste diagnóstico.
1.5.1. Roteiro para determinar a validade de um teste diagnóstico
O delineamento de estudos para avaliar a utilidade clínica ou
populacional de testes diagnósticos deve incorporar dois aspectos. O primeiro
deles diz respeito aos princípios de randomização e mascaramento (OPAS,
1997). A randomização ou aleatorização corresponde ao processo de alocação
aleatória de pacientes ou espécimes clínicos em grupos buscando uma
distribuição equilibrada de variáveis de confundimento. E o mascaramento é
20
realizado para minimizar o viés de mensuração, impedindo o comportamento
de um modo sistemático por parte do avaliador, caso saiba que tipo de
intervenção ou confirmação diagnóstica está submetido aquele paciente ou
espécime clínica (Almeida Filho & Rouquaryol, 2002). O segundo aspecto a ser
levado em conta refere-se à prática clínica vigente como, por exemplo, se o
teste será aplicado nas mesmas condições de seu uso na rotina laboratorial
(OPAS, 1997).
Em 1999, um grupo do Cochrane Colloquium discutindo sobre a baixa
qualidade metodológica de artigos que reportavam avaliações de testes
diagnósticos, desenvolveram um roteiro de itens que deveriam ser incluídos em
trabalhos sobre estudos de acurácia diagnóstica. Esse roteiro foi denominado
STARD (Standards for Reporting of Diagnostic Accuracy) (Bossuyt et al., 2003).
O STARD inicia-se com a certificação através da identificação de
palavras-chave de que se trata de um estudo de acurácia diagnóstica seguido
de questionamentos sobre a justificativa do estudo, como vantagens na
introdução de um novo teste ou comparação de acurácia entre diversos testes
e/ou grupos participantes.
A metodologia deve contemplar os seguintes tópicos:
•
Sujeitos da pesquisa: definição da procedência e dos critérios de
elegibilidade da população a ser estudada, qual a base clínica e
laboratorial para o recrutamento, qual o critério adotado para a
definição da amostragem, é o estudo prospectivo ou retrospectivo;
•
Métodos: Etapas do processamento do teste índice e do teste de
referência,
especificações
técnicas
dos
materiais
utilizados,
21
detalhamento da interpretação dos resultados dos testes que serão
avaliados, informação sobre mascaramento na realização dos testes;
utilização de métodos estatísticos para a análise dos resultados.
Os resultados devem conter informações referentes às características
clínicas e demográficas da população do estudo e se em todos os participantes
foram aplicados os testes propostos, tabulação dos resultados do testes índice
e de referência, estimações de parâmetros de acurácia diagnóstica com
medidas de quantificação de incerteza (intervalo de confiança - IC), destino dos
resultados perdidos ou indeterminados. E finalizando, a discussão deve
abordar a aplicabilidade clínica dos achados do estudo.
22
2. JUSTIFICATIVA
No Centro de Referência em Leishmanioses (CRLeish), situado no
Instituto de Pesquisa Clínica Evandro Chagas (IPEC), foram atendidos cerca
de 230 pacientes com LTA provenientes do Estado do Rio de Janeiro entre os
anos de 2002 e 2004. Esses pacientes foram submetidos à rotina clínica e
laboratorial, na qual os métodos diagnósticos (IDRM, sorologia, histopatologia,
cultura e exame direto) são realizados.
Os testes sorológicos contribuem para o diagnóstico da LTA, apesar do
seu valor limitado devido à baixa resposta humoral e às reações cruzadas com
outras doenças (Roffi et al., 1980; Teixeira & Vexenat, 1996), com sinais
clínicos semelhantes, especialmente a esporotricose cuja incidência aumentou
recentemente no Rio de Janeiro (Barros et al., 2001; Barros et al., 2004).
Vários outros parâmetros podem afetar o desempenho dos métodos
imunoenzimáticos, como as frações antigênicas empregadas, o grau de avidez
e afinidade dos anticorpos pelos antígenos e o limiar de detecção da técnica.
Alguns autores relacionaram o aumento da sensibilidade no ensaio
imunoenzimático com o uso de reveladores fluorogênicos e sua utilização em
detrimento dos cromógenos (Shalev et al., 1980; Labrousse et al., 1982;
Rakhmanova & MacDonald, 1998).
Neste estudo, pretendeu-se comparar a acurácia de três tipos de
reveladores no ensaio imunoenzimático para LTA. Baseado na literatura foram
selecionados os cromógenos OPD (o-fenilenodiamino-Sigma®), utilizado na
rotina do nosso laboratório, o TMB (3,3’,5,5’-tetrametilbenzidina-Sigma®) e o
fluorógeno MUP (4-metilumbeliferilfosfato-Molecular Probes®), cujos limiares
23
de detecção para IgG são, respectivamente, 2; 0,3 e 0,5 ng/mL (Porstmann &
Kiessig, 1992).
A escolha do antígeno L. braziliensis a ser empregado no ensaio
imunoenzimático deste estudo decorreu ao fato desta espécie ser a mais
prevalente e identificada como etiologicamente associada a LTA no Rio de
Janeiro e, também pelos resultados de estudos de acurácia do ELISA
realizados por nosso grupo, comparando antígenos L. braziliensis e L. majorlike. Nascimento et al. (2003) observaram uma sensibilidade de 65,4% com
antígeno L. major-like e 84,4% com L. braziliensis, e especificidade de 84,4% e
91,7%,
respectivamente.
Os
resultados
de
Barroso-Freitas
(2006)
corroboraram os nossos, com sensibilidade e especificidade de 95,7% e 100%
para L. braziliensis e de 78,7% e 82,8% para L. major-like.
24
3. OBJETIVOS
3.1.
Objetivo Geral
Comparar a acurácia de três sistemas reveladores utilizados em ensaios
imunoenzimáticos para a detecção de anticorpos IgG específicos no
diagnóstico da leishmaniose tegumentar americana causada por Leishmania
(Viannia) braziliensis.
3.2.
•
Objetivos Específicos
Comparar a sensibilidade, especificidade, valores preditivos e razões de
verossimilhança dos ensaios imunoenzimáticos para os sistemas
reveladores;
•
Determinar a confiabilidade do ensaio imunoenzimático para os diferentes
sistemas reveladores;
•
Indicar o revelador mais adequado no ensaio imunoenzimático para o
diagnóstico sorológico da LTA no Serviço de Parasitologia do IPEC.
25
4. SUJEITOS E MÉTODOS
4.1.
Delineamento do Estudo
Estudo diagnóstico seccional, mascarado, randomizado, com repetições
independentes para comparação de três sistemas reveladores em ensaios
imunoenzimáticos para o diagnóstico da leishmaniose tegumentar americana,
em população de pacientes atendidos no ambulatório do CRLeish - IPEC.
4.2.
Sujeitos da Pesquisa
4.2.1. População do Estudo
A população do estudo foi constituída de pacientes atendidos no
ambulatório do CRLeish - IPEC no período de janeiro de 2003 a julho de 2005.
4.2.2. Tamanho Amostral
O tamanho amostral calculado foi de 378 indivíduos, sendo 189 em cada
grupo (casos versus controles) considerando uma sensibilidade esperada de
84% (para o método em avaliação - ensaio imunoenzimático) (Nascimento et
al., 2003); uma diferença limite de equivalência entre os dois métodos de 5%,
um nível de significância de 5% e um poder de 80% utilizando-se a fórmula de
cálculo amostral para equivalência de duas proporções. As variações de
tamanho amostral ocorreram segundo a expectativa de performance para o
teste ELISA convencional, em avaliação, e segundo a magnitude da margem
de erro admitida.
26
4.2.3. Critérios de elegibilidade e seleção da amostra
As amostras de soro incluídas no estudo foram provenientes de
pacientes atendidos no ambulatório de CRLeish e que foram submetidos ao
protocolo padrão de rotina clínica (Anexo 1) no período acima citado.
O critério de confirmação para o grupo de pacientes com LTA foi o
diagnóstico parasitológico positivo obtido através da cultura, imprint ou
histopatologia. Amostras de soro de pacientes com outras doenças cutâneas
que compõe o espectro do diagnóstico diferencial com LTA foram utilizadas
como grupo controle, e a confirmação do diagnóstico realizada pela
positividade na cultura, histopatologia ou exame direto para a dada doença.
A partir do banco de dados de pacientes do CRLeish, as amostras de
soro foram selecionadas aleatoriamente utilizando o programa EPI-Info 6.0. A
fim de que não houvesse erro na classificação, o prontuário de todos os
pacientes selecionados foi revisto para a confirmação do diagnóstico.
Dos 189 pacientes com LTA, 166 possuíam leishmaniose cutânea, 14
com leishmaniose cutâneo-mucosa e nove com a forma mucosa. No grupo
controle, o diagnóstico encontrado mais freqüente foi o de esporotricose,
seguido de piodermite, úlcera vascular, neoplasia, dermatofitose, sífilis e
paracoccidioidomicose (Tabela 1).
Para este estudo, foi considerada somente a primeira amostra de soro
coletada do paciente para diagnóstico e antes do início da terapêutica
apropriada. Todas as amostras utilizadas foram diluídas 1:2 em glicerina e
estocadas no freezer (-20ºC) no Serviço de Parasitologia, IPEC.
27
Tabela 1: Freqüência (%) dos diagnósticos no grupo controle.
Diagnóstico Diferencial
N
%
Esporotricose
158
83,6
Piodermite
14
7,4
Úlcera Vascular
11
5,9
Neoplasia
3
1,6
Dermatofitose
1
0,5
Sífilis
1
0,5
Paracoccidioidomicose
1
0,5
189
100
TOTAL
4.3.
Parasitas e antígenos utilizados nos testes
Neste estudo foram utilizados antígenos parcialmente solúveis obtidos
de
formas
promastigotas
de
Leishmania
(Viannia)
braziliensis
(MHOM/BR/75/M2903). Os parasitas foram obtidos de cultura em fase
logarítmica de crescimento, a partir de uma curva de crescimento e definiu-se o
terceiro dia como o melhor ponto para a obtenção desses parasitas (BarrosoFreitas, 2006).
4.3.1. Cultura axênica de L. (V.) braziliensis
Inicialmente, realizou-se um repique da cultura de manutenção (meio
bifásico-NNN+Schneider) para 50 mL do meio líquido utilizado para o
28
crescimento parasitário. Após três dias, a cultura foi quantificada em câmara de
Neubauer empregando-se o Azul de Trypan (0,2% em salina tamponada com
fosfatos - PBS). Um novo repique foi realizado com um inóculo inicial de 1x106
células/mL para garrafas de cultura com 250 mL do meio BHI (Brain Heart
Infusion - Difco®) suplementado com 10% de soro fetal bovino (SFB), 200
U/mL de penicilina, 200 µg/mL de estreptomicina e 1% de urina humana
(Shamsuzzaman et al., 1999). Após três dias de incubação em estufa a 2628ºC, tempo estipulado pela curva de crescimento, os parasitas foram
coletados e processados.
4.3.2. Preparação antigênica
As culturas foram transferidas para tubos cônicos estéreis de 50 mL e
centrifugados a 5500g por 10 minutos a 4ºC (Centrífuga Refrigerada Coulter
Allegra 21R - Beckman®). Descartando-se o sobrenadante, o sedimento foi
ressuspenso em PBS pH 7,2 e centrifugado novamente a 5500g por 10
minutos a 4ºC. Esse processo foi repetido três vezes. Após a última lavagem, o
sedimento foi ressuspenso em tampão de lise contendo inibidores de protease
(1mM
iodoacetamina,
1mM
phenylmethylsulphonyl
fluoride
e
1mM
phenantroline), e submetidos a 30 ciclos de congelamento (gelo seco + etanol)
e descongelamento (banho-maria à 60ºC) adicionado de duas horas de ultrasom (50/60 Hz - Transsonic 310 - Elma®) para o rompimento total dos
parasitas. A seguir, o material foi novamente centrifugado, agora a 10000g por
5 minutos a 4°C e o sobrenadante coletado para a dosagem do teor protéico
29
pelo método de Folin-Lowry (Lowry et al., 1951). O antígeno foi separado em
alíquotas e conservado a -20°C até o momento do uso.
4.4.
Protocolo técnico do ensaio imunoenzimático
Utilizou-se a metodologia descrita por Voller et al.(1976), descrita a
seguir. Placas de poliestireno de 96 poços (nº 436110 para fluorógeno e nº
439454 para cromógeno - Nunc Maxisorp®) foram sensibilizadas com 100 µL
do antígeno total parcialmente solúvel de Leishmania (V.) braziliensis na
concentração de 5 µg/mL diluído em tampão carbonato-bicarbonato pH 9,6 e
posteriormente incubadas overnight (18 horas) a 4ºC. Após quatro lavagens
com PBS pH 7,2 com 0,05% de Tween 20 (PBS-T), em lavadora automática
(Tecan - Columbus Washer®), foi adicionado em cada poço 100 µL das
amostras de soro diluídas a 1:40 em PBS-T com 1% de leite desnatado
(Molico®; PBS-TL), incubando-se por 45 minutos a 37ºC em câmara úmida.
Seguindo-se mais quatro novas lavagens, foram adicionados 100 µL de antiIgG cadeia γ-específica conjugada à peroxidase (HRP) (A3187 - Sigma®), nas
diluições de 1:4000 para OPD e 1:12000 para TMB, ou à fosfatase alcalina
(AP) (A3150 - Sigma®) na diluição de 1:150000 para MUP, diluídos em PBSTL. Após 45 minutos de incubação a 37ºC em câmara úmida e quatro novas
lavagens, foram adicionados 100 µL da solução reveladora.
•
OPD: 10 mg de OPD (P6912 - Sigma®), 10 µL de peróxido de
hidrogênio (H2O2) em 25 mL de tampão citrato-fosfato pH 5,0;
•
TMB: Solução pronta para o uso (T0440 - Sigma®);
30
•
MUP: 0,1mM de MUP (M6491 - Molecular Probes®) em tampão
dietanolamina pH 9,8.
As placas foram incubadas por 15 minutos (OPD) e 30 minutos (TMB e
MUP) na ausência de luz, interrompendo-se a reação por adição a cada poço
de 50 µL de 1N H2SO4 (OPD e TMB) e 100 µL 3N NaOH (MUP). A densidade
óptica e a fluorescência (Relative Fluorescence Units - RFU) dos poços foram
determinadas em leitor de placas (Tecan Genius®). Na leitura das placas com
os cromógenos OPD e TMB utilizaram-se os filtros com comprimento de onda
de 492 nm e 450 nm, respectivamente; e para o fluorógeno MUP os filtros de
emissão de 465 nm e excitação de 360 nm.
4.5.
Confiabilidade e Mascaramento
Para avaliar a confiabilidade dos testes, foram realizadas duas aferições
de cada amostra pelo mesmo técnico em dois momentos distintos para cada
sistema revelador. Os testes foram realizados com mascaramento das
amostras, isto é, sem que o avaliador soubesse o grupo ao qual pertencia a
amostra, se caso ou controle a fim de minimizar viés.
4.6.
Análise Estatística
A sensibilidade, especificidade, valores preditivos positivo, negativo e as
razões de verossimilhança foram calculados utilizando o Statistical Package for
the Social Science (SPSS) versão 11.0, com respectivos intervalos de
confiança de 95%. A confiabilidade do ensaio imunoenzimático foi analisada
pelo coeficiente de correlação intraclasse com intervalo de confiança de 95%.
31
Foram estabelecidos cut-offs para cada tipo de ensaio imunoenzimático
segundo o sistema revelador utilizado. Os resultados foram expressos em DO
e RFU e tratados como variáveis contínuas mediante a curva ROC. O
desempenho dos diferentes testes foi comparado através de suas curvas ROC
(AUC), utilizando-se o software MedCalc 8.2. Os valores das áreas sob a curva
foram comparados pelo teste Anova.
4.7.
Aspectos Éticos
A rotina clínica de atendimento dos pacientes, incluindo a obtenção de
espécimes clínicos para os estudos e a realização de teste de Montenegro, foi
previamente submetida ao Comitê de Ética em Pesquisa do IPEC, constituindo
o projeto: “Estudo para a sistematização do atendimento de pacientes com
Leishmaniose Tegumentar Americana no Centro de Referência em LTAInstituto de Pesquisa Clínica Evandro Chagas - FIOCRUZ”, aprovado no
CEP/IPEC sob o número 0016.0.009-02. Os pacientes assinaram um termo de
consentimento livre e esclarecido (Anexo 2) para a realização da rotina clínica
e/ou entrada no Programa de Leishmanioses do IPEC. Este estudo não
acarretou em modificações na rotina de atendimento ambulatorial de pacientes
e um termo de compromisso (Anexo 3) para manter o anonimato dos sujeitos
da pesquisa foi assinado pelos responsáveis do projeto e aprovado no
CEP/IPEC sob o número 0015.0.009.000-06 (Anexo 4).
32
5. RESULTADOS
5.1.
Diluições dos conjugados anti-IgG
Para a titulação do conjugado foram utilizadas quatro amostras de soro
positivas de pacientes confirmados parasitologicamente para leishmaniose
como controles positivos (CP) e quatro amostras de soro negativas de
indivíduos saudáveis como controles negativos (CN).
A concentração ótima para o conjugado anti-IgG HRP foi encontrada a
partir da sua diluição em 1:2000, 1:4000 e 1:8000 para o cromógeno OPD
(Figura 4) e em 1:6000, 1:12000 e 1:18000 para o TMB (Figura 5). Para o
fluorógeno MUP, diluiu-se o conjugado anti-IgG AP nas concentrações
1:50000, 1:100000, 1:150000 e 1:200000 (Figura 6). Para a definição dessas
concentrações, considerou-se a diluição com a maior razão entre a média dos
controles positivos e a média dos controles negativos.
As diluições escolhidas foram 1:4000, 1:12000 e 1:150000 para OPD,
TMB e MUP, respectivamente. A tabela 2 mostra as razões para cada diluição
e cada sistema revelador na qual derivaram a escolha das diluições do
conjugado.
33
Figura 4: Diluições do conjugado anti-IgG HRP para o cromógeno OPD.
2,200
2,000
1,800
1,600
1,400
DO 1,200
1,000
0,800
0,600
0,400
0,200
0,000
1:2000
1:4000
1:8000
Diluições do conjugado
BL
CN1
CN2
CN3
CN4
CP1
CP2
CP3
CP4
BL: Blank; CN: Controle Negativo; CP: Controle Positivo; DO: Densidade Óptica
Figura 5: Diluições do conjugado anti-IgG HRP para o cromógeno TMB.
1,600
1,400
1,200
1,000
DO
0,800
0,600
0,400
0,200
0,000
1:6000
1:12000
1:18000
Diluições do conjugado
BL
CN1
CN2
CN3
CN4
CP1
CP2
CP3
CP4
BL: Blank; CN: Controle Negativo; CP: Controle Positivo; DO: Densidade Óptica
34
Figura 6: Diluições do conjugado anti-IgG AP para o fluorógeno MUP.
50000
45000
40000
35000
RFU
30000
25000
20000
15000
10000
5000
0
1:50000
1:100000
1:150000
1:200000
Diluições dos conjugados
BL
CN1
CN2
CN3
CN4
CP1
CP2
CP3
CP4
BL: Blank; CN: Controle Negativo; CP: Controle Positivo; RFU: Unidade Relativa
de Fluorescência
Tabela 2: Razões entre as médias dos controles positivos (CP) e as
médias dos controles negativos (CN) para cada diluição do conjugado e
sistema revelador.
Revelador
Diluições
1:2000
1:4000
1:8000
Média CP
1,511
1,129
0,582
Média CN
0,374
0,156
0,139
Razão
4,0
7,2
4,2
TMB
1:6000
1:12000
1:18000
1,286
1,230
0,706
0,252
0,142
0,092
5,1
8,7
7,7
MUP
1:50000
1:100000
1:150000
1:200000
39605
37338
34443
14730
12106
8523
5556
2796
3,3
4,4
6,2
5,3
OPD
35
5.2.
Ensaios Imunoenzimáticos
Com as concentrações ótimas definidas, foram realizadas duas aferições
de cada grupo (casos e controles) para cada sistema revelador.
5.2.1. Definição dos pontos de cortes (cut-off)
Os pontos de corte (cut-off) dos imunoensaios foram definidos através
da curva ROC. A leitura de densidade óptica (DO) considerada como cut-off
para o OPD foi 0,203 e 0,239 para o TMB, e a unidade relativa de fluorescência
(RFU) para o MUP foi 11103. As figuras 7,8 e 9 representam a distribuição dos
resultados, em DO ou RFU, de cada grupo no ensaio imunoenzimático para
cada revelador (OPD, TMB E MUP, respectivamente), tendo como cut-off os
valores acima.
Figura 7: Distribuição das Densidades Ópticas no ELISA com o
cromógeno OPD nos dois grupos - LTA (N= 189) e controle (N= 189).
OPD
1,800
1,600
1,400
1,200
1,000
0,800
0,600
0,400
0,200
0,203
0,000
LTA
Controles
36
Figura 8: Distribuição das Densidades Ópticas no ELISA com o
cromógeno TMB nos dois grupos - LTA (N= 189) e controle (N= 189).
TMB
1,500
1,350
1,200
1,050
0,900
0,750
0,600
0,450
0,300
0,239
0,150
0,000
LTA
Controles
Figura 9: Distribuição das Unidades Relativas de Fluorescência nos
ensaios imunoenzimáticos com o fluorógeno MUP nos dois grupos LTA (N= 189) e controle (N= 189).
MUP
45000
40000
35000
30000
25000
20000
15000
11103
10000
5000
0
LTA
Controles
37
Os resultados nos imunoensaios das amostras de cada grupo (189
pacientes de LTA e 189 pacientes com outras doenças cutâneas) com os três
reveladores estão descritos na tabela 3. Não foram observadas diferenças com
significância estatística entre as médias das leituras obtidas para os pacientes
de leishmaniose cutânea, leishmaniose cutâneo-mucosa e leishmaniose
mucosa para os reveladores OPD (0,874; 0,940; 0,967) p= 0,505, TMB (0,820;
0,831; 0,884) p= 0,179 e MUP (25973; 28798; 29489) p= 0,180,
respectivamente. As amostras (N=5) com resultados falso-negativos foram as
mesmas em todos os sistemas reveladores.
Tabela 3: Resultados - N (%) - positivos e negativos do imunoensaio para
os diferentes grupos segundo os três reveladores.
Teste
OPD
LTA (%)
Controles (%)
Positivo
184 (97,4)
Negativo
Total
TMB
MUP
LTA (%)
Controles (%)
LTA (%)
Controles (%)
12 (6,4)
184 (97,4)
6 (3,2)
184 (97,4)
8 (4,2)
5 (2,6)
177 (93,6)
5 (2,6)
183 (96,8)
5 (2,6)
181 (95,8)
189 (100)
189 (100)
189 (100)
189 (100)
189 (100)
189 (100)
5.2.2. Acurácia dos testes
Os parâmetros de acurácia indicaram sensibilidade de 97,4% para os
três reveladores e especificidade de 93,7%, 97,4% e 95,8% para OPD, TMB e
MUP, respectivamente (Tabela 4). A utilização do TMB revelou uma
especificidade ligeiramente maior que o OPD (p= 0,082) e MUP (p= 0,397),
38
com valor preditivo positivo e negativo de 97,4%. A razão de verossimilhança
para o teste negativo foi idêntica nos três sistemas e no TMB, a razão de
verossimilhança para o teste positivo foi 36,8, ou seja, há uma chance 36,8
vezes maior de se encontrar um resultado positivo no teste em pacientes com a
doença quando comparado com pacientes sem a doença.
Tabela 4: Valores de sensibilidade, especificidade, VPP, VPN, RV+ e RVcom seus respectivos IC de 95% para cada revelador.
Revelador
Sensibilidade (%)
(IC 95%)
Especificidade (%)
(IC 95%)
VPP (%)
(IC 95%)
VPN (%)
(IC 95%)
RV
+
OPD
97,4
(93,9; 99,1)
93,7
(89,2; 96,7)
93,9
(89,3; 96,9)
97,3
(93,4;98,9)
15,3 0,03
TMB
97,4
(93,9; 99,1)
97,4
(93,9; 99,1)
97,4
(92,9; 98,7)
97,4
(93,6;99,0)
36,8 0,03
MUP
97,4
(93,9; 99,1)
95,8
(91,8; 98,1)
95,8
(91,7;98,0)
97,3
(93,5;99,0)
23,0 0,03
VPP: valor preditivo positivo; VPN: valor preditivo negativo; RV+: razão de
verossimilhança positiva; RV-: razão de verossimilhança negativa e IC:
Intervalo de Confiança
5.2.3. Comparação do desempenho dos três reveladores utilizando a curva
ROC
A área sob a curva (IC 95%) para o OPD e TMB foi idêntica 0,984
(0,966; 0,994 e 0,965; 0,994, respectivamente) e para o MUP foi 0,986 (0,968;
0,995), essa pequena diferença não atingiu significância estatística (Tabela 5).
39
RV -
A observação da figura 10 mostra que as AUC se sobrepõem independente do
tipo de revelador utilizado.
Tabela 5: Comparação das áreas sob a curva (AUC) do ensaio enzimático
com os diferentes reveladores
Diferença entre AUC
Erro padrão
p valor
0,006
IC 95% da
diferença
-0,012 a 0,013
OPD e TMB
0,000
OPD e MUP
0,002
0,007
-0,012 a 0,015
0,797
TMB e MUP
0,002
0,006
-0,009 a 0,013
0,722
0,976
Figura 10: Áreas sob a curva ROC dos três sistemas reveladores
1,0
Sensibilidade
,8
Legenda
Linha de referência
,5
MUP
,3
TMB
0,0
0,0
OPD
,3
,5
,8
1,0
1 - Especificidade
40
5.3.
Confiabilidade dos ensaios imunoenzimáticos
Para a avaliação da confiabilidade foram realizados estudos de
repetibilidade, isto é, um mesmo avaliador realizou o teste para cada amostra
em dois momentos distintos e o resultado foi analisado pelo coeficiente de
correlação intraclasse (ICC).
O valor do ICC para o OPD foi 0,993 (0,991; 0,994), 0,996 (0,995; 0,996)
para o TMB e 0,994 (0,992; 0,995) para o MUP, com seus respectivos IC de
95%. A confiabilidade foi considerada excelente para os três sistemas
reveladores.
41
6. DISCUSSÃO
O problema do diagnóstico acurado em LTA continua relevante e atual
tendo em vista que nos últimos 20 anos, a incidência de LTA vem aumentando
consideravelmente, com uma média anual de 32 mil novos casos, tornando-se
cada vez mais um grave problema de saúde pública (Ministério da Saúde,
2006).
Em nosso estudo asseguramos o padrão de referência para os casos
selecionados através do sugerido na literatura, isto é, a identificação de
amastigotas em amostras teciduais ou esfregaços, e a cultura in vitro de
parasitas presentes em biópsias (Melo, 1981; Gontijo & Melo, 2004).
Por se tratar de um estudo diagnóstico do tipo caso-controle e com
vistas a maximizar a representatividade interna da amostra, assegurou-se que
os controles fossem provenientes do mesmo ambulatório em que os casos
foram captados, e que por isso compartilharam a suspeita clínica inicial de LTA.
Outros aspectos de robustez do delineamento deste estudo foram a
randomização dos controles e o mascaramento na realização dos testes
(Bossuyt et al., 2003).
Como tem ocorrido em outros trabalhos do grupo do IPEC, a
esporotricose foi o diagnóstico diferencial mais freqüente (Barroso-Freitas,
2006) tendo em vista a ocorrência de surto no Rio de Janeiro (Barros et al.,
2001; Barros et al., 2004). Fato que contribui para a generabilidade externa
deste estudo, talvez para clientela do Estado do Rio de Janeiro.
Como preconizado em estudos diagnósticos avaliamos a confiabilidade
das técnicas realizadas. Comparando-se com um estudo para o diagnóstico da
42
LTA, nossos índices de confiabilidade (ICC: OPD - 0,993; TMB - 0,996; MUP 0,994) foram excelentes, em consonância com o encontrado por BarrosoFreitas (2006) no teste ELISA com o antígeno de L. braziliensis (ICC 0,940).
Não houve a possibilidade de pesquisar reprodutibilidade, ou seja, a análise
destas mesmas amostras em outro laboratório.
As técnicas imunoenzimáticas vêm sendo utilizadas em inúmeras
doenças, inclusive em inquéritos soro-epidemiológicos, devido a sua facilidade
e rapidez na execução, automatização, boa acurácia e baixo custo (ParanhosSilva et al., 1996; Braga et al., 1998). Este estudo se insere no âmbito da
utilização
destes
imunoensaios
no
diagnóstico
das
leishmanioses
e
especificamente no que tange aos aperfeiçoamentos quanto à busca de uma
preparação antigênica ideal para a pesquisa de anticorpos anti-Leishmania,
dos limiares de positividade das amostras (cut-off), das melhores diluições dos
conjugados enzimáticos e dos reveladores a serem utilizados (Barral-Netto et
al., 1986).
Possivelmente devido à opção por utilizar o antígeno de Leishmania
(Viannia) braziliensis nos imunoensaios, a qual é a espécie predominante no
Rio de Janeiro, obtivemos ótimos parâmetros de acurácia, independente do
revelador utilizado. Este resultado confirma estudos anteriores que também
demonstraram o aumento da acurácia dos testes pela utilização de antígenos
homólogos em detrimento dos heterólogos (Mosleh et al., 1995; Nascimento et
al., 2003; Saha et al., 2005; Barroso-Freitas, 2006).
Embora seja um item imprescindível para a execução de um ensaio
imunoenzimático e existam inúmeros tipos de reveladores disponíveis no
43
mercado, são raros os estudos que elegem o revelador como objeto de
avaliação (Shekarchi et al., 1985; Crowther et al., 1990; Roberts et al., 1991), e
não encontramos em nossa revisão de literatura estudos com este
delineamento para a pesquisa de anticorpos específicos anti-Leishmania no
diagnóstico da LTA.
Também a definição da diluição ótima dos anticorpos anti-IgG cadeia γespecífica, conjugados à peroxidase e à fosfatase alcalina que permitiria
melhor distinguir indivíduos não infectados de pacientes com LTA, é de difícil
comparação porque em estudos publicados estas decisões não têm os
métodos descritos, sendo um item rotineiro mencionado na metodologia do
teste. No estado da arte, há consenso que a determinação de diluições deva
ser determinada nas condições de cada laboratório e a cada mudança de lote,
uma vez que inúmeras variáveis influenciam o desempenho.
Apesar de alguns dados na literatura apontarem o aumento da
sensibilidade através do uso de fluorógenos (Shalev et al., 1980; Avrameas,
1992), essa afirmativa não foi observada em nossos resultados. A sensibilidade
encontrada (97,4%) em nosso estudo foi idêntica nos três sistemas
reveladores, resultado congruente com o de Crowther et al. (1990) que
utilizando os mesmos reveladores na detecção do vírus da febre aftosa
também encontraram sensibilidades similares entre o fluorógeno e o
cromógeno. E com o de Shekarchi et al. (1985), quando comparou o
cromógenos pNPP e o fluorógeno MUP para a detecção de anticorpos contra o
vírus da rubéola e antígenos do vírus herpes simplex.
44
Por outro lado, Roberts et al. (1991) detectaram melhor desempenho
com fluorógenos, utilizando os cromógenos TMB, ABTS (2,2’ - azino-bis - 3 etilbenzotiazolina - 6 - ácido sulfônico), PMP (monofosfato de fenolftaleína) e
pNPP (p-nitrofenil fosfato), e os fluorógenos HPPA (3 - p - hidroxifenil ácido
propiônico) e MUP na detecção de anticorpos anti-HIV. A sensibilidade obtida
pelo fluorógeno HPPA foi ligeiramente superior (limite de detecção 1,7 vezes
maior) ao TMB e MUP, e estes últimos foram equivalentes. O cromógeno ABTS
que segundo Bos et al. (1981) possui performance semelhante ao OPD, obteve
um desempenho inferior ao TMB.
Shekarchi et al. (1985) concluíram pela utilização de um revelador
fluorogênico para a detecção de anticorpos contra o vírus da rubéola e de
antígenos do vírus herpes simplex com base em outros parâmetros uma vez
que a acurácia foi semelhante. Foi menor o tempo de incubação necessário
para a revelação do MUP em ambos os vírus, e mais baixa a concentração de
antígeno usado na detecção dos anticorpos anti-rubéola. Não detectamos
diferenças relevantes no tempos de incubação nem na concentração de
antígeno Leishmania (V.) braziliensis que foi de 5 µg/mL em todos os sistemas
testados.
Entretanto, uma desvantagem no ensaio imunoenzimático revelado com
o fluorógeno MUP reside no rápido decréscimo na emissão do sinal de
fluorescência, exigindo que a leitura seja realizada imediatamente para não
prejudicar o resultado, e no fato do equipamento apropriado para a medição da
intensidade da fluorescência ter um custo bastante elevado, reafirmando o
benefício do uso dos cromógenos (Crowther et al., 1990; Gee et al., 1999).
45
É interessante ressaltar que obtivemos uma pequena diferença nas
especificidades para os três reveladores sem significância estatística, sendo a
mais elevada para o TMB. No entanto, uma limitação no que diz respeito ao
desenho de estudo se refere ao fato do cálculo do tamanho amostral ter sido
realizado estimando diferenças percentuais nos parâmetros de acurácia da
ordem de 5%, que foi uma estimativa maior do que as diferenças encontradas.
Do ponto de vista clínico-laboratorial uma diferença de desempenho desta
magnitude (5%) ou maior apontaria para não similaridade.
Uma vez que as acurácias dos reveladores têm sido indistinguíveis,
outros parâmetros estão sendo considerados para a escolha do sistema
revelador adequado. Assim, alguns autores propõem a utilização do TMB por
ser altamente estável e não mutagênico e/ou carcinogênico (Bos et al., 1981),
possuir baixo custo em relação aos fluorógenos, fácil manipulação (Blais et al.,
2004), disponibilidade comercial sob a forma de kits (Frey et al., 2000; Blais et
al., 2004), além de ser mais sensível que o OPD cujas propriedades
mutagênicas foram demonstradas no teste de Ames (que detecta a
citotoxicidade e mutagenicidade causadas por compostos químicos) (Voogd et
al., 1980; Porstmann & Kiessig, 1992).
Considerando os argumentos acima e a acurácia similar dos três
reveladores pretendemos substituir o OPD pelo TMB na rotina do laboratório.
46
7. CONCLUSÃO
1 - Os três reveladores (OPD, TMB e MUP) nos ensaios imunoenzimáticos
revelaram índices de sensibilidade idênticos (97,4%) e especificidade
semelhantes (OPD - 93,7%; TMB - 97,4%; MUP - 95,8%), sem diferença
estatística significante na detecção de anticorpos IgG para o diagnóstico da
LTA.
2 - O desempenho dos sistemas reveladores, comparados através da curva
ROC, mostrou uma pequena diferença entre eles, porém sem significância
estatística.
3 - A confiabilidade foi excelente nos três sistemas reveladores.
4 - A utilização do revelador TMB como escolha para sua implementação no
ensaio imunoenzimático para o diagnóstico da LTA no Serviço de Parasitologia
deve-se ao fato de ser estável, não mutagênico ou carcinogênico e de fácil
manipulação.
47
8. REFERÊNCIAS
Allain, D. S. and Kagan, I. G. 1975. A direct agglutination test for leishmaniasis.
Am J Trop Med Hyg, 24 (2): 232-6.
Almeida Filho, N. and Rouquaryol, M. Z. 2002. Introdução à Epidemiologia. 3ª
ed. Rio de Janeiro: Medsi.
Anthony, R. L., Christensen, H. A. and Johnson, C. M. 1980. Micro enzymelinked immunosorbent assay (ELISA) for the serodiagnosis of New World
leishmaniasis. Am J Trop Med Hyg, 29 (2): 190-4.
Antunes, L. J., Reis, A. P., Pereira Tavares, C. A. and Pellegrino, J. 1972.
Determination of immunoglobulins and passive hemagglutination reaction in
patients with mucocutaneous leishmaniasis. Rev Inst Med Trop Sao Paulo, 14
(3): 203-6.
Araujo, F. G. and Mayrink, W. 1968. Fluorescent antibody test in visceral
leishmaniasis. II. Studies on the specificity of the test. Rev Inst Med Trop Sao
Paulo, 10 (1): 41-5.
Avrameas, S. 1992. Amplification systems in immunoenzymatic techniques. J
Immunol Methods, 150 (1-2): 23-32.
Avrameas, S. and Guilbert, B. 1971. A method for quantitative determination of
cellular immunoglobulins by enzyme-labeled antibodies. Eur J Immunol, 1 (5):
394-6.
Badaro, R., Reed, S. G. and Carvalho, E. M. 1983. Immunofluorescent antibody
test in American visceral leishmaniasis: sensitivity and specificity of different
morphological forms of two Leishmania species. Am J Trop Med Hyg, 32 (3):
480-4.
Barral-Netto, M., Badaro, R., Barral, A. and Carvalho, E. M. 1986. Immunology
of cutaneous leishmaniasis. Rev Soc Bras Med Trop, 19 (3): 173-91.
Barros, M. B. L., Schubach, A., Francesconi-do-Valle, A. C., GutierrezGalhardo, M. C., Schubach, T. M., Conceição-Silva, F., Salgueiro, M. M.,
Mouta-Confort, E., Reis, R. S., Madeira, M. F., Cuzzi, T., Quintella, L. P., Silva
Passos, J. P., Conceição, M. J. and Marzochi, M. C. A. 2005. Positive
Montenegro skin test among patients with sporotrichosis in Rio De Janeiro. Acta
Trop, 93 (1): 41-7.
Barros, M. B. L., Schubach, A. O., Francesconi-do-Valle, A. C., GutierrezGalhardo, M. C., Conceição-Silva, F., Schubach, T. M., Reis, R. S., Wanke, B.,
Marzochi, K. B. and Conceição, M. J. 2004. Cat-transmitted sporotrichosis
epidemic in Rio de Janeiro, Brazil: description of a series of cases. Clin Infect
Dis, 38 (4): 529-35.
48
Barros, M. B. L., Schubach, T. M. P., Gutierrez-Galhardo, M. C., Schubach, A.
O., Monteiro, P. C., Reis, R. S., Zancopé-Oliveira, R. M., Lazera, M. S., CuzziMaya, T., Blanco, T. C., Marzochi, K. B., Wanke, B. and Francesconi-do-Valle,
A. C. 2001. Sporotrichosis: an emergent zoonosis in Rio de Janeiro. Mem Inst
Oswaldo Cruz, 96 (6): 777-9.
Barroso-Freitas, A. P. T. 2006. Avaliação da reação imunoenzimática (ELISA) e
imunofluorescência indireta (IFI) para o diagnóstico da leishmaniose
tegumentar americana [Mestrado]. Rio de Janeiro: Fundação Oswaldo Cruz.
Behforuz, N., Rezai, H. R. and Gettner, S. 1976. Application of
immunofluorescence for detection of antibody in Leishmania infection. Ann.
Trop. Med. Parasitol, 70: 293-301.
Bettini, S., Pampiglione, S. and Maroli, M. 1977. Studies on Mediterranean
leishmaniasis. V. A preliminary epidemiological survey of human leishmaniasis
in Tuscany. Trans. R. Soc. Trop. Med. Hyg., 71 (73).
Blais, B. W., Leggate, J., Bosley, J. and Martinez-Perez, A. 2004. Comparison
of fluorogenic and chromogenic assay systems in the detection of Escherichia
coli O157 by a novel polymyxin-based ELISA. Lett Appl Microbiol, 39 (6): 51622.
Bos, E. S., Van der Doelen, A. A., Van Rooy, N. and Schuurs, A. H. 1981.
3,3',5,5' - Tetramethylbenzidine as an Ames test negative chromogen for horseradish peroxidase in enzyme-immunoassay. J Immunoassay, 2 (3-4): 187-204.
Bossuyt, P. M., Reitsma, J. B., Bruns, D. E., Gatsonis, C. A., Glasziou, P. P.,
Irwig, L. M., Lijmer, J. G., Moher, D., Rennie, D. and de Vet, H. C. 2003.
Towards complete and accurate reporting of studies of diagnostic accuracy: the
STARD initiative. Standards for Reporting of Diagnostic Accuracy. Clin Chem,
49 (1): 1-6.
Bouvier, J., Etges, R. J. and Bordier, C. 1985. Identification and purification of
membrane and soluble forms of the major surface protein of Leishmania
promastigotes. J Biol Chem, 260 (29): 15504-9.
Bovaird, J.H., Ngo, T.T. and Lenhoff, H.M. 1982. Optimizing the ophenylenediamine assay for horseradish peroxidase: effects of phosphate and
pH, substrate and enzyme concentrations, and stopping reagents. Clin Chem,
28(12): 2423-6.
Braga, M. D., Coelho, I. C., Pompeu, M. M., Evans, T. G., MacAullife, I. T.,
Teixeira, M. J. and Lima, J. W. 1998. Control of canine visceral leishmaniasis:
comparison of results from a rapid elimination program of serum-reactive dogs
using an immunoenzyme assay and slower elimination of serum-reactive dogs
49
using filter paper elution indirect immunofluorescence. Rev Soc Bras Med Trop,
31 (5): 419-24.
Bray, R. S. and Lainson, R. 1966. The immunology and serology of
leishmanisis. IV. Results of Ouchterlony double diffusion tests. Trans R Soc
Trop Med Hyg, 60 (5): 605-9.
Bray, R. S. and Lainson, R. 1967. Studies on the immunology and serology of
leishmaniasis. V. The use of particles as vehicles in passive agglutination tests.
Trans R Soc Trop Med Hyg, 61 (4): 490-505.
Brito, M. E., Mendonça, M. G., Gomes, Y. M., Jardim, M. L. and Abath, F. G.
2000. Identification of potentially diagnostic Leishmania braziliensis antigens in
human cutaneous leishmaniasis by immunoblot analysis. Clin Diagn Lab
Immunol, 7 (2): 318-21.
Bruijn, M. H. and Barker, D. C. 1992. Diagnosis of New World leishmaniasis:
specific detection of species of the Leishmania braziliensis complex by
amplification of kinetoplast DNA. Acta Trop, 52 (1): 45-58.
Bryceson, A. D. 1970. Immunological aspects of clinical leishmaniasis. Proc R
Soc Med, 63 (10): 1056-60.
Camargo, M. E. and Rebonato, C. 1969. Cross-reactivity in fluorescence tests
for Trypanosoma and Leishmania antibodies. A simple inhibition procedure to
ensure specific results. Am J Trop Med Hyg, 18 (4): 500-5.
Carvalho, E. M., Correia Filho, D., Bacellar, O., Almeida, R. P., Lessa, H. and
Rocha, H. 1995. Characterization of the immune response in subjects with selfhealing cutaneous leishmaniasis. Am J Trop Med Hyg, 53 (3): 273-7.
Cascio, G., Purpura, A. and Prilosi, A. 1963. Test dell'emoagglutinazione
condizionata per la recerca della agglutinin anti-Leishmania. Peditria (Napoles),
71: 251.
Celeste, B. J., Angel, S. O., Castro, L. G., Gidlund, M. and Goto, H. 2004.
Leishmania infantum heat shock protein 83 for the serodiagnosis of
tegumentary leishmaniasis. Braz J Med Biol Res, 37 (11): 1591-3.
Chaffee, E. F. In: Proc. VII Int. Congr. Trop. Med. Malaria; 1963; Rio de Janeiro;
1963. p. 309.
Chiari, C. A., Mayrink, W. and Magalhães, P. A. 1973. Indirect
immunofluorescent reaction in the control and treatment of American cutaneous
leishmaniasis. Rev Inst Med Trop Sao Paulo, 15 (5): 298-303.
50
Convit, J. and Pinardi, M. E. 1969. Applying the indirect immunofluorescency
test to the study of American cutaneous leishmaniasis. Dermatol Int, 8 (1): 1720.
Costa, J. M., Netto, E. M., Vale, K. C., Osaki, N. K., Tada, M. S. and Marsden,
P. D. 1987. Spontaneous healing of cutaneous Leishmania braziliensis
braziliensis ulcers. Trans R Soc Trop Med Hyg, 81 (4): 606.
Coutinho, S. G., C., P., Mendonça, S. C. F., Conceição-Silva, F. and Dórea, R.
C. C. 1987. Pathogenesis and immunopathology of leishmaniasis. Mem Inst
Oswaldo Cruz, 82: 214-228.
Coutinho, S. G., Da-Cruz, A. M., Bertho, A. L., Santiago, M. A. and De-Luca, P.
1998. Immunologic patterns associated with cure in human American
cutaneous leishmaniasis. Braz J Med Biol Res, 31 (1): 139-42.
Coutinho, S. G., Pirmez, C. and Da-Cruz, A. M. 2002. Parasitological and
immunological follow-up of American tegumentary leishmaniasis patients. Trans
R Soc Trop Med Hyg, 96 Suppl 1: S173-8.
Crowther, J. R., Angarita, L. and Anderson, J. 1990. Evaluation of the use of
chromogenic and fluorogenic substrates in solid-phase enzyme linked
immunosorbent assays (ELISA). Biologicals, 18 (4): 331-6.
Desjeux, P. 1996. Leishmaniasis. Public health aspects and control. Clin
Dermatol, 14 (5): 417-23.
Dias, M., Mayrink, W., Deane, L. M., da Costa, C. A., Magalhães, P. A., Melo,
M. N., Batista, S. M., Araujo, F. G., Coelho, M. V. and Williams, P. 1977.
Epidemiology of mucocutaneous leishmaniasis Americana. I. Study of
reservoirs in an endemic region of the State of Minas Gerais. Rev Inst Med Trop
Sao Paulo, 19 (6): 403-10.
Engvall, E. and Perlmann, P. 1972. Enzyme-linked immunosorbent assay,
Elisa. 3. Quantitation of specific antibodies by enzyme-labeled antiimmunoglobulin in antigen-coated tubes. J Immunol, 109 (1): 129-35.
Fagundes, A., Marzochi, K. B. and Marzochi, M. C. 2003. Immediate and
generalized reaction to Montenegro skin test. Rev Soc Bras Med Trop, 36 (3):
413-4.
Fernley, H.N. and Walker, P.G. 1965. Kinetic Behaviour of Calf-Intestinal
Alkaline Phosphatase with 4-Methylumbelliferyl Phosphate. Biochem. J., 97:95103.
Fletcher, R. H., Fletcher, S. W. and Wagner, E. H. 1996. Epidemiologia Clínica:
Elementos Essenciais. 3ª ed. Porto Alegre: Artmed.
51
Frey, A., Meckelein, B., Externest, D. and Schmidt, M. A. 2000. A stable and
highly sensitive 3,3',5,5'-tetramethylbenzidine-based substrate reagent for
enzyme-linked immunosorbent assays. J Immunol Methods, 233 (1-2): 47-56.
Furtado, T. 1972. Diagnóstico Laboratorial da Leishmaniose Tegumentar
Americana. Anais Brasileiros de Dermatologia, 47: 211-228.
Furtado, T. 1980. Critérios para diagnóstico da LTA. Anais Brasileiros de
Dermatologia, 65: 51-86.
Garham, P. 1971. The genus Leishmania. Bull. Org. Mond. Santé, 44: 477-491.
Gee, K. R., Sun, W. C., Bhalgat, M. K., Upson, R. H., Klaubert, D. H., Latham,
K. A. and Haugland, R. P. 1999. Fluorogenic substrates based on fluorinated
umbelliferones for continuous assays of phosphatases and betagalactosidases. Anal Biochem, 273 (1): 41-8.
Gonçalves, C. C., Reiche, E. M., Abreu Filho, B. A., Silveira, T. G., Felizardo, T.
C., Maia, K. R., Costacurta, R., Padovesi, E. J., Dias Filho, B. P., Jankevicius,
S. I. and Jankevicius, J. V. 2002. Evaluation of antigens from various
Leishmania species in a Western blot for diagnosis of American tegumentary
leishmaniasis. Am J Trop Med Hyg, 66 (1): 91-102.
Gontijo, B. and Carvalho, M. L. 2003. American cutaneous leishmaniasis. Rev
Soc Bras Med Trop, 36 (1): 71-80.
Gontijo, C. M. F. and Melo, M. N. 2004. Leishmaniose Visceral no Brasil:
quadro atual, desafios e perspectivas. Revista Brasileira de Epidemiologia, 7
(3): 338-349.
Grimaldi, G., Jr. and McMahan-Pratt, D. 1991. Leishmaniasis and its etiologic
agents in the New World: an overview. Prog Clin Parasitol, 2: 73-118.
Guimarães, M. C., Celeste, B. J., Corrales, E. M. and Antunes, C. M. 1991.
Comparison on the performance of Leishmania major-like and Leishmania
braziliensis braziliensis as antigen for New World leishmaniasis IgGimmunofluorescence test. Rev Inst Med Trop Sao Paulo, 33 (6): 503-8.
Guimarães, M. C., Celeste, B. J. and Franco, E. L. 1990. Diagnostic
performance indices for immunofluorescent tests and enzyme immunoassays of
leishmaniasis sera from northern and north-eastern Brazil. Bull World Health
Organ, 68 (1): 39-43.
Guimarães, M. C., Celeste, B. J., Franco, E. L., Cuce, L. C. and Belda, W., Jr.
1989. Evaluation of serological diagnostic indices for mucocutaneous
leishmaniasis: immunofluorescence tests and enzyme-linked immunoassays for
IgG, IgM and IgA antibodies. Bull World Health Organ, 67 (6): 643-8.
52
Guimarães, M. C., Giovannini, V. L. and Camargo, M. E. 1974. Antigenic
standardization for mucocutaneous leishmaniasis immunofluorescence test.
Rev Inst Med Trop Sao Paulo, 16 (3): 145-8.
Harith, A. E., Kolk, A. H., Kager, P. A., Leeuwenburg, J., Faber, F. J., Muigai,
R., Kiugu, S. and Laarman, J. J. 1987. Evaluation of a newly developed direct
agglutination test (DAT) for serodiagnosis and sero-epidemiological studies of
visceral leishmaniasis: comparison with IFAT and ELISA. Trans R Soc Trop
Med Hyg, 81 (4): 603-6.
Hommel, M., Peters, W., Ranque, J., Quilici, M. and Lanotte, G. 1978. The
micro-ELISA technique in the serodiagnosis of visceral leishmaniasis. Ann Trop
Med Parasitol, 72 (3): 213-18.
Ishikawa, E. 1973. Enzyme immunoassay of insulin by fluorimetry of the insulinglucoamylase complex. J Biochem (Tokyo), 73 (6): 1319-21.
Junqueira Pedras, M., Orsini, M., Castro, M., Passos, V. M. and Rabello, A.
2003. Antibody subclass profile against Leishmania braziliensis and Leishmania
amazonensis in the diagnosis and follow-up of mucosal leishmaniasis. Diagn
Microbiol Infect Dis, 47 (3): 477-85.
Kar, K. 1995. Serodiagnosis of leishmaniasis. Crit Rev Microbiol, 21 (2): 123-52.
Killick-Kendrick, R. 1990a. The life-cycle of Leishmania in the sandfly with
special reference to the form infective to the vertebrate host. Ann Parasitol Hum
Comp, 65 Suppl 1: 37-42.
Killick-Kendrick, R. 1990b. Phlebotomine vectors of the leishmaniases: a
review. Med Vet Entomol, 4 (1): 1-24.
Labrousse, H., Guesdon, J. L., Ragimbeau, J. and Avrameas, S. 1982.
Miniaturization of beta-galactosidase immunoassays using chromogenic and
fluorogenic substrates. J Immunol Methods, 48 (2): 133-47.
Lainson, R., Ryan, L. and Shaw, J. J. 1987a. Infective stages of Leishmania in
the sandfly vector and some observations on the mechanism of transmission.
Mem Inst Oswaldo Cruz, 82 (3): 421-4.
Lainson, R., Shaw, J. J. and Silveira, F. T. 1987b. Dermal and visceral
leishmaniasis and their causative agents. Trans R Soc Trop Med Hyg, 81 (4):
702-3.
Leontides, L. S., Saridomichelakis, M. N., Billinis, C., Kontos, V., Koutinas, A.
F., Galatos, A. D. and Mylonakis, M. E. 2002. A cross-sectional study of
Leishmania spp. infection in clinically healthy dogs with polymerase chain
reaction and serology in Greece. Vet Parasitol, 109 (1-2): 19-27.
53
Lopez, M., Inga, R., Cangalaya, M., Echevarria, J., Llanos-Cuentas, A., Orrego,
C. and Arevalo, J. 1993a. Diagnosis of Leishmania using the polymerase chain
reaction: a simplified procedure for field work. Am J Trop Med Hyg, 49 (3): 34856.
Lopez, M., Inga, R., Cueva, N., Alvarez, E. and Arevalo, J. 1993b. PCR: a tool
for diagnosis of American tegumentary leishmaniasis in a health post of rural
endemic areas. Arch Inst Pasteur Tunis, 70 (3-4): 499-504.
Lowry, O. H., Rosebrough, N. J., Farr, A. L. and Randall, R. J. 1951. Protein
measurement with the Folin phenol reagent. J Biol Chem, 193 (1): 265-75.
Magalhães, A. V., Moraes, M. A., Raick, A. N., Llanos-Cuentas, A., Costa, J.
M., Cuba, C. C. and Marsden, P. D. 1986. Histopathology of tegumentary
leishmaniasis caused by Leishmania braziliensis braziliensis. 3. Cellular
reactions in tissues. Rev Inst Med Trop Sao Paulo, 28 (5): 300-11.
Manuel, J. and Behin, R. Leishmaniasis: immunity, immunopathology and
immunodiagnosis. In: Immunology of Parasitic Infections. Boston: Blackwell
Scientific; 1982. p. 299.
Marsden, P. D. 1985. Clinical presentations of Leishmania braziliensis
braziliensis. Parasitol Today, 1 (5): 129-33.
Marsden, P. D., Netto, E. M., Badaro, R., Cuba, C. A., Costa, J. L. and Barreto,
A. C. 1986. Apparent cure of a difficult treatment problem in a patient with
mucosal leishmaniasis. Am J Trop Med Hyg, 35 (2): 449.
Marsden, P. D. and Nonato, R. R. 1975. Mucocutaneous leishmaniasis: review
of clinical aspects. Rev Soc Bras Med Trop, 10: 309-326.
Marzochi, K. B., Marzochi, M. A., Silva, A. F., Grativol, N., Duarte, R., Confort,
E. M. and Modabber, F. 1998. Phase 1 study of an inactivated vaccine against
American tegumentary leishmaniasis in normal volunteers in Brazil. Mem Inst
Oswaldo Cruz, 93 (2): 205-12.
Marzochi, M. C. and Marzochi, K. B. 1994. Tegumentary and visceral
leishmaniases in Brazil: emerging anthropozoonosis and possibilities for their
control. Cad Saúde Publica, 10 Suppl 2: 359-75.
Melo, M. N. 1981. Cultivation of Leishmania in chemically defined media. Trans
R Soc Trop Med Hyg, 75 (5): 756.
Meredith, S. E., Zijlstra, E. E., Schoone, G. J., Kroon, C. C., van Eys, G. J.,
Schaeffer, K. U., el-Hassan, A. M. and Lawyer, P. G. 1993. Development and
application of the polymerase chain reaction for the detection and identification
of Leishmania parasites in clinical material. Arch Inst Pasteur Tunis, 70 (3-4):
419-31.
54
Milon, G., Del Giudice, G. and Louis, J. A. 1995. Immunobiology of
experimental cutaneous leishmaniasis. Parasitol Today, 11 (7): 244-7.
Ministério da Saúde. 2007. Manual de Vigilância da Leishmaniose Tegumentar
Americana. 2ª ed., Brasília: Editora do Ministério da Saúde, 182 p. (Série A.
Normas e Manuais Técnicos)
Ministério da Saúde. 2006. Atlas de Leishmaniose Tegumentar Americana Diagnósticos Clínico e Diferencial. 2ª ed., Brasília: Editora do Ministério da
Saúde, 136 p. (Série A. Normas e Manuais Técnicos)
Mitchell, G. F., Curtis, J. M., Handman, E. and McKenzie, I. F. 1980. Cutaneous
leishmaniasis in mice: disease patterns in reconstituted nude mice of several
genotypes infected with Leishmania tropica. Aust J Exp Biol Med Sci, 58 (5):
521-32.
Montenegro, J. 1926. Cutaneous reaction in leishmaniasis. Archives of
dermatology and Syphiology, 13: 187.
Moses, A. 1919. De fixaca do complemento na leishmaniose tegumentar. Bras.
Med., 33 (107).
Mosleh, I. M., Saliba, E. K., al-Khateeb, M. S., Bisharat, Z., Oumeish, O. Y. and
Bitar, W. 1995. Serodiagnosis of cutaneous leishmaniasis in Jordan using
indirect fluorescent antibody test and the enzyme-linked immunosorbent assay.
Acta Trop, 59 (2): 163-72.
Nascimento, L. D., Schubach, A. O., Freitas, A. P. T. B., Madeira, M. F., Duarte,
R., Marzochi, M. C. A. and Confort, E. M. 2003. Análise retrospectiva de ELISA
com antígenos de L. major e L. braziliensis em soros de pacientes com
leishmaniose tegumentar americana (LTA) do Estado do Rio de Janeiro. Anais
do XVIII Congresso Brasileiro de Parasitologia: 58.
Oddo, F. G. and Cascio, G. 1963. The Immuno-Fluorescence Test in Visceral
and Cutaneous Leishmaniasis. Riv Ist Sieroter Ital, 38: 139-45.
Oliveira, C. I., Bafica, A., Oliveira, F., Favali, C. B., Correa, T., Freitas, L. A.,
Nascimento, E., Costa, J. M. and Barral, A. 2003. Clinical utility of polymerase
chain reaction-based detection of Leishmania in the diagnosis of American
cutaneous leishmaniasis. Clin Infect Dis, 37 (11): e149-53.
Oliveira-Neto, M. P., Mattos, M., Souza, C. S., Fernandes, O. and Pirmez, C.
1998. Leishmaniasis recidiva cutis in New World cutaneous leishmaniasis. Int J
Dermatol, 37 (11): 846-9.
Oliveira-Neto, M. P., Mattos, M. S., Perez, M. A., Da-Cruz, A. M., Fernandes,
O., Moreira, J., Goncalves-Costa, S. C., Brahin, L. R., Menezes, C. R. and
55
Pirmez, C. 2000. American tegumentary leishmaniasis (ATL) in Rio de Janeiro
State, Brazil: main clinical and epidemiologic characteristics. Int J Dermatol, 39
(7): 506-14.
Oliveira-Neto, M. P., Pirmez, C., Rangel, E., Schubach, A. and Grimaldi Junior,
G. 1988. An outbreak of American cutaneous leishmaniasis (Leishmania
braziliensis braziliensis) in a periurban area of Rio de Janeiro city, Brazil: clinical
and epidemiological studies. Mem Inst Oswaldo Cruz, 83 (4): 427-35.
O'Neil, C. E., Labrada, M. and Saravia, N. G. 1993. Leishmania (Viannia)
panamensis-specific IgE and IgA antibodies in relation to expression of human
tegumentary leishmaniasis. Am J Trop Med Hyg, 49 (2): 181-8.
OPAS. 1997. Métodos de investigação epidemiológica em doenças
transmissíveis. 1ª ed. Brasília: Organização Pan-Americana de Saúde e
Fundação Nacional de Saúde.
Pampiglione, S., La Placa, M. and Schlick, C. 1974. Studies on Mediterranean
leishmaniasis. I. An outbreak of visceral leishmaniasis in northern Italy. Trans.
R. Soc. Trop. Med. Hyg., 68 (349).
Pappas, M. G., Hajkowski, R. and Hockmeyer, W. T. 1983. Dot enzyme-linked
immunosorbent assay (Dot-ELISA): a micro technique for the rapid diagnosis of
visceral leishmaniasis. J Immunol Methods, 64 (1-2): 205-14.
Paranhos-Silva, M., Freitas, L. A., Santos, W. C., Grimaldi, G. J., Pontes-deCarvalho, L. C. and Oliveira-dos-Santos, A. J. 1996. A cross-sectional
serodiagnostic survey of canine leishmaniasis due to Leishmania chagasi. Am J
Trop Med Hyg, 55 (1): 39-44.
Paranhos-Silva, M., Pontes-de-Carvalho, L. C., Sá Oliveira, G. G., Nascimento,
E. G. and dos-Santos, W. L. 2001. Skin reactions to thimerosal and Leishmania
in dogs from a leishmaniasis endemic area: it is better to keep them apart. Mem
Inst Oswaldo Cruz, 96 (5): 679-81.
Pessôa, S. B. and Barretto, M. P. 1948. Leishmaniose Tegumentar Americana:
Ministério da Educação e Saúde.
Pirmez, C., da Silva Trajano, V., Oliveira-Neto, M. P., da-Cruz, A. M.,
Goncalves-da-Costa, S. C., Catanho, M., Degrave, W. and Fernandes, O. 1999.
Use of PCR in diagnosis of human american tegumentary leishmaniasis in Rio
de Janeiro, Brazil. J Clin Microbiol, 37 (6): 1819-23.
Porstmann, T. and Kiessig, S. T. 1992. Enzyme immunoassay techniques. An
overview. J Immunol Methods, 150 (1-2): 5-21.
56
Rakhmanova, V. A. and MacDonald, R. C. 1998. A microplate fluorimetric assay
for transfection of the beta-galactosidase reporter gene. Anal Biochem, 257 (2):
234-7.
Rey-Ladino, J. A., Joshi, P. B., Singh, B., Gupta, R. and Reiner, N. E. 1997.
Leishmania major: molecular cloning, sequencing, and expression of the heat
shock protein 60 gene reveals unique carboxy terminal peptide sequences. Exp
Parasitol, 85 (3): 249-63.
Roberts, I. M., Jones, S. L., Premier, R. R. and Cox, J. C. 1991. A comparison
of the sensitivity and specificity of enzyme immunoassays and time-resolved
fluoroimmunoassay. J Immunol Methods, 143 (1): 49-56.
Rocha, P. N., Almeida, R. P., Bacellar, O., Jesus, A. R., Filho, D. C., Filho, A.
C., Barral, A., Coffman, R. L. and Carvalho, E. M. 1999. Down-regulation of Th1
type of response in early human American cutaneous leishmaniasis. J Infect
Dis, 180 (5): 1731-4.
Roffi, J., Dedet, J. P., Desjeux, P. and Garre, M. T. 1980. Detection of
circulating antibodies in cutaneous leishmaniasis by enzyme-linked
immunosorbent assay (ELISA). Am J Trop Med Hyg, 29 (2): 183-9.
Saha, S., Mazumdar, T., Anam, K., Ravindran, R., Bairagi, B., Saha, B.,
Goswami, R., Pramanik, N., Guha, S. K., Kar, S., Banerjee, D. and Ali, N. 2005.
Leishmania
promastigote
membrane
antigen-based
enzyme-linked
immunosorbent assay and immunoblotting for differential diagnosis of Indian
post-kala-azar dermal leishmaniasis. J Clin Microbiol, 43 (3): 1269-77.
Saravia, N. G., Valderrama, L., Labrada, M., Holguin, A. F., Navas, C., Palma,
G. and Weigle, K. A. 1989. The relationship of Leishmania braziliensis
subspecies and immune response to disease expression in New World
leishmaniasis. J Infect Dis, 159 (4): 725-35.
Schubach, A., Marzochi, M. C., Cuzzi-Maya, T., Oliveira, A. V., Araujo, M. L.,
Oliveira, A. L., Pacheco, R. S., Momen, H., Conceição-Silva, F., Coutinho, S. G.
and Marzochi, K. B. 1998. Cutaneous scars in American tegumentary
leishmaniasis patients: a site of Leishmania (Viannia) braziliensis persistence
and viability eleven years after antimonial therapy and clinical cure. Am J Trop
Med Hyg, 58 (6): 824-7.
Shalev, A., Greenberg, A. H. and McAlpine, P. J. 1980. Detection of attograms
of antigen by a high-sensitivity enzyme-linked immunoabsorbent assay (HSELISA) using a fluorogenic substrate. J Immunol Methods, 38 (1-2): 125-39.
Shamsuzzaman, S. M., Furuya, M., Korenaga, M., Imamura, K. and Hashiguchi,
Y. 1999. Use of urine samples from healthy humans, nephritis patients or other
animals as an alternative to foetal calf serum in the culture of Leishmania (L.)
donovani in vitro. Ann Trop Med Parasitol, 93 (6): 613-20.
57
Shannon, L.M., Kay, E. and Lew, J.Y. 1966. Peroxidase isozymes from
horseradish roots. I. Isolation and physical properties. J Biol Chem., 241(9):
2166-72.
Shaw, J. J. and Lainson, R. 1975. Leishmaniasis in Brazil: X. Some
observations of intradermal reactions to different trypanosomatid antigens of
patients suffering from cutaneous and mucocutaneous leishmaniasis. Trans R
Soc Trop Med Hyg, 69 (3): 323-35.
Shaw, J. J. and Voller, A. 1964. The detection of circulating antibody to KalaAzar by means of immunofluorescent techniques. Trans R Soc Trop Med Hyg,
58: 349-52.
Shekarchi, I. C., Sever, J. L., Nerurkar, L. and Fuccillo, D. 1985. Comparison of
enzyme-linked immunosorbent assay with enzyme-linked fluorescence assay
with automated readers for detection of rubella virus antibody and herpes
simplex virus. J Clin Microbiol, 21 (1): 92-6.
Silveira, T. G., Arraes, S. M., Bertolini, D. A., Teodoro, U., Lonardoni, M. V.,
Roberto, A. C., Ramos, M., Nerilo Sobrinho, A., Ishikawa, E. and Shaw, J.
1999. The laboratory diagnosis and epidemiology of cutaneous leishmaniasis in
Parana State, southern Brazil. Rev Soc Bras Med Trop, 32 (4): 413-23.
Souza, W. J., Coutinho, S. G., Marzochi, M. C., Toledo, L. M. and Gottlieb, M.
V. 1982. Use of the indirect immunofluorescence test in the therapeutic followup of cutaneous leishmaniasis americana. Mem Inst Oswaldo Cruz, 77 (3): 24753.
Souza, W. J., Santos, J. R., Medeiros, S. M., Schubach, A., Da-Cruz, A. M. and
Coutinho, S. G. 1998. Leishmanioses: Reação de imunofluorescência indireta
para pesquisa de anticorpos IgM em frações de soros separadas por
cromatografia de gel filtração. Jornal Brasileiro de Patologia, 34: 280-285.
Teixeira, A. R. and Vexenat, A. C. 1996. The true significance of serological
exams in the diagnosis of endemic diseases. Rev Soc Bras Med Trop, 29 (4):
379-82.
Uliana, S. R., Nelson, K., Beverley, S. M., Camargo, E. P. and Floeter-Winter,
L. M. 1994. Discrimination amongst Leishmania by polymerase chain reaction
and hybridization with small subunit ribosomal DNA derived oligonucleotides. J
Eukaryot Microbiol, 41 (4): 324-30.
Ulrich, M., Rodriguez, V., Centeno, M. and Convit, J. 1995. Differing antibody
IgG isotypes in the polar forms of leprosy and cutaneous leishmaniasis
characterized by antigen-specific T cell anergy. Clin Exp Immunol, 100 (1): 548.
58
Voller, A., Bidwell, D. E. and Bartlett, A. 1976. Enzyme immunoassays in
diagnostic medicine. Theory and practice. Bull World Health Organ, 53 (1): 5565.
Voogd, C. E., Van der Stel, J. J. and Jacobs, J. J. 1980. On the mutagenic
action of some enzyme immunoassay substrates. J Immunol Methods, 36 (1):
55-61.
Walton, B. C. 1980. Evaluation of chemotherapy of American leishmaniasis by
the indirect fluorescent antibody test. Am J Trop Med Hyg, 29 (5): 747-52.
Weigle, K. and Saravia, N. G. 1996. Natural history, clinical evolution, and the
host-parasite interaction in New World cutaneous Leishmaniasis. Clin Dermatol,
14 (5): 433-50.
Weigle, K. A., Labrada, L. A., Lozano, C., Santrich, C. and Barker, D. C. 2002.
PCR-based diagnosis of acute and chronic cutaneous leishmaniasis caused by
Leishmania (Viannia). J Clin Microbiol, 40 (2): 601-6.
World Health Organization. 1998. Leishmania and HIV in Gridlock. World Health
Organ and Joint United Nations Programme on HIV/AIDS: 27.
Zweig, M. H. and Campbell, G. 1993. Receiver-operating characteristic (ROC)
plots: a fundamental evaluation tool in clinical medicine. Clin Chem, 39 (4): 56177.
59
9. ANEXOS
Anexo 1 - Protocolo de Atendimento Clínico do Projeto “Estudo para a
sistematização do atendimento de pacientes com Leishmaniose Tegumentar
Americana no Centro de Referência em LTA - Instituto de Pesquisa Clínica
Evandro Chagas - Fiocruz”, CEP/IPEC nº 0016.0.009-02.
Centro de Referência em Leishmaniose Tegumentar Americana
Instituto de Pesquisa Clínica Evandro Chagas – Fiocruz
Rotina para o atendimento de pacientes
Critério Clínico para encaminhamento de pacientes para o IPEC
Paciente proveniente de área endêmica ou suspeita; apresentando lesão
cutânea ulcerosa ou tuberosa, única ou múltipla, com evolução superior a 30
dias; com ou sem adenopatia associada e reação de Montenegro positiva
(superior a 5 mm de enduração).
Outros pacientes provenientes de área endêmica, porém, de difícil
diagnóstico: apresentando lesões sugestivas e reação de Montenegro negativa;
adenomegalia localizada sem lesão cutânea; má resposta ou recidiva após um
primeiro tratamento para LTA.
Rotina para Diagnóstico Clínico-Laboratorial (pré-tratamento)
Avaliação clínica e dermatológica: Exame clínico geral e exame
dermatológico com descrição e documentação fotográfica ou filmagem das
lesões.
Avaliação otorrinolaringológica: Realizada com fibra ótica, para descrição e
documentação fotográfica ou filmagem das lesões.
Sangue:
Resposta linfoproliferativa a antígenos de Leishmania e S. schenckii "in vitro"
Reação em cadeia da polimerase (PCR) para Leishmania
Sorologias para LTA, VDRL, paracoccidioidomicose, histoplasmose,
esporotricose
Eletroforese de hemoglobina (úlceras de perna)
Hemograma
Bioquímica: glicose, uréia, creatinina, TGO, TGP, fosfatase alcalina, gama GT,
amilase, lipase
Coagulograma (pacientes com indicação de biópsia mucosa)
60
Eletrocardiograma (ECG)
Reações intradérmicas: PPD, esporotriquina e Montenegro (nos casos
negativos inicialmente)
Utiliza-se a leishmanina produzida por Biomanguinhos – Fiocruz, contendo 40
µg de nitrogênio protéico por mililitro e fenol 0,4% como conservante. Após
assepsia local com álcool 70o, injeta-se 0,1 mL de antígeno por via intradérmica
na face anterior do antebraço. O grau de resposta cutânea é medido 48 horas
após a injeção. A enduração é marcada com caneta esferográfica, medida em
milímetros, decalcada em papel umedecido e arquivada no prontuário do
paciente. Uma enduração de 5 mm ou mais em seu maior diâmetro é
considerada positiva.
Aspirado do bordo da lesão cutânea e / ou de gânglio periférico:
Direto no tubo a vácuo (cultura para Leishmania)
Após injeção de 0,1 mL de salina estéril (com antibiótico) 0,9% no tubo à vácuo
(cultura para Leishmania)
Biópsia cutânea e/ou mucosa e / ou de gânglio periférico:
Formol (histopatologia e imunohistoquímica)
Solução salina estéril (cultura para fungos e micobactéria)
Solução salina estéril com antibiótico (cultura para Leishmania)
Imprint em lâmina de vidro
Congelação a –70 oC (imunopatologia e reação em cadeia da polimerase PCR)
Radiografia do tórax e dos seios da face: direcionados pela história e/ou
exame clínico (rotina apenas nos casos mucosos)
Outros exames: direcionados pela história e/ou exame clínico
Tratamento Padrão
Medidas Gerais:
Tratamentos para outras doenças concomitantes como hipertensão arterial,
diabetes etc. deverão, preferencialmente, ser iniciados antes ou durante a
investigação diagnóstica, a fim de se iniciar o tratamento específico com o
paciente o mais compensado possível.
A infecção secundária deverá ser tratada com cuidados locais (água, sabão
de coco e anti-sépticos) e, se necessário, antibióticos orais, pelo menos, na
semana que anteceder à biópsia de pele, a fim de diminuir a contaminação
bacteriana das culturas para Leishmania.
No caso da presença de crostas e obstrução nasal, as cavidades nasais
deverão ser instiladas com solução fisiológica de cloreto de sódio 0,9% por
várias vezes ao dia durante todo o período do acompanhamento, a fim de
possibilitar uma boa visualização das mucosas das cavidades nasais, assim
como o alívio sintomático do paciente.
61
Nos casos de lesões abaixo dos joelhos, o repouso com os membros
inferiores elevados durante o maior tempo possível, é um excelente método
terapêutico auxiliar.
Medidas específicas:
Em princípio, todos os pacientes deverão ser tratados, ambulatorialmente,
com antimoniato de N-metil-glucamina (Glucantime®) na dosagem de 5 mg
A administração EV, quando indicada para diminuir o
Sb5+/kg/dia1 IM.
desconforto local, deverá ser realizada, de preferência, em ambiente hospitalar.
Pacientes idosos ou apresentando outras complicações clínicas, poderão ser
tratados em regime de internação ou de hospital-dia.
O antimoniato de N-metil-glucamina (antimoniato de meglumina) é
apresentado em ampolas de 5 mL contendo 1,5g de N-metil-glucamina,
equivalente a 405 mg de Sb5+. Portanto, 5 mL correspondem a 405 mg de Sb5+
e cada mL a 81 mg de Sb5+.
Os pacientes com a forma cutânea serão tratados inicialmente durante 30
dias. Caso seja indicado, o tratamento poderá ser prorrogado, na mesma
dosagem, por mais 10 a 30 dias consecutivos (ver acompanhamento clínico).
Os pacientes com a forma mucosa serão tratados por um mínimo de 30
dias, porém o tratamento será continuado, preferencialmente sem interrupção,
até a epitelização e/ou desinfiltração das mucosas.
Pacientes com lesões na laringe ou com extensas lesões nas vias aéreas e
digestivas superiores deverão ser internados a fim de prevenir a instalação de
um quadro de insuficiência respiratória por edema local, mais provável de
ocorrer nas primeiras 72 horas após início do tratamento. A profilaxia com
corticosteróides deverá ser iniciada antes da primeira dose do tratamento
específico. Utiliza-se hidrocortisona 100 mg EV 6/6h durante um mínimo de 24
horas e descontinuada durante os próximos dois dias,
Pacientes que necessitem interromper temporariamente o tratamento por
toxicidade, ao recomeçar, deverão dar seqüência ao tratamento a partir da
última dose administrada, como se não tivesse havido qualquer interrupção.
Os casos de lesões recidivantes e as possíveis evoluções para forma
mucosa (ver acompanhamento clínico), deverão ser retratadas, inicialmente,
com a mesma dosagem e pelo mesmo período que os pacientes virgens de
tratamento, porém se possível, em regime de internação ou hospital-dia.
Em caso de insucesso no segundo tratamento, avaliar a possibilidade de
utilização da dose de 10-20 mg Sb5+/kg/dia1 ou de outra droga como a
anfotericina B ou a pentamidina.
A anfotericina B deverá ser diluída em solução de glicose 5% a uma
concentração de 0,1 mg/mL (não utilizar soluções contendo eletrólitos). A
administração deve ser diária ou em dias alternados, por um período de 1 a 4
horas de infusão endovenosa.
A dose inicial é de 0,3-0,5 mg/Kg/dia
aumentando-se progressivamente até 1 mg/Kg/dia, até alcançar a dose
1
Exemplo de cálculo de dose para um paciente de 60 kg:
5 mg Sb5+/kg/dia = 300 mg Sb5+/dia = 3,7 mL/dia, arredondando, = 3,5 mL/dia EV ou IM.
20 mg Sb5+/kg/dia = 1200 mg Sb5+/dia = 14,8 mL/dia, arredondando, = 15 mL/dia EV ou IM.
62
máxima diária de 50 mg. As doses totais recomendadas são de 1 a 1,5g para
LC e, de 2,5 a 3g para LM.
A Pentamidina pode ser encontrada sob a formulação de mesilato e de
isotionato, em frascos/ampolas contendo 300 mg. A formulação de isotionato
costuma ser melhor tolerado. A droga deve ser administrada após a
alimentação devido a sua ação hipoglicemiante. A dose habitual é de 2-4
mg/Kg, IM, em dias alternados durante 5 a 25 semanas, ou por período mais
prolongado se necessário. O Ministério da Saúde recomenda que a dose total
não ultrapasse 2g e alguns autores têm utilizado esquemas curtos com
sucesso.
Pacientes com uma ou duas lesões cutâneas, que por qualquer motivo
apresentem impossibilidade de receber medicação parenteral regular ou que
apresentem sinais de toxicidade importante à medicação sistêmica, poderão
ser submetidos a tratamento intralesional com N-metil-glucamina.
Rotina de Acompanhamento
Exames laboratoriais para monitorização da toxicidade:
Hemograma, glicose, uréia, creatinina, TGO, TGP, fosfatase alcalina, gama
GT, amilase, lipase e ECG deverão ser realizados durante o tratamento a cada
7, 10 ou 15 dias; imediatamente após o tratamento; e depois, apenas os
exames alterados, até a sua normalização.
Em casos de alterações
persistentes ou rapidamente progressivas, recomenda-se a suspensão
temporária do tratamento até a normalização dos exames.
Para Anfotericina B acrescentar dosagens de Na e K e utilizar intervalos de
uma semana ou menos.
Ao utilizar-se a Pentamidina, a glicemia deve ser acompanhada
mensalmente durante 6 meses sempre que a dose total ultrapassar 1g.
Sorologias para LTA: Deverão ser realizadas em todas as consultas de
retorno.Quando as consultas forem realizadas em outros locais, o sangue
deverá ser centrifugado e o soro poderá ser transportado imediatamente em
isopor com gelo ou estocado congelado (preferencialmente a –20oC) e
posteriormente transportado em isopor com gelo para o laboratório.
Sorologia anti-HIV: Deverá ser solicitada nos casos de evolução aberrante
(lesões fora do padrão clínico usual, apresentando exuberância parasitária,
teste de Montenegro não reator etc.) e má resposta terapêutica.
Acompanhamento clínico
Casos cutâneos
Avaliação clínica e dermatológica:
Devem ser repetidas a cada 15, 10 ou 7 dias durante o tratamento, de
acordo com as condições clínicas do paciente, e no 30o dia.
63
Ao término do tratamento espera-se que as lesões estejam com
pouquíssima infiltração (não endurecidas à palpação) e epitelizadas (recoberta
por uma "pele fina"), embora mantenham algum eritema (cicatriz rósea).
Nos casos em que não ocorra epitelização das lesões (geralmente úlceras
localizadas abaixo dos joelhos), manter sem tratamento (apenas cuidados
locais) e reavaliar quinzenalmente.
Caso não ocorra uma tendência
progressiva para a epitelização, reavaliar o diagnóstico (principalmente nos
casos sem comprovação parasitológica) e/ou a necessidade de repetir o
tratamento.
A partir da constatação da epitelização das lesões, os pacientes deverão ser
reavaliados após 1, 3, 6, 12 meses e então anualmente, pelo mínimo de 5
anos. Ao longo do primeiros 6-12 meses deve-se observar a progressiva
regressão do eritema e da infiltração da cicatriz, geralmente acompanhada de
atrofia da epiderme e áreas de hiper e de hipopigmentação.
Avaliação otorrinolaringológica
Nos pacientes sem lesão mucosa anterior ao tratamento, devem ser
realizadas, no mínimo, com 6 e 12 meses e então anualmente, por um mínimo
de 5 anos, para constatar que não houve desenvolvimento de lesões mucosas.
Casos mucosos
Avaliação clínica:
Devem ser repetidas a cada 15, 10 ou 7 dias durante o tratamento, de
acordo com as condições clínicas do paciente, e no 30o dia. Caso haja
indicação de prorrogação do tratamento as reavaliações devem seguir com a
periodicidade necessária.
Avaliação otorrinolaringológica:
Após o 30o dia de tratamento deverão ser a cada 15, 10 ou 7 dias de
prorrogação do tratamento, de acordo com as condições clínicas do paciente.
A partir da constatação da epitelização das lesões, os pacientes deverão ser
reavaliados após 1, 3, 6, 12 meses e então anualmente, por um mínimo de 5
anos, para constatar a manutenção da cicatrização das lesões. Recidivas de
lesões e/ou evolução de um caso de forma cutânea para a forma mucosa
Pacientes com lesões recidivantes, deverão reiniciar a investigação
diagnóstica (principalmente aqueles sem comprovação parasitológica) e/ou
repetir o tratamento, de preferência em regime de internação ou hospital-dia.
Pacientes que evoluírem da forma cutânea para a forma mucosa,
necessariamente deverão seguir a rotina de investigação inicial para pacientes
mucosos.
Em ambos os casos, atentar para a possibilidade para a co-infecção pelo
HIV ou outras doenças associadas de natureza infecciosa ou degenerativa.
64
Calendário para pacientes tratados em outras unidades de saúde
Pacientes de Forma Cutânea
MOMENTO
FREQÜÊNCIA
Confirmação do diagnóstico:
LOCAL
IPEC
Durante o tratamento:
A cada 15, 10 ou 7 dias
o
Imediatamente após o
Unidade de origem
No 30 dia
Unidade de origem
Caso persista lesão não
Quinzenalmente até a constatação da
Unidade de origem
epitelizada:
epitelização (dentro de mais 2 meses)
tratamento:
Caso persista a lesão aberta ou caso
IPEC
ocorra piora nesse período
Primeiro ano após o tratamento:
Anos subseqüentes:
2 e 4 meses
Unidade de origem
1, 6 e 12 meses
IPEC
Anualmente durante no mínimo 5 anos IPEC
Pacientes de Forma Mucosa
FREQÜÊNCIA
MOMENTO
Confirmação do diagnóstico:
LOCAL
IPEC
Durante o tratamento:
A cada 15, 10 ou 7 dias
Unidade de origem
Imediatamente após o
No 30o dia
IPEC
Caso necessite prorrogar o
A cada 7 ou 10 dias para
Unidade de origem
tratamento:
acompanhamento clínico geral
tratamento:
A cada 10 ou 15 dias até a
IPEC
constatação da cura clínica
Primeiro ano após o tratamento:
1, 3, 6 e 12 meses
IPEC
Anos subseqüentes:
Anualmente durante no mínimo 5 anos IPEC
65
Anexo 2 - Termo de Consentimento Livre e Esclarecido
Termo de Consentimento Livre e Esclarecido 1
INSTITUIÇÃO: INSTITUTO DE PESQUISA CLÍNICA EVANDRO CHAGAS FIOCRUZ
COORDENADOR DA PESQUISA: ARMANDO DE OLIVEIRA SCHUBACH
ENDEREÇO: Av. Brasil 4365-Manguinhos-Rio de Janeiro-RJ-CEP 21045-900
TELEFONES:(0xx21)598-4260/598-4263/598-4266/290-1943/FAX(0xx21)590-9988
NOME DO PROJETO DE PESQUISA: ESTUDO PARA A SISTEMATIZAÇÃO
DO ATENDIMENTO DE PACIENTES COM LEISHMANIOSE TEGUMENTAR
AMERICANA NO CENTRO DE REFERÊNCIA EM LTA - INSTITUTO DE
PESQUISA CLÍNICA EVANDRO CHAGAS - FIOCRUZ
NOME DO VOLUNTÁRIO: _________________________________________
A leishmaniose tegumentar americana (LTA) é uma doença que atinge seres
humanos e animais, incluindo o cão, causada por parasitos chamados
leishmanias. A doença é transmitida pelo "mosquito palha", que vive em
regiões de mata, plantações de banana, manga etc. localizadas próximas às
moradias humanas, onde costuma entrar para se alimentar de sangue de
pessoas e animais domésticos. A LTA se apresenta como feridas na pele de
difícil cicatrização.
Algumas vezes, a LTA pode se tornar mais grave,
envolvendo as mucosas de revestimento interno do nariz e da garganta,
mesmo vários anos após a cicatrização da ferida na pele. Atualmente, não
temos como saber qual paciente adoecerá de novo e qual permanecerá curado
definitivamente.
Outras
doenças
como
infecções
por
bactérias,
tuberculose,
sífilis,
esporotricose, outras micoses, tumores e etc. podem se manifestar de forma
1 a
1 via: Prontuário Médico
2a via: Paciente
66
parecida com a leishmaniose e precisam ser diferenciadas para que se possa
iniciar o tratamento correto. Entretanto, com os exames existentes atualmente,
nem sempre se consegue ter certeza absoluta sobre qual a doença em
questão.
No momento, várias perguntas precisam ser respondidas como: de que
outras maneiras a LTA pode se manifestar? Como se comportam os exames
de laboratório antes, durante e após o tratamento? Quais pacientes, mesmo
após o tratamento, irão reabrir suas cicatrizes ou irão desenvolver doença
dentro do nariz ou na garganta? Que outras doenças parecidas estão sendo
confundidas com a LTA e quais exames devem ser utilizados para
esclarecimento? Qual o papel dos seres humanos como reservatórios da
doença? Quais as melhores formas de tratamento? Que medidas devem ser
tomadas para controlar o problema?
Pelo presente documento, você está sendo convidado(a) a participar de uma
investigação clínica a ser realizada no IPEC-FIOCRUZ, com os seguintes
objetivos:
Descrever aspectos da LTA: manifestações clínicas e exames de
laboratório, tentando estabelecer padrões de apresentação da doença e seu
modo de evolução, comparando com outras doenças.
Avaliar o uso dos antimoniais e outras drogas utilizadas no tratamento da
LTA levando em consideração o tempo de tratamento, toxicidade, facilidade
de administração, custo e ausência de envolvimento das mucosas do nariz
e da garganta.
Isolar, identificar e comparar as leishmanias causadoras da LTA
provenientes de diversas localidades.
Este documento procura esclarecê-lo sobre o problema de saúde em estudo
e sobre a pesquisa que será realizada, prestando informações, detalhando os
procedimentos e exames, benefícios, inconvenientes e riscos potenciais.
A sua participação neste estudo é voluntária. Você poderá recusar-se a
participar de uma ou todas as etapas da pesquisa ou, mesmo, se retirar dela a
qualquer
momento,
sem
que
este
fato
lhe
venha
causar
qualquer
67
constrangimento ou penalidade por parte da Instituição. O seu atendimento
médico não será prejudicado caso você decida não participar ou caso decida
sair do estudo já iniciado. Os seus médicos poderão também interromper a sua
participação a qualquer momento, se julgarem conveniente para a sua saúde.
A sua participação com relação ao Projeto consiste em autorizar a realização
de uma série de exames para o diagnóstico da sua doença, e que parte deste
material, assim como os resultados destes exames de rotina, sejam utilizados
neste estudo. Também será necessária a sua autorização: 1) para a utilização
de documentação fotográfica ou filmagem de suas lesões para estudo 2) para
que parte do material coletado periodicamente para a realização de exames
para acompanhamento da evolução da sua doença, assim como os resultados
destes exames de rotina e do seu tratamento sejam utilizados neste estudo 3)
para que parte das amostras coletadas seja estocada a fim de servir para
outros estudos que tenham como finalidade a melhor compreensão da doença,
o desenvolvimento e avaliação de novos métodos diagnósticos; avaliação da
resposta ao tratamento etc., desde que tal estudo seja previamente analisado e
autorizado por um Comitê de Ética em Pesquisa.
Os exames e procedimentos aplicados lhe serão gratuitos. Você receberá
todos os cuidados médicos adequados para a sua doença. Participando deste
estudo você terá algumas responsabilidades: seguir rigorosamente as
instruções do seu médico; comparecer à unidade de saúde nas datas
marcadas; relatar a seu médico todas as reações que você apresentar durante
o tratamento, tanto positivas quanto negativas.
Caso você necessite de atendimento médico, durante o período em que
estiver participando do estudo, procure o Instituto de Pesquisa Clínica Evandro
Chagas - FIOCRUZ, mesmo fora do seu agendamento.
Em caso de
necessidade ligue para o Dr. Armando de Oliveira Schubach, Dra. Fátima
Conceição-Silva ou Dra. Mariza Salgueiro nos telefones acima. Caso você
apresente qualquer quadro clínico que necessite de internação, a equipe
médica providenciará seu leito no Instituto de Pesquisa Clínica Evandro
Chagas - FIOCRUZ.
Seus animais com suspeita de LTA poderão ser
68
atendidos gratuitamente pela médica veterinária Dra. Tânia Maria Pacheco
Schubach no Serviço de Zoonoses do IPEC.
Sua identidade será mantida como informação confidencial. Os resultados do
estudo poderão ser publicados sem revelar a sua identidade e suas imagens
poderão ser divulgadas desde que você não possa ser reconhecido.
Entretanto, se necessário, os seus registros médicos estarão disponíveis para
consulta para a equipe envolvida no estudo, para o Comitê de Ética em
Pesquisa, para as Autoridades Sanitárias e para você.
Você pode e deve fazer todas as perguntas que julgar necessárias antes de
concordar em participar do estudo, assim como a qualquer momento durante o
tratamento. O seu médico deverá oferecer todas as informações necessárias
relacionadas à sua saúde, aos seus direitos, e a eventuais riscos e benefícios
relacionados à sua participação neste estudo.
Procedimentos, exames e testes que serão utilizados:
Antes do tratamento haverá coleta de informações sobre a doença; exame
médico geral e exame da pele com descrição e documentação fotográfica ou
filmagem das lesões; exame interno do nariz e da garganta com um aparelho
chamado fibra ótica, que permite ver lesões pequenas ou em locais de difícil
acesso, para descrição e documentação fotográfica ou filmagem das lesões (se
necessário será aplicado "spray" anestésico local). Retirada, com anestesia
local, de um pequeno fragmento da lesão de pele, de mucosa ou de "íngua"
para realização de exames tanto para diagnóstico (aspecto microscópico do
tecido doente e culturas para tentativa de isolamento de possíveis agentes de
doença como fungos, bactérias e leishmanias) quanto para pesquisa
(identificação de células e outros componentes da resposta inflamatória, assim
como novos métodos de identificação dos possíveis agentes da doença).
Outros materiais também poderão ser coletados na tentativa de isolamento do
agente causador da doença: aspiração com seringa e agulha do bordo da lesão
e de secreções em lesões de pele fechadas.
Outros exames também serão realizados para diagnosticar outras doenças
possíveis de serem confundidas com a LTA, para classificar a gravidade da
69
doença e avaliar os efeitos dos medicamentos a serem utilizados durante o seu
tratamento: um a quatro testes cutâneos (injeção da décima parte de um
mililitro de um reativo para determinada doença na pele da região anterior do
antebraço, a qual deverá ser revista entre 2 a 3 dias após a injeção); exames
de sangue (quantidade equivalente a aproximadamente três colheres de sopa),
exame de saliva (coletada com um tipo de cotonete), radiografia dos pulmões e
da face (se necessário complementada por tomografia computadorizada); e
eletrocardiograma.
O tratamento da LTA em pacientes humanos costuma ser com o
medicamento glucantime por via intramuscular (IM), intravenosa (IV) uma
injeção ao dia, geralmente, durante um período de 30 dias contínuos ou com
intervalos de descanso.
Excepcionalmente, para idosos, pacientes com
doenças graves ou que não tolerem o tratamento normal, poderá ser utilizada a
via intralesional (IL).
O tempo do tratamento poderá ser diminuído ou
aumentado conforme a necessidade.
Outras opções de tratamento são a
anfotericina B (IV) e a pentamidina (IM), ambas injetáveis e necessitando
medidas de acompanhamento parecidas com as do glucantime.
Após o início do tratamento, você deverá comparecer a aproximadamente
três consultas dentro de 10, 20 e 30 dias. Caso as lesões não cicatrizem
totalmente, o tratamento poderá ser continuado pelo período de tempo
necessário. Ao se atingir a cura clínica, você deverá retornar para consulta de
reavaliação em 1, 3, 6, 9 e 12 meses após o término do tratamento. E, a partir
de então, pelo menos uma vez por ano durante um prazo indefinido (no mínimo
5 anos).
A cada retorno deverão ser realizados avaliação médica e exames de
sangue (na quantidade aproximada de uma ou duas colheres de sopa) para
avaliar os efeitos dos medicamentos utilizados no seu tratamento e/ou para
avaliar a evolução da doença.
Outros exames, como o eletrocardiograma
durante o tratamento, poderão ser realizados quando indicados.
70
Inconvenientes e riscos principais conhecidos até os dias atuais:
A coleta de sangue poderá causar alguma dor no momento da punção venosa
e, eventualmente, poderá haver a formação de uma área arroxeada no local,
que voltará ao normal dentro de alguns dias.
Ocasionalmente, os testes na pele poderão, apresentar uma reação forte
com inflamação do local, formação de bolhas e, mais raramente, formação de
ferida.
Todo o processo costuma regredir dentro de alguns dias a poucas
semanas.
Tanto os testes na pele quanto o anestésico injetado no momento da biópsia
(retirada de um pequeno fragmento de pele para exame) poderão causar
alergia, geralmente limitada ao aparecimento de áreas vermelhas, empoladas e
com coceira na pele e que respondem bem a medicamentos anti-alérgicos.
Mais raramente poderá haver uma reação mais severa com dificuldade de
respirar e necessidade de cuidados mais intensos, existentes no IPEC.
No local da biópsia poderá ocorrer inflamação e dor, acompanhados ou não
de infecção por bactérias. Caso isso ocorra, poderá ser necessário o uso de
medicamentos para dor e antibióticos.
Os medicamentos glucantime e pentamidina costumam causar efeitos
indesejáveis, não devem ser utilizados na gravidez e seu uso em mulheres em
idade reprodutiva deve ser acompanhado de uso de método anticoncepcional
eficaz como preservativo de látex masculino ou feminino ("camisinha"),
diafragma feminino ou anticoncepcional oral ("pílula"). Quando o tratamento
não puder ser adiado, a anfotericina B poderá ser utilizada na gravidez. Os
exames com raios-x também não devem ser realizados em grávidas.
Formas de ressarcimento:
Sempre que necessário, nos dias de seu atendimento, poderá ser fornecida
alimentação conforme rotina do Serviço de Nutrição e Serviço social do IPEC
para pacientes externos.
Benefícios esperados:
Espera-se que, ao final do tratamento, você esteja curado da LTA, embora
as consultas de retorno por vários anos após o tratamento sejam necessárias
71
para a confirmação da cura. Os resultados deste estudo poderão ou não
beneficiá-lo diretamente, mas no futuro, poderão beneficiar outras pessoas,
pois espera-se também que este estudo contribua para que o diagnóstico e
acompanhamento do tratamento de pacientes com LTA possa ser feito de
forma mais eficaz e segura. Caso a sua investigação demonstre outro
diagnóstico diferente de LTA, você será devidamente orientado a buscar o
tratamento mais adequado para o seu caso.
Declaro que li e entendi todas as informações referentes a este estudo e que
todas as minhas perguntas foram adequadamente respondidas pela equipe
médica, a qual estará à disposição para responder minhas perguntas sempre
que eu tiver dúvidas.
Recebi uma cópia deste termo de consentimento e pelo presente consinto,
voluntariamente, em participar deste estudo de pesquisa.
_______________________________________________
_______________
Nome paciente:
Data
_______________________________________________
_______________
Nome médico:
Data
_______________________________________________
_______________
Nome testemunha 2:
Data
_______________________________________________
_______________
Nome testemunha 2:
Data
2
Apenas no caso de pacientes impossibilitados de manifestar o seu consentimento por escrito.
No caso de menores de 18 anos, deverá ser assinado pelo pai, mãe ou responsável legal.
72
Anexo 3 - Termo de Compromisso e Responsabilidade
TERMO DE COMPROMISSO E RESPONSABILIDADE
Eu, Mauro Célio de Almeida Marzochi, coordenador do projeto de
pesquisa intitulado “Estudo comparativo de sistemas reveladores em
ensaios imunoenzimáticos para detecção de anticorpos específicos no
diagnóstico da leishmaniose tegumentar americana (LTA) causada por
Leishmania (Viannia) braziliensis”, comprometo-me a manter o anonimato e
a confidencialidade dos participantes do projeto.
A identidade dos participantes, assim como os resultados obtidos com
este projeto, serão mantidos em um banco de dados sob a minha
responsabilidade.
Os resultados obtidos com esta pesquisa serão divulgados em
comunicações científicas mantendo o anonimato dos participantes e o material
biológico utilizado nesse projeto só poderá ser empregado em outras pesquisas
após submissão e aprovação do Comitê de Ética em Pesquisa.
Rio de Janeiro, 04 de julho de 2005.
Mauro Célio de Almeida Marzochi
Sonia Regina Lambert Passos
Orientador
Co-orientadora
Lílian Dias Nascimento
Mestranda
73
Anexo 4 - Aprovação no CEP/IPEC
74
75
Baixar