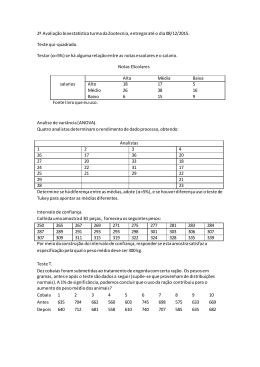
ATIVIDADE DE FITASES MICROBIANAS EM DIFERENTES CONDIÇÕES DE ARMAZENAMENTO, pH, TEMPERATURA E PROCESSAMENTO TÉRMICO LUCIANA DE PAULA NAVES 2009 LUCIANA DE PAULA NAVES ATIVIDADE DE FITASES MICROBIANAS EM DIFERENTES CONDIÇÕES DE ARMAZENAMENTO, pH, TEMPERATURA E PROCESSAMENTO TÉRMICO Dissertação apresentada à Universidade Federal de Lavras como parte das exigências do Programa de Pós-Graduação em Agroquímica, para a obtenção do título de “Mestre”. Orientadora Profa. Angelita Duarte Corrêa LAVRAS MINAS GERAIS - BRASIL 2009 Ficha Catalográfica Preparada pela Divisão de Processos Técnicos da Biblioteca Central da UFLA Naves, Luciana de Paula. Atividade de fitases microbianas em diferentes condições de armazenamento, pH, temperatura e processamento térmico / Luciana de Paula Naves. – Lavras : UFLA, 2009. 60 p. : il. Dissertação (Mestrado) – Universidade Federal de Lavras, 2009. Orientador: Angelita Duarte Corrêa. Bibliografia. 1. Ácido fítico. 2. Fitato. 3. Atividade enzimática. 4. Frango de corte. 5. Suplementação. 6. Hexafosfato de mio-inositol fosfohidrolase. I. Universidade Federal de Lavras. II. Título. CDD – 636.5085 LUCIANA DE PAULA NAVES ATIVIDADE DE FITASES MICROBIANAS EM DIFERENTES CONDIÇÕES DE ARMAZENAMENTO, pH, TEMPERATURA E PROCESSAMENTO TÉRMICO Dissertação apresentada à Universidade Federal de Lavras como parte das exigências do Programa de Pós-Graduação em Agroquímica, para a obtenção do título de “Mestre”. APROVADA em 26 de fevereiro de 2009. Prof. Paulo Borges Rodrigues UFLA Prof. Matheus Puggina de Freitas UFLA Profa. Angelita Duarte Corrêa UFLA (Orientadora) LAVRAS MINAS GERAIS – BRASIL A Deus, À minha mãe Maria Lucia e ao meu pai José Augusto, pelo amor, apoio e compreensão. Ao meu irmão Fernando, pelo carinho, amizade e companheirismo. Ao Rodrigo, pelo amor, incentivo e compreensão. DEDICO AGRADECIMENTOS A Deus, pela vida e força espiritual. À minha família e meu noivo, que sempre me apoiaram. À Universidade Federal de Lavras e ao Departamento de Química, pela oportunidade concedida para a realização do curso e das análises. À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela concessão da bolsa de estudos. À Profa. Angelita Duarte Corrêa, pela orientação, amizade e por tudo que me ensinou. Ao Prof. Antônio Gilberto Bertechini pelo apoio, amizade e sugestões. Aos professores Custódio Donizete dos Santos e Celeste Maria Patto de Abreu pelas sugestões e amizade. Ao Dr. Jerônimo Ávito Brito pela amizade, sugestões e apoio. Aos professores das disciplinas cursadas, pelo conhecimento e amizade transmitidos. A todos do Laboratório de Bioquímica do Departamento de Química, em especial Juliana Arriel Torres, Pricila M. Batista Chagas e Suelen Ribas pela ajuda na realização das análises. Aos funcionários do Departamento de Química e aos colegas de pósgraduação, em especial Gislaine Aparecida Carvalho pela amizade. Aos funcionários da Biblioteca/UFLA, pela atenção e presteza com que sempre me atenderam. Enfim, a todos que, direta ou indiretamente, contribuíram para a realização deste trabalho. SUMÁRIO Página RESUMO................................................................................................... i ABSTRACT............................................................................................... iii LISTA DE SIGLAS................................................................................... v LISTA DE FIGURAS................................................................................ vi LISTA DE TABELAS............................................................................... vii 1 INTRODUÇÃO...................................................................................... 1 2 REFERENCIAL TEÓRICO................................................................... 3 2.1 O substrato: fitato................................................................................. 3 2.2 A enzima: fitase.................................................................................... 6 2.2.1 Aspectos gerais.................................................................................. 6 2.2.2 Fontes de origem............................................................................... 8 2.2.2.1 Fitases de origem vegetal e animal................................................ 8 2.2.2.2 Fitases de origem microbiana........................................................ 9 2.2.3 Propriedades moleculares, catalíticas e classificação das fitases...... 10 2.2.4 Local de ação..................................................................................... 14 2.2.5 Fatores físicos e químicos que afetam a estabilidade e a atividade da fitase............................................................................................. 16 2.2.5.1 pH................................................................................................... 17 2.2.5.2 Temperatura................................................................................... 18 2.2.5.3 Glicosilação e íons metálicos......................................................... 19 2.2.5.4 Agentes redutores e inibidores....................................................... 19 2.2.5.5 Armazenamento............................................................................. 20 2.2.6 Considerações................................................................................... 21 3 MATERIAL E MÉTODOS.................................................................... 22 3.1 Procedimentos experimentais e fitases utilizadas................................ 22 3.2 Extração da fitase e determinação da atividade enzimática................. 23 3.3 Primeira etapa...................................................................................... 23 3.3.1 Armazenamento das fitases............................................................... 23 3.3.2 Formulação do núcleo....................................................................... 24 3.3.3 Incorporação das fitases ao núcleo de vitaminas, minerais e aminoácidos...................................................................................... 25 3.4 Segunda etapa....................................................................................... 26 3.4.1 Efeito do pH e da temperatura na atividade das fitases..................... 26 3.5 Terceira etapa....................................................................................... 26 3.5.1 Formulação das rações...................................................................... 26 3.5.2 Incorporação das fitases às rações..................................................... 27 3.5.3 Rações suplementadas com fitase, processamento térmico e armazenamento................................................................................. 28 3.5.4 Determinação da umidade................................................................. 28 3.6 Análises estatísticas.............................................................................. 29 4 RESULTADOS E DISCUSSÃO............................................................ 31 4.1 Primeira etapa: armazenamento........................................................... 31 4.2 Segunda etapa: pH e temperatura......................................................... 35 4.2.1 pH...................................................................................................... 35 4.2.2 Temperatura...................................................................................... 38 4.3 Terceira etapa: processamento térmico das rações e armazenamento. 41 5 CONCLUSÕES....................................................................................... 46 REFERÊNCIAS BIBLIOGRÁFICAS....................................................... 47 ANEXOS.................................................................................................... 56 RESUMO NAVES, Luciana de Paula. Atividade de fitases microbianas em diferentes condições de armazenamento, pH, temperatura e processamento térmico. 2009. 60p. Dissertação (Mestrado em Agroquímica) - Universidade Federal de Lavras, Lavras, MG1. O uso de fitase na nutrição das aves é cada vez mais frequente e promissor. Entretanto, há várias fitases disponíveis no mercado e poucos estudos científicos sobre a influência da forma e tempo de armazenamento, pH, temperatura e processamento térmico na atividade da enzima em questão. Portanto, este experimento foi realizado com três fitases de diferentes origens (Aspergillus oryzae, Aspergillus niger e Saccharomyces cerevisae) e dividido em três etapas com os objetivos de: (1) avaliar o efeito de duas formas de armazenamento sobre a atividade das fitases; (2) avaliar os efeitos do pH e temperatura, in vitro, sobre a atividade das fitases; e (3) avaliar o efeito de três tempos de exposição ao calor sobre a atividade das fitases incorporadas a dois tipos de rações para frangos de corte, durante um período máximo de armazenamento de 60 dias em temperatura ambiente (TA). Na primeira etapa, as fitases foram armazenadas nas seguintes formas, em quatro repetições cada: a) original (como adquirida) com atividade catalítica determinada após 0; 60; 90; 120; 150 e 180 dias de armazenamento em TA; e b) incorporada a um núcleo contendo vitaminas, macro e microminerais e aminoácidos, com determinação da atividade a cada 30 dias de armazenamento em TA, durante 180 dias. Na segunda, a atividade foi determinada, em quatro repetições, em valores de pH de 2,0 a 9,0 e em temperaturas de 20 a 90°C. A última etapa foi dividida em dois experimentos, com três repetições cada. Experimento 1: avaliou-se o efeito de dois tipos de ração para frangos de corte (fase inicial e final) e quatro tratamentos (ração controle e submetidas a três tempos de exposição ao calor) sobre a atividade das fitases. Experimento 2: a ração de fase inicial submetida aos quatro tratamentos citados anteriormente teve a atividade de fitase determinada após 0; 15; 30; 45 e 60 dias de armazenamento em TA. As determinações da atividade da fitase de S. cerevisae não apresentaram padrões de repetibilidade durante a primeira etapa, portanto, essa enzima foi avaliada apenas na segunda etapa. Houve perda linear de atividade enzimática, durante o armazenamento, em ambas as formas avaliadas. A fitase de A. niger foi a enzima com menor perda de atividade nas duas formas de armazenamento. O 1 Comitê Orientador: Dra Angelita Duarte Corrêa (Orientadora), Dr. Antônio Gilberto Bertechini, Dr. Custódio Donizete dos Santos e Dra. Celeste Maria Patto de Abreu (co-orientadores) − UFLA. i armazenamento, em TA, das fitases na forma original é o mais indicado. Variações no pH e temperatura acarretaram em alterações na atividade das três fitases. A fitase de A. oryzae teve maior atividade no pH 4,0 enquanto as outras fitases apresentaram pH ótimo entre 4,5 e 5,0. A fitase de A. oryzae apresentou maior atividade a 40°C e a 50oC estava inativa, enquanto que a fitase de A. niger teve maior atividade próximo a 45°C, estando inativa a 60oC. A fitase de S. cerevisae foi a mais termoresistente, pois estava ativa a 60°C, com atividade máxima entre 50 e 60°C. Os resultados obtidos nos experimentos 1 e 2 da terceira etapa mostraram que a atividade enzimática não foi alterada pelo tipo de ração, processamento térmico das rações nem pelo armazenamento das mesmas, em TA, durante 60 dias. ii ABSTRACT NAVES, Luciana de Paula. Activity of microbial phytases in different conditions of storage, pH, temperature and thermic processes. 2009. 60p. Dissertation (Master in Agrochemistry) - Universidade Federal de Lavras, Lavras, MG1. The use of phytase in poultry nutrition is progressively more frequent and promising. However, there are many available phytases in the market and few scientific studies about the influence of form and period of storage, pH, temperature and thermic process on the enzyme activity in question. Therefore, this experiment was carried out with three phytases from different sources (Aspergillus oryzae, Aspergillus niger and Saccharomyces cerevisae) and divided into three stages, whose objectives are: (1) evaluate the effect of two forms of storage on the phytases activity; (2) evaluate the effects of the pH and temperature, in vitro, on the phytases activity; and (3) evaluate the effect of three times of exhibition to the heat on the phytases activity incorporated in two types of feed for broiler chickens, during a maximum period of storage of 60 days at the room temperature (RT). In the first stage, the phytases were stored in the following manners, with four repetitions each: a) original (as acquired) with the catalytic activity determinated after 0; 60; 90; 120; 150 and 180 days of storage at RT; and b) incorporated to a nucleus containing vitamins, macro and microminerals and aminoacids, with activity determination every 30 days of storage at RT, during 180 days. In the second, the activity was determined, using four repetitions, in pH values ranging from 2.0 to 9.0 and in temperatures from 20 to 90°C. The last stage was divided into two experiments, with three repetitions each. Experiment 1: the effect of two types of feeds for broiler chickens (initial phase and final phase) and four treatments (control feed and feed submitted at three times of exhibition to the heat) on the phytases activity, was evaluated. Experiment 2: the phytase activity of the initial phase feed submitted to the four treatments cited was determined after 0; 15; 30; 45 and 60 days of storage at RT. Determinations of activity of the S. cerevisae phytase didn’t show any repeatibilily standard during the first stage; therefore, this enzyme was evaluated only in the second stage. There was linear loss of enzymatic activity, during the storage, in both forms evaluated. The A. niger phytase was the enzyme with the lowest loss of activity in both forms of storage. The storage, at RT, of phytases in the original form is the more indicated. 1 Guidance Committee: Dra. Angelita Duarte Corrêa (Adviser), Dr. Antônio Gilberto Bertechini, Dr. Custódio Donizete dos Santos e Dra. Celeste Maria Patto de Abreu − UFLA. iii Variation in pH and temperature caused changes in the activity of the three phytases. The A. oryzae phytase exhibited the largest activity at pH 4.0, while the other phytases showed optimum pH between 4.5 and 5.0. The A. oryzae phytase showed the largest activity at 40°C and, at 50°C, it was inactive; while the A. niger phytase presented the largest activity near to 45°C, being inactive at 60°C. The S. cerevisae phytase was the most thermae-resistent enzyme since it was active at 60°C with maximum activity between 50 and 60°C. According to the results obtained in the experiments 1 and 2 of the third stage, the enzymatic activity wasn’t dependent on the type of feed, thermic process and storage of feeds, at RT, during 60 days. iv LISTA DE SIGLAS FAP Fosfatase ácida “purple” FBH Fitase ß-hélice FTU Unidades de atividade de fitase HFA Histidina fosfatase ácida MM Massa molecular MS Matéria seca Pi Fósforo inorgânico TA Temperatura ambiente v LISTA DE FIGURAS Página FIGURA 1 Estrutura do ácido fítico completamente desprotonado...... 4 FIGURA 2 Exemplos de possíveis ligações entre o ácido fítico e alguns nutrientes.................................................................. 6 FIGURA 3 Estrutura do mio-inositol..................................................... 14 FIGURA 4 Atividade das fitases de A. oryzae e A. niger, nas formas originais, em função do tempo de armazenamento............. 32 Atividade das fitases de A. oryzae e A. niger, incorporadas ao núcleo, em função do tempo de armazenamento............ 33 Atividade das fitases de A. oryzae, A. niger e S. cerevisae, em função do pH................................................................. 36 Atividade enzimática em função da temperatura................ 39 FIGURA 5 FIGURA 6 FIGURA 7 vi LISTA DE TABELAS Página TABELA 1 Composição percentual dos ingredientes presentes no núcleo 24 TABELA 2 Composição dos suplementos vitamínico e mineral............... 25 TABELA 3 Composição das rações de acordo com as fases estudadas................................................................................ 27 TABELA 4 Atividade das fitases de A. oryzae e A. niger, em FTU kg-1 MS, incorporadas a dois tipos de rações e submetidas a quatro tratamentos................................................................... 42 TABELA 5 Umidade, em g 100g-1, das rações de fase inicial e final suplementadas com as fitases de A. oryzae e A. niger............ 43 TABELA 6 Atividade da fitase de A. oryzae, em FTU kg-1 MS, incorporada à ração para frangos de corte na fase inicial, submetida a quatro tratamentos e armazenada durante período máximo de 60 dias..................................................... 44 TABELA 7 Atividade da fitase de A. niger, em FTU kg-1 MS, incorporada à ração para frangos de corte na fase inicial submetida a quatro tratamentos e armazenada durante período máximo de 60 dias..................................................... 45 vii 1 INTRODUÇÃO O fitato é a principal forma de armazenamento de fósforo (P) em sementes e grãos comumente presentes nas rações para aves. Entretanto, como os frangos de corte apresentam baixa atividade de fitase endógena, o P fítico presente na ração é praticamente não aproveitado e acumula-se nas excretas dos frangos constituindo um sério problema ambiental por causar eutrofização de corpos d’água. Devido ao baixo aproveitamento natural do P fítico, P de origem inorgânica (Pi) precisa ser adicionado à ração aumentando significativamente os custos de produção e, além disso, há indícios de crise futura no suprimento de Pi já que as jazidas de fosfatos são recursos naturais não-renováveis. O fitato também pode atuar como antinutriente, diminuindo a biodisponibilidade de nutrientes. Diante disso, fitases exógenas têm sido adicionadas a rações de frangos de corte para minimizar esses problemas. A fitase (hexafosfato de mio-inositol fosfo-hidrolase) atua sobre o substrato fitato, hidrolisando-o em ésteres fosfatos de mio-inositol menores por meio de uma série de reações de desfosforilação liberando, consequentemente, Pi . Grandes avanços têm ocorrido na avicultura durante as últimas décadas tornando-a mundialmente um dos segmentos mais desenvolvidos da agropecuária. A inclusão de fitases na dieta dos frangos de corte tem se tornado cada vez mais comum, entretanto há várias fitases disponíveis no mercado e poucos estudos científicos sobre a influência da forma e tempo de armazenamento, pH, temperatura e processamento térmico na atividade da enzima em questão. Portanto, este experimento foi realizado com três fitases microbianas de diferentes origens e está dividido em três etapas com os objetivos de: (1) avaliar o efeito de duas formas de armazenamento sobre a atividade das fitases, durante o período máximo de 180 dias em temperatura 1 ambiente (TA); (2) avaliar os efeitos do pH e temperatura, in vitro, sobre a atividade das fitases; e (3) avaliar o efeito de três tempos de exposição ao calor sobre a atividade das fitases incorporadas a dois tipos de rações para frangos de corte, durante um período máximo de armazenamento de 60 dias em TA. 2 2 REFERENCIAL TEÓRICO 2.1 O substrato: fitato O termo fitato refere-se ao sal do ácido fítico (hexafosfato de mioinositol; IP6) com um único tipo de mineral (Selle & Ravindran, 2007). O fitato foi identificado pela primeira vez há mais de um século (Hartig, 1855). É a principal forma de armazenamento de fósforo (P) durante o desenvolvimento de cereais, legumes e sementes. Sua concentração no vegetal pode variar de 1 a 5% (Lei & Porres, 2003). A localização do fitato nas sementes é variada. Em grãos pequenos, é observado principalmente na camada de aleurona, testa e pericarpo, e no caso do milho é encontrado principalmente no embrião. Em sementes de leguminosas é acumulado no cotilédone, entretanto na soja está localizado nos corpos protéicos distribuídos por toda semente (Baker, 1991). Assim, o fitato está naturalmente presente em sementes e grãos comumente usados nas formulações de rações. Normalmente, as dietas das aves contêm de 2,5 a 4,0g de P fítico kg-1 de ração (Ravindran et al., 1995). Todavia, o P fítico é pobremente absorvido pelos monogástricos devido à ausência, ou quantidade insuficiente, de enzimas que hidrolisam fitato no trato gastrointestinal desses animais. Portanto, fósforo inorgânico (Pi) - um mineral caro e não-renovável precisa ser adicionado à dieta de aves, suínos e peixes para atender as exigências de P desses animais. O P fítico não absorvido e o Pi adicionado à dieta em excesso são excretados no solo podendo poluir o ambiente em áreas de intensa criação animal. O P acumulado no solo pode ser carreado com as chuvas para corpos d’água causando a eutrofização destes, estimulando o crescimento desordenado de microrganismos produtores de neurotoxinas e culminando na morte de diversas espécies aquáticas. Além disso, o ácido fítico carregado 3 negativamente tem ação quelante com cátions, diminuindo a absorção desses íons no intestino delgado (Lei & Porres, 2003). Estruturalmente, o ácido fítico consiste em um anel de mio-inositol completamente fosforilado disposto na conformação de cadeira (energeticamente mais estável) contendo, no total, 12 locais de dissociação de próton (Johnson & Tate, 1969) (Figura 1). 2 O PO32- 5 O3P O OPO32- 3 4 1 2 O3P O 6 2 2 O3P O OPO32FIGURA 1 Estrutura do ácido fítico completamente desprotonado (Johnson & Tate, 1969). A molécula de ácido fítico tem alto conteúdo de P (28,2%) e potencial quelante para formar grande variedade de complexos insolúveis com cátions em pH neutro e básico. Em pH ácido, a protonação parcial ou total do ácido fítico diminui sua capacidade de complexar-se com minerais catiônicos. A ordem correspondente à diminuição da estabilidade do complexo formado é a seguinte: Zn2+, Cu2+, Ni2+, Co2+, Mn2+, Ca2+ e Fe2+ (Cheryan, 1980). Segundo Pallauf & Rimbach (1995), o Zn é o elemento traço mais influenciado pelo ácido fítico, o que está de acordo com os resultados obtidos por Oberleas & Harland (1996) os quais relataram que o fitato foi um fator significante no desenvolvimento de deficiência de zinco por tornar tal mineral indisponível. O ácido fítico também pode 4 exercer influência negativa na disponibilidade de proteínas e aminoácidos presentes na dieta. Os grupos fosfatos do ácido fítico podem complexar-se com grupos amino de aminoácidos como a lisina, histidina e arginina. Além disso, grupos carboxila da cadeia lateral de aminoácidos ácidos podem ligar-se ao ácido fítico por meio de minerais di ou tri-valentes. Os complexos, proteína-ácido fítico ou proteínamineral-ácido fítico, podem reduzir a utilização da proteína. Esses complexos podem ocorrer naturalmente nos alimentos ou podem ser formados durante sua passagem pelo trato gastrointestinal (Kornegay, 2001). O ácido fítico também pode complexar-se com carboidratos como, por exemplo, o amido. Durante a incubação in vitro do amido de trigo e de feijão com saliva humana observou-se que a hidrólise foi retardada quando fitato de sódio foi adicionado e que, quando o cálcio foi adicionado ao ensaio, a digestão do amido foi restabelecida (Thompson et al., 1987). Ravindran et al. (2000) realizaram estudos com frangos de corte que mostraram claramente que a utilização da energia metabolizável aparente aumentou quando dietas com altos níveis de fitato foram suplementadas com fitase. Segundo esses pesquisadores, o ácido fítico pode exercer seu efeito no amido de uma ou mais maneiras: (i) por ligar-se a α-amilase ou por quelar Ca2+, o qual é necessário para a atividade normal da α-amilase; e/ou (ii) pela ligação direta ao amido e por meio de proteínas de acoplamento. Exemplos de possíveis ligações entre o ácido fítico e alguns nutrientes estão apresentados na Figura 2. A concentração do fitato no alimento é decisiva na sua atuação como antinutriente. Todavia, as respostas para a atividade da fitase são melhoradas com o aumento dos níveis de fitato na dieta e indicações disto têm sido documentadas para aves (Ravindran et al., 2000) e suínos (Selle et al., 2003). Assim, diante da variedade de complexos insolúveis que podem ser formados e da diminuição da disponibilidade dos nutrientes complexados, a importância da atividade da fitase é clara já que, se o fitato é hidrolisado, seus 5 O OH Ca2+ OH P - P O - O O O O O O H H O- O Ca2+ - O C CH2 O proteína OH Amido O proteína CH2 H P NH3 O + - O P P O- Zn2+ O H H O - O H O - O P O OH HOH2C Amido FIGURA 2 Exemplos de possíveis ligações entre o ácido fítico e alguns nutrientes (Kornegay, 2001). efeitos inibitórios são reduzidos (Kornegay, 2001). 2.2 A enzima: fitase 2.2.1 Aspectos gerais O fósforo é um nutriente essencial para o desenvolvimento adequado dos animais. Participa na formação e mineralização óssea, metabolismo celular, síntese de proteínas, constitui membranas celulares e desempenha função tamponante mantendo o equilíbrio ácido-básico no organismo (Ciofalo et al., 2003). As recomendações diárias de P para frangos de corte variam entre os trabalhos disponíveis na literatura e ainda não há um único valor para mensurar tal exigência. 6 Embora a atividade da fitase tenha sido detectada pela primeira vez em farelo de arroz há aproximadamente um século atrás (Suzuki et al., 1907), tentativas para desenvolver tal enzima só começaram a partir de 1962 na América do Norte (Wodzinski & Ullah, 1996). Contudo, apenas em 1991 a primeira fitase tornou-se comercialmente disponível em resposta à legislação dos países baixos, a qual estabeleceu limites para as quantidades de P lançados no ambiente (Selle & Ravindran, 2007). A fitase tem sido amplamente utilizada na alimentação de monogástricos para melhorar a disponibilidade de P, reduzir a poluição ambiental causada pelo acúmulo desse mineral nas excretas e diminuir custos de produção (Cromwell et al., 1995; Lei & Porres, 2003). Assim, a redução da excreção de P fítico pelas aves associada à diminuição da taxa de inclusão de Pi na ração são benéficas tanto no aspecto ambiental como por favorecer uma produção sustentável. O valor de equivalência de P é definido como a quantidade de Pi que não precisa ser adicionado à dieta em função da quantidade de fitase presente na ração via suplementação (Kornegay, 2001). Estima-se que 500 a 1.000FTU substituem, aproximadamente, 1g de Pi (Yi et al., 1996; Selle & Ravindran, 2007). Em estudos com frangos de corte, Paik (2003) combinou a redução do nível de P não-fítico de dietas iniciais (4,5−3,5g kg-1) e finais (3,5−2,5g kg-1) com a suplementação (ou não) de fitase com atividade de 500FTU kg-1 ração. A diminuição do P não-fítico na ausência da fitase reduziu a excreção de P em 14,8%, mas o ganho de peso dos animais foi depreciado. A inclusão da fitase nas rações acarretou redução na excreção de P em 29,6% e não comprometeu o desempenho de crescimento dos frangos. Em experimentos com pintos de corte na fase inicial, Tejedor et al. (2001) concluíram que rações à base de milho e soja suplementadas com fitase nas taxas de 500 e 750FTU kg-1 aumentaram o ganho de peso em 3,4 e 2,8%, respectivamente. Além disso, melhoraram a conversão alimentar em 3% nas 7 duas taxas de suplementação avaliadas. Em outra linha de pesquisa atual, as fitases são utilizadas para o desenvolvimento de estudos cinéticos e fisiológicos dos produtos da sua ação catalítica, pois tem sido proposto que determinados fosfatos de mio-inositol apresentam efeitos metabólicos de interesse como prevenção de formação de pedra renal (Ohkawa et al., 1984), controle da hipercolesterolemia e arteriosclerose (Potter, 1995), e redução dos riscos de câncer de colo (Shamsuddin et al., 1997). 2.2.2 Fontes de origem As fitases são enzimas amplamente encontradas nos microrganismos, plantas e certos tecidos animais, entretanto as fontes microbianas são as mais adequadas para a produção de fitase em escala comercial (Vats & Banerjee, 2004). 2.2.2.1 Fitases de origem vegetal e animal Provavelmente, todos os vegetais superiores contêm alguma atividade de fitase. Todavia, a concentração dessa enzima e sua significância na hidrólise do fitato variam consideravelmente entre as plantas (Maenz, 2001). Os níveis de controle da degradação do fitato nas sementes têm sido discutidos. Durante a germinação, a atividade da fitase pode ser controlada pela ação do ácido giberélico e fosfato; entretanto, esses mecanismos ainda não estão completamente entendidos (Konietzny & Greiner, 2002). De um modo geral, baixa atividade de fitase tem sido determinada em ampla variedade de sementes tais como arroz, trigo, cevada, milho, centeio, soja e oleaginosas (Eeckhout & Paepe, 1994). Embora as rações contenham sementes com certa atividade de fitase, o processo de peletização (usado no processamento da maioria das rações) acarreta em perda de atividade catalítica 8 desencadeada pela desnaturação térmica da fitase (Kornegay, 2001). Segundo Jongbloed & Kemme (1990), as fitases de origem vegetal são mais termolábeis que as de origem microbiana. Em comparação com as fitases de microrganismos e plantas, investigações sobre as fitases de origem animal são muito limitadas e, portanto, não serão discutidas neste trabalho. 2.2.2.2 Fitases de origem microbiana Dois fatores importantes conduziram ao desenvolvimento da fitase microbiana tornando-a economicamente viável para ser usada em escala comercial nas dietas das aves e suínos: o avanço da biotecnologia e o aperfeiçoamento das técnicas de fermentação (Kornegay, 2001). Em geral, as fitases de origem microbiana são mais estáveis a variações no pH e temperatura do que as fitases de plantas (Konietzny & Greiner, 2002). Eeckhout & Paepe (1991) concluíram que a resposta obtida in vivo (em suínos) para a fitase microbiana (500U kg-1) foi 74% mais eficiente do que a observada, em ensaios in vitro, para a fitase do trigo (500U kg-1). Eles demonstraram que a fitase presente no trigo é ativa cataliticamente em estreito espectro de pH e é menos efetiva no intestino. Além disso, é mais susceptível à desnaturação em baixo pH e à digestão proteolítica do que a fitase de Aspergillus niger (Phillippy, 1999). A sensibilidade da fitase ao calor deve ser considerada para qualquer processamento térmico realizado após a aplicação da enzima. As fitases extracelulares de origem microbiana são moderadamente estáveis ao calor. Fitases termoestáveis foram isoladas do Bacillus sp. DS11 (Kim et al., 1998) e A. fumigatus. A enzima de A. fumigatus tem atividade em ampla variação de pH e pode resistir a temperaturas extremas de 100°C por 20 minutos ou 90°C por 120 minutos. O gene que codifica esta enzima tem sido clonado e super- 9 expresso em A. niger. A fitase de A. fumigatus é um exemplo de enzima com alto potencial comercial, já que pode resistir às condições de peletização da ração sem perdas significativas de atividade (Pasamontes et al., 1997). Entretanto, esse é um caso particular de fitase com alta resistência à desnaturação térmica. Várias fitases microbianas distintas estão atualmente disponíveis no mercado. As três fitases mais comuns são derivadas de A. niger, que é uma 3fitase; Peniophora lycii e Escherichia coli, que são 6-fitases (Garrett et al., 2004). 2.2.3 Propriedades moleculares, catalíticas e classificação das fitases A primeira fitase caracterizada (phy A), sintetizada pelo microrganismo A. niger, é codificada por um fragmento de DNA de 1,4kb, possui massa molecular (MM) de 80kDa e 10 locais de N-glicosilação (Han & Lei, 1999). O valor descrito para mensurar a MM das fitases é variado. Segundo Choi et al. (2001), a MM de fitases bacterianas é menor do que a observada para as fitases fúngicas (40−55 versus 80−120kDa). Konietzny & Greiner (2002) estimam valores, para as fitases em geral, entre 40 e 70kDa. De acordo com Greiner (2002), a MM de três fitases isoladas de sementes de tremoço (Lupinus albus var. Amiga) variou de 57 a 64kDa. Todavia, Vats & Banerjee (2004) relataram que as fitases têm MM estimada entre 35−700kDa dependendo da sua origem. A fitase (hexafosfato de mio-inositol fosfo-hidrolase) catalisa a reação de desfosforilação do ácido fítico ou fitato em ésteres de fosfato de mio-inositol menores e Pi (Lei & Porres, 2003). Apresentam a cinética clássica de Michaelis-Menten, ou seja, a liberação de Pi é dependente da concentração do substrato (Vats & Banerjee, 2004). A atividade da fitase é, normalmente, expressa em unidades de fitase (FTU), sendo 10 que uma FTU é a quantidade de Pi liberado (µmol) durante um minuto de reação em uma solução de fitato de sódio 5,1mmol L-1 em pH 5,5 e temperatura de 37°C (Engelen et al., 1994). Algumas outras abreviações incluindo FYT, U e PU, têm sido usadas para indicar a atividade de diferentes fitases microbianas comerciais, embora estas siglas tenham sido definidas sob condições in vitro similares às definidas para FTU. O número de fitases descritas aumentou durante a última década (Konietzny & Greiner, 2002). Entretanto, nem todas são estruturalmente semelhantes nem liberam o grupo fosfato pelo mesmo mecanismo (Mullaney & Ullah, 2003). A ação catalítica da fitase sobre o fitato pode resultar em diferentes isômeros de posição, dependendo da origem da enzima. Como a hidrólise enzimática do fitato é um processo serial, em que cada fosfato de mioinositol menor pode ser o substrato para a hidrólise seguinte, acredita-se que a liberação de ortofosfato tenha limitações (Konietzny & Greiner, 2002). As fitases são divididas em duas categorias, de acordo com o local do anel de mio-inositol onde a hidrólise se inicia. A 3-fitase (E.C. 3.1.3.8; hexafosfato de mio-inositol 3-fosfo-hidrolase) libera preferencialmente o fosfato da posição C3, enquanto a 6-fitase (E.C. 3.1.3.26; hexafosfato de mio-inositol 6fosfo-hidrolase) inicia a hidrólise na posição C6 do anel de mio-inositol. De um modo geral, as 6-fitases são comumente encontradas nas plantas, enquanto as 3fitases são produzidas por microrganismos, em especial os fungos (Dvrøáková, 1998; Konietzny & Greiner, 2002). Entretanto, as fitases de Escherichia coli e Peniophora lycii são exceções, pois são 6-fitases (Greiner et al., 1993; Lassen et al., 2001). As 3 e 6-fitases possuem distintas especificidades pelo substrato e liberam diferentes fosfatos de mio-inositol menores (Wyss et al., 1999). Esses dois tipos de fitases diferem na estrutura, propriedades físico-químicas e catalíticas (Ullah & Sethumadhavan, 1996). 11 Segundo Zyla et al. (2004), a 3-fitase (A. ficuum) foi mais efetiva do que a 6-fitase (P. lycii) na desfosforilação e na liberação do cálcio sob condições que simulavam a digestão no trato intestinal dos frangos de corte. A 6-fitase apresentou atividade em estreita variação de pH e foi menos estável, em meio ácido, que a 3-fitase. Igbasan et al. (2000) relataram que a fitase de P. lycii é menos termoestável e menos resistente à digestão pela pepsina e pancreatina que a fitase de A. niger. Entretanto, quanto à performance de crescimento, mineralização óssea e retenção de P, não houve diferença significativa entre os dois tipos de fitase. Para uma enzima ser uma fitase ela deve exibir atividade de fosfatase. Dependendo do perfil pH x atividade e do pH ótimo de catálise, as fitases são classificadas como fosfatase ácida, neutra ou alcalina (Mullaney & Ullah, 2003). As fitases ácidas normalmente apresentam pH ótimo entre 4,5 e 6,0 e as alcalinas em pH próximo a 8,0 (Konietzny & Greiner, 2002). A maioria dos estudos atuais compreende as fosfatases ácidas com alta especificidade pelo substrato ácido fítico. Dentro da divisão “fosfatase ácida”, três classes são descritas de acordo com diferenças estruturais e variações em suas propriedades catalíticas. São elas: histidina fosfatases ácidas (HFA), fitases ß-hélice (FBH) e fosfatases ácidas “purple” (FAP) (Mullaney & Ullah, 2003). A primeira classe é a que possui maior número de representantes, sendo caracterizada pela presença de uma sequência conservada no sítio ativo composta por sete aminoácidos (RHGXRXP) e um dipeptídeo cataliticamente ativo (His361Asp362). Entre as enzimas que pertencem a essa classe, a atividade específica pelo ácido fítico é variada. Wyss et al. (1999) compararam as propriedades catalíticas de várias fitases fúngicas e propuseram duas subclasses HFA. Uma subclasse contempla as fosfatases com ampla especificidade de substrato, ou seja, aquelas que atuam sobre vários substratos fosfatados, mas possuem baixa atividade específica pelo ácido fítico. A outra, contém aquelas 12 enzimas com estreita especificidade de substrato, mas com alta atividade específica por fitato. A fitase phy A de A. niger NRRL 3135, comercializada como Natuphos, é amplamente conhecida por sua alta atividade específica pelo ácido fítico (Wodzinski & Ullah, 1996). As demais classes (FBH e FAP) não possuem a sequência específica do heptapeptídeo e/ou o dipeptídeo cataliticamente ativo (Ostanin & Etten, 1993). A FBH é uma classe recentemente descoberta representada pela fitase phy C de Bacillus subtilis e TS-Phy de Bacillus amyloliquefaciens. Buscas no banco de dados de proteínas (Protein Data Bank) revelaram não haver nenhuma outra fosfatase, disponível no banco de dados, com estrutura semelhante à apresentada pelas phy C e TS-Phy. Essas duas fitases são dependentes de Ca2+ para serem ativas e termoresistentes (Oh et al., 2001). As fosfatases classificadas como FAP são metaloenzimas. Dentre as enzimas que representam essa classe apenas a GmPhy, recentemente isolada do cotilédone de soja (Glycine max L. Merr.) (Hegeman & Grabau, 2001), é a que apresenta atividade de fitase significativa (Mullaney & Ullah, 2003). Teoricamente, a hidrólise enzimática completa do fitato gera uma série e ésteres fosfatos de mio-inositol menores (IP6 → IP5 → IP4 → IP3 → IP2 → IP1) por meio de uma série de reações de desfosforilação, para produzir o mioinositol (Figura 3) e seis Pi. É importante notar, entretanto, que as fitases são estereoespecíficas e apresentam forte preferência pelos grupos fosfatos ligados equatorialmente ao anel de mio-inositol, sendo o grupo fosfato disposto axialmente no C2 resistente à hidrólise enzimática (Lei & Porres, 2003). Consequentemente espera-se que a hidrólise do fitato pela fitase libere como produtos o monofosfato de mioinositol (IP1) e cinco Pi. Todavia, a hidrólise do fitato por fitases exógenas em frangos de corte não prossegue usualmente nesta dimensão (até IP1) (Wodzinski & Ullah, 1996; Maenz, 2001). 13 H OH OH H H OH H H OH OH H OH FIGURA 3 Estrutura do mio-inositol. Independente da origem (bacteriana, fúngica ou vegetal) as fitases ácidas conhecidas hidrolisam, no máximo, 5 dos 6 grupos fosfatos presentes no fitato. Assim, o mio-inositol fosforilado no C2 + 5Pi têm sido identificados como produtos finais. Somente em raros casos traços de mio-inositol livre foram identificados (Wyss et al., 1999). Já a fitase alcalina de B. subtilis, por exemplo, não é capaz de utilizar como substrato o mio-inositol fosfatado com 3 ou menos grupos fosfatos presentes no anel. Desta forma, o trifosfato de mio-inostiol + 3Pi são os produtos finais da hidrólise do fitato pela fitase de B. subtilis (Kerovuo et al., 2000b). Até o momento, a elucidação do mecanismo de hidrólise do fitato pela fitase é conhecida apenas em raros casos (Konietzny & Greiner, 2002). 2.2.4 Local de ação Comercialmente, a avicultura é um importante segmento da agropecuária e a necessidade de diminuir os custos de produção tem impulsionado diversas pesquisas com rações suplementadas com fitase (Bertechini, 2006). Todavia, o local de atividade da fitase no trato gastrointestinal desses animais tem recebido 14 pouca atenção. Porém, é provável que a maior parte da hidrólise se inicie no papo tendo continuidade no proventrículo e moela, onde o pH favorece a atividade das fitases ácidas. O papo é, provavelmente, o local primário da degradação do fitato pelas fitases exógenas (Kerr et al., 2000). Liebert et al. (1993) relataram, em estudos com galinhas, que 69-86% da atividade da fitase microbiana adicionada à ração foi detectada no papo e 31-38% no proventrículo. Nenhuma atividade foi detectada no intestino delgado. Entretanto, há evidências de que a fitase derivada de E. coli seja mais ativa no intestino delgado do que a derivada de P. lycii (Onyango et al., 2005), o que pode ser atribuído à grande resistência da fitase derivada de E. coli frente às enzimas proteolíticas endógenas (Igbasan et al., 2000). Avaliações no íleo e no trato total indicam que a degradação do fitato é incompleta nos frangos de corte alimentados com rações suplementadas com fitase. A hidrólise do fitato por fitase de A. niger com atividade de 500FTU kg-1 de ração foi determinada no íleo em dois estudos separados, nos quais as aves receberam dietas a base de milho e soja. Camden et al. (2001) descreveram que a fitase degradou 29,3% do fitato presente na dieta, enquanto Tamim et al. (2004) relataram um valor de 33,5%. Deste modo, esses dois estudos sugerem que a fitase microbiana não degrada todo fitato presente na dieta de frangos de corte. Leske & Coon (1999) determinaram a dimensão da hidrólise do fitato em variadas dietas suplementadas com fitase de A. niger. A suplementação de sete dietas para frangos de corte com 600FTU kg-1 degradou, em média, 25,4% do fitato. Já em poedeiras, quando 300FTU kg-1 foi adicionado a três distintas dietas, o resultado foi de 37,7%. A forma na qual o fitato residual está presente no intestino é de interesse. Resultados obtidos in vitro (Frolich et al., 1986) e em suínos (Rapp et al., 2001) indicam que o fitato residual permanece em grande parte intacto (IP6) com quantidades relativamente pequenas de ésteres de fosfato mio-inositol menores. 15 Isto é importante porque a capacidade quelante desses ésteres menores é desproporcionalmente menor que a do IP6. Tem sido mostrado in vitro que, em relação ao Zn e Cu, as forças de ligação do IP4 e IP3 são menores do que as do IP6 e IP5 (Persson et al., 1998). Além do mais, a capacidade (in vitro) do fitato em inibir a pepsina da digestão da caseína e albumina soro bovina é mais pronunciada para IP5 e IP6, enquanto o IP1 e IP2 não inibiram a atividade da pepsina (Knuckles et al., 1989). Há poucas informações descrevendo a hidrólise do fitato durante a passagem pelo intestino. Após o consumo de uma refeição, é provável que o ácido fítico fique parcialmente protonado tornando-se susceptível à hidrólise durante sua residência no estômago ou no papo. Normalmente, o pH ótimo para a atividade da fitase é próximo a 5,0 estando abaixo do pH efetivo na formação de complexos ácido fítico-mineral resistentes a fitase. Nas regiões superiores ao intestino delgado, o pH aumenta favorecendo a formação desses complexos. De acordo com o anteriormente exposto, Maenz et al. (1999) concluíram, em estudos in vitro, que a adição de solução de Ca2+ 0,5M não inibiu a fitase microbiana em pH 5,0. Todavia, observaram uma inibição completa com a adição de uma concentração bem menor (Ca2+ 0,005M) quando o pH aumentou para 7,5. Embora de forma indireta, a vitamina D pode interferir positivamente na atividade da fitase por aumentar a absorção do Ca2+ e, consequentemente, limitar a formação de complexos insolúveis resistentes à hidrólise enzimática (Pointillart, 1993). 2.2.5 Fatores físicos e químicos que afetam a estabilidade e a atividade da fitase A fitase ideal é aquela que mantém atividade nas diferentes condições encontradas no trato gastrointestinal e nas condições usadas no processamento dos alimentos. A ação catalítica de qualquer enzima é determinada por suas 16 estruturas primária, secundária, terciária e quaternária (quando houver). Alterações de fatores físico-químicos alteram sua estrutura o que pode acarretar em redução da atividade. Em casos severos, a atividade pode ser totalmente anulada. Os benefícios adquiridos com a adição de enzimas exógenas nas dietas de aves são amplamente documentados (Maenz, 2001; Bertechini, 2006; Selle & Ravindran, 2007). Entretanto, fatores físicos e químicos podem interferir na atividade das fitases, conforme descrito a seguir. 2.2.5.1 pH Mudanças no pH afetam o caráter iônico dos grupos ionizáveis dos aminoácidos que compõem as fitases alterando sua conformação tridimensional e, consequentemente, sua atividade catalítica. Uma segunda fitase (phy B) foi isolada de A. niger NRRL 3135 (Ullah & Cummins, 1987). Suas propriedades catalíticas diferem da phy A. Quando a phy B foi isolada pela primeira vez e teve sua atividade de fitase determinada, o ensaio foi conduzido em pH 5,0 (pH ótimo observado para a phy A). Entretanto, o pH ótimo para a phy B é menor (pH 2,5) e pouca, ou nenhuma, atividade foi observada em pH 5,0. Essa baixa atividade no pH 5,0 pode ser entendida analisando o sítio de especificidade pelo substrato (SES). Kostrewa et al. (1999) identificaram que o SES da phy B é diferente do SES da phy A. O SES da phy B é eletrostaticamente mais neutro e, portanto, pode acomodar maior variedade de substratos que a fitase phy A. Isso também significa que no pH 2,5 o SES da phy B não está carregado e aceita substratos carregados negativamente; entretanto, em pH 5,0 está negativamente carregado e repele o substrato carregado negativamente. 17 2.2.5.2 Temperatura Outra diferença entre a phy A e phy B de A. niger é que a forma ativa da phy A é um monômero, enquanto que a forma ativa da phy B é um tetrâmero (Wyss et al., 1998). Essa estrutura tetramérica inicialmente confere termoestabilidade à phy B, mas também torna a enzima incapaz de retornar à sua conformação original depois de ter sido desnaturada pelo calor, diferente do que acontece com a phy A. Os protômeros individuais são aparentemente incapazes de reassociar-se à forma ativa depois do tetrâmero phy B ter sido desnaturado. A peletização das rações (processo mecânico durante o qual há aglomeração de pequenas partículas por meio de calor úmido entre 70−90°C e pressão exercida por uma prensa de pelete) melhora a palatabilidade e o valor nutricional dos alimentos aumentando o consumo e consequentemente, o ganho de peso e eficiência alimentar das aves em crescimento. Assim, fitases podem ser acrescentadas à ração antes da peletização (o que permite melhor homogeneização), mas é necessário que sejam termoresistentes às condições desse processo. O revestimento químico de fitases tem sido usado para melhorar sua estabilidade térmica; entretanto, pode comprometer sua atividade no local de ação. Fitases em meio líquido podem ser adicionadas às rações após a peletização, mas isso torna o trabalho laborioso e necessita de equipamentos caros. Assim, pesquisas objetivando aumentar a termoresistência das fitases utilizam técnicas de biotecnologia (mutações direcionadas, técnicas de recombinação genética, busca por organismos termofílicos produtores de fitase, etc) as quais tem se mostrado uma excelente ferramenta para melhorar a termoresistência de fitases potencias para a utilização na alimentação animal A termoestabilidade de uma enzima é dada por sua capacidade de resistir à desnaturação térmica e/ou à habilidade de retornar a sua conformação tridimensional original depois do processamento térmico (Lei & Porres, 2003). 18 2.2.5.3 Glicosilação e íons metálicos Várias fitases fúngicas e de origem vegetal são glicosiladas. A manose e galactose ligadas à extremidade N-terminal da enzima nativa de A. niger NRRL 3135 correspondem a 27,3% de sua massa molecular (Ullah, 1988). A glicosilação (ou desglicosilação) pode afetar as propriedades catalíticas, estabilidade e ponto isoelétrico das fitases (Konietzny & Greiner, 2002). Algumas fitases podem ser inibidas por íons metálicos, mas é difícil determinar se a inibição é resultado da ligação do metal à enzima ou à formação de complexo ácido fítico-íon pobremente solúvel. A formação de precipitado pela adição de Fe2+ ou Fe3+ no ensaio enzimático sugere que há redução na concentração de substrato ativo pela formação de complexo ácido fítico-Fe pobremente solúvel (Konietzny et al., 1995). Segundo Konietzny & Greiner (2002), a maioria das fitases é inibida por Cu2+ e Zn2+. Maenz et al. (1999) avaliaram o potencial inibitório, em pH neutro, de diferentes minerais sobre a atividade de fitases microbianas e descreveram a seguinte ordem de inibição: Zn2+>>Fe2+>Mn2+>Fe3+>Ca2+>Mg2+. Diminuições no pH acarretaram em redução considerável destes efeitos, pois a protonação dos grupos fosfatos desloca o mineral convertendo o fitato que estava na forma de complexos resistentes para formas suscetíveis à fitase (Maenz, 2001). Por outro lado, certas fitases dependem de certos íons metálicos para exercerem atividade catalítica. Segundo Kerovuo et al. (2000a), a fitase de B. subtilis é dependente de Ca+2 e, portanto, a presença de EDTA diminui a atividade enzimática. 2.2.5.4 Agentes redutores e inibidores Reagentes redutores tais como 2-mercaptoetanol, ditiotreitol e glutationa reduzida podem romper ligações dissulfeto. A atividade catalítica é dependente da conformação tridimensional da enzima assim, a presença de agentes redutores 19 pode reduzir ou até mesmo anular a atividade enzimática. Ullah & Mullaney (1996) concluíram que as ligações dissulfeto na fitase de A. niger desempenham importante papel no seu dobramento tridimensional característico. O fluoreto pode agir como inibidor competitivo em fitases, assim como o ortofosfato resultante da hidrólise (inibição pelo produto). O molibdato e vanadato são também conhecidos inibidores de fitases. Acredita-se que esses derivados de metais de transição exerçam seu efeito inibitório por formarem complexos que se assemelham à geometria de bi-pirâmide trigonal do estado de transição (Zhang et al., 1997). 2.2.5.5 Armazenamento O armazenamento pode acarretar redução da atividade da fitase. Todavia, praticamente não há relatos na literatura sobre a perda de atividade enzimática em diferentes formas e durante o período de armazenamento. Além disso, como há várias fitases disponíveis no mercado não se sabe se todas perdem atividade, durante o armazenamento, da mesma maneira. Pesquisas com esses objetivos são importantes, pois permitem que a indústria assegure ao produtor por quanto tempo e de que forma tal produto pode ser armazenado sem que haja perdas significativas dos benefícios promovidos pela fitase. Pizzolante et al. (2002a) determinaram a atividade da fitase de A. niger, na forma original (como adquirida), em três tipos de armazenamento: no congelador a 0°C, no refrigerador a 4°C e em temperatura ambiente (TA). A atividade foi determinada a cada 14 dias durante o período máximo de armazenamento de 112 dias. Concluíram que o armazenamento da fitase a 0°C acarretou a maior atividade média durante o período do experimento (5.177FTU g-1), entretanto, esse valor foi apenas 4,9% maior do que a média observada para a fitase armazenada em TA (4.935FTU g-1). Além disso, relataram que a atividade enzimática da fitase armazenada em TA reduziu em até 7,7% durante o 20 período de armazenamento. 2.2.6 Considerações O uso da fitase em dietas das aves é uma realidade atual e vem ao encontro das necessidades de otimização dos custos das rações bem como a produção animal com responsabilidade ambiental (Bertechini, 2006). As pesquisas até então realizadas indicam boa eficácia da fitase. Por outro lado, ainda faltam informações comparativas entre as fitases quanto à manutenção da atividade em situações químicas e físicas diferentes. 21 3 MATERIAL E MÉTODOS 3.1 Procedimentos experimentais e fitases utilizadas O presente trabalho foi conduzido no Laboratório de Bioquímica/Departamento de Química/Universidade Federal de Lavras−UFLA, em três etapas. Na primeira etapa, a atividade enzimática foi determinada em duas formas de armazenamento das fitases, durante o período máximo de 180 dias. Na segunda, avaliou-se o efeito do pH e temperatura na atividade das fitases. A última etapa constou de dois experimentos para avaliar o efeito de três tempos de exposição ao calor sobre a atividade das fitases incorporadas a dois tipos de rações para frangos de corte, durante um período máximo de armazenamento de 60 dias em temperatura ambiente. Foram utilizadas as seguintes enzimas: a) 6-fitase E.C. 3.1.3.26 (sintetizada pelo microrganismo Aspergillus oryzae geneticamente modificado pela adição do gene do fungo Peniophora lycii) com atividade de 5.000FTU g-1, segundo o fabricante. b) 3-fitase E.C. 3.1.3.8 (produzida por A. niger modificado geneticamente pela adição do gene que codifica fitase de A. ficuum) com atividade de 10.000FTU g-1, segundo o fabricante. c) 6-fitase E.C. 3.1.3.26 (sintetizada pela levedura Saccharomyces cerevisae, sendo que as bactérias Citrobacter brakii e Escherichia coli foram usadas como microrganismos bases − seleção genética) com atividade de 10.000FTU g-1, segundo o fabricante. A temperatura e a umidade relativa mínima e máxima do local de armazenamento foram registradas com o uso de termo-higrômetro digital, a cada sete dias, durante o período do experimento. 22 3.2 Extração da fitase e determinação da atividade enzimática A extração da fitase foi feita em tampão acetato 0,25mol L-1 [contendo 0,05% de Triton X-100 (p/v) e 0,05% de albumina do soro bovino (p/v)], em pH 5,0 sob agitação horizontal por 30 minutos na presença de gelo. Após a extração, a amostra foi centrifugada (2.000 x g por 10 minutos a 4°C) e o sobrenadante recolhido. A determinação da atividade no sobrenadante baseou-se na ação da fitase sobre o substrato fitato de sódio 7,5mmol L-1 (C6H6O24P6Na12 − SigmaAldrich), em meio tamponado (tampão acetato 0,25mol L-1; pH 5,0), a 37°C por quatro diferentes tempos de incubação (máximo de 20 minutos para a determinação da atividade nas fitases originais; e máximo de 60 minutos no núcleo e nas rações suplementadas com as fitases). A reação foi interrompida por uma mistura de três soluções (ácido nítrico 21,67%, molibdato de amônia 0,081mol L-1 e vanadato de amônia 0,02mol L-1) nas proporções de 2:1:1, respectivamente, com formação de produto amarelo o qual possui absorção máxima no comprimento de onda de 415nm. O fosfato de potássio foi usado como padrão (Engelen et al., 1994). O cálculo da atividade foi feito utilizando-se a inclinação da reta resultante do ensaio com a amostra (absorbância/min) e a inclinação da reta da curva padrão (absorbância/µmol de P). A atividade da fitase foi expressa em unidades de FTU, sendo que uma FTU é a quantidade de Pi liberado (em µmol) em 1 minuto de reação em uma solução de fitato de sódio 7,5mmol L-1; pH = 5,0 e a 37°C. 3.3 Primeira etapa 3.3.1 Armazenamento das fitases As fitases foram armazenadas em recipientes hermeticamente fechados, à temperatura ambiente e em quatro repetições cada, nas seguintes formas: original (como adquirida) e incorporada a um núcleo contendo mistura de vitaminas, minerais e aminoácidos. A atividade das fitases nas formas originais 23 foi determinada após 0; 60; 90; 120; 150 e 180 dias de armazenamento e expressa em FTU g-1 de enzima, enquanto que nas formas incorporadas a atividade foi determinada a cada 30 dias, durante um período máximo de 180 dias de armazenamento, e expressa em FTU kg-1 de núcleo. 3.3.2 Formulação do núcleo Os componentes do núcleo foram adquiridos separadamente e, em seguida, misturados com uso de sacos plásticos. A composição percentual dos ingredientes presentes no núcleo consta na Tabela 1. TABELA 1 Composição percentual dos ingredientes presentes no núcleo. Descrição do ingrediente (%) Suplemento vitamínico 4,00 Suplemento mineral 4,00 DL- metionina 99% 4,00 Fosfato bicálcico 48,20 Calcário calcítico 20,10 L-lisina 99% 3,45 Cloreto de colina 70% 2,00 Fitase 0,40* Sal 13,85** *Taxa de inclusão baseada na fitase com 10.000FTU g-1. **A taxa de inclusão de sal varia em função da taxa de inclusão da fitase de forma que a taxa de inclusão final, destes dois componentes, seja igual a 14,25%. A composição detalhada dos suplementos vitamínico e mineral está descrita na Tabela 2. 24 TABELA 2 Composição dos suplementos vitamínico e mineral. Composição do suplemento vitamínico Vitaminas Níveis kg-1 Composição do suplemento mineral Minerais mg kg-1 Vitamina A 12.000.000 UI Ferro 50.000 Vitamina D3 2.200.000 UI Cobre 8.500 Vitamina E 30.000 mg Zinco 70.000 Vitamina K 2.500 mg Manganês 75.000 Niacina 53.000 mg Iodo 1.500 Ácido fólico 1.000 mg Cobalto Ácido pantotênico 13.000 mg Biotina 200 110 mg Vitamina B1 2.200 mg Vitamina B2 6.000 mg Vitamina B6 3.300 mg Vitamina B12 16 µg Selênio (mineral) 250 mg 3.3.3 Incorporação das fitases ao núcleo de vitaminas, minerais e aminoácidos As fitases foram adicionadas ao núcleo na forma em pó com teor de inclusão de 40.000FTU kg-1 de núcleo. Para assegurar que cada tratamento fosse suplementado com a mesma atividade de fitase kg-1 de núcleo, cada enzima teve sua atividade determinada assim que foi adquirida, sendo a resposta (em FTU g-1 de enzima) considerada como a atividade inicial. Assim, o cálculo da quantidade de fitase adicionada ao núcleo foi feito a partir da atividade inicial de cada enzima. Portanto, a taxa de inclusão média da fitase de A. oryzae foi de 11,76g kg-1 de núcleo, enquanto que para a fitase de A. niger foi de 3,74g kg-1 de núcleo. 25 3.4 Segunda etapa 3.4.1 Efeito do pH e da temperatura na atividade das fitases A determinação da curva de pH foi feita por meio da incubação da fitase com o fitato de sódio 7,5mmol L-1 a 37°C variando-se os valores de pH (2, 3, 4, 5, 6, 7, 8 e 9), em quatro diferentes tempos de incubação, a fim de se determinar o pH ótimo que é aquele no qual a enzima apresenta maior atividade catalítica. Inicialmente, foram utilizados os seguintes tampões: HCl-KCl (pH 2,0); glicinaHCl (pH 2,0 e 3,0); citrato (pH 3,0; 4,0; 5,0 e 6,0); maleato (pH 6,0 e 7,0) e trisHCl (pH 7,0; 8,0 e 9,0). Todavia, não foi determinada atividade em nenhum pH do tampão citrato, para as três enzimas avaliadas. Assim, o tampão citrato foi substituído pelo tampão acetato (pH 3,0; 4,0; 5,0 e 6,0), mantendo-se os demais tampões. Todos os tampões usados nesta etapa foram preparados na concentração de 0,1mol L-1. Os ensaios de temperatura foram realizados no pH ótimo préestabelecido para cada fitase com concentração do substrato fixa (7,5mmol L-1), em quatro diferentes tempos de incubação, nas seguintes temperaturas: 20, 30, 40, 50, 60, 70, 80 e 90°C. 3.5 Terceira etapa Nem sempre é possível interromper o ciclo de produção normal de indústrias de ração para que as amostras de experimentos sejam peletizadas. Portanto, simulações em escalas laboratoriais são necessárias para que seja possível quantificar as perdas de atividade enzimática após determinados processamentos térmicos, além de serem importantes para contribuir com a padronização de metodologias cada vez mais eficientes e próximas da realidade. 3.5.1 Formulação das rações Na Tabela 3 está descrita a composição das rações. 26 TABELA 3 Composição das rações de acordo com as fases estudadas. Fases Inicial (1 a 7 dias) 588,35 Final (36 a 42 dias) 658,25 Farelo de soja 360,00 284,00 Óleo de soja 19,40 33,50 Fosfato bicálcico 13,00 8,50 Calcário calcítico 6,00 5,00 Sal 4,40 3,70 DL-metionina 99% 3,60 2,10 L-lisina 99% 2,50 2,20 Suplemento vitamínico 1,00 1,00 Suplemento mineral 1,00 1,00 Cloreto de colina 70% 0,50 0,50 Bacitracina de zinco 10% 0,25 0,25 1.000g 1.000g Ingredientes Milho TOTAL 3.5.2 Incorporação das fitases às rações As fitases foram adicionadas às rações na forma em pó com teor de inclusão de 3.000FTU kg-1 de ração. Cada tratamento foi suplementado com a mesma atividade de fitase, pois o cálculo da quantidade de fitase adicionada à ração foi feito a partir da atividade determinada na forma original momentos antes da suplementação, que foi de 1.410FTUg-1 para a fitase de A. oryzae e de 7.946FTU g-1 para a fitase de A. niger. Portanto, a taxa de inclusão média da fitase de A. oryzae foi de 2,128g kg-1 de ração, enquanto que para a fitase de A. niger foi de 0,378g kg-1 de ração. 27 3.5.3 Rações suplementadas com fitase, processamento térmico e armazenamento Experimento 1: Conduzido com dois tipos de rações para frangos de corte (fase inicial e fase final − subitem 3.5.1) suplementadas com as fitases (subitem 3.5.2) sendo estabelecidos quatro tratamentos, com três repetições cada: rações sem processamento térmico (controle) e submetidas à estufa ventilada entre 80°C e 85°C por três tempos de exposição ao calor: 4, 8 e 12 minutos. Para cada repetição, 100g de cada ração foram espalhadas sobre uma bandeja de alumínio (30 x 20cm). Antes da exposição ao calor, as rações (exceto as do grupo controle) foram umidificadas em 8% (p/p) com o uso de dispersor de água na tentativa de simular a umidade do processo de peletização no qual há exposição da ração ao calor úmido. Posteriormente, todas as rações tiveram a atividade de fitase determinada. Experimento 2: As rações de fase inicial foram armazenadas em recipientes hermeticamente fechados à temperatura ambiente, sendo a atividade das fitases determinada a cada 15 dias, durante um período máximo de 60 dias de armazenamento. Como controle de qualidade do experimento, as rações controle e submetidas a três tempos de exposição ao calor tiveram o teor de umidade determinado. A atividade das fitases, em ambos os experimentos, foi corrigida em relação ao teor de umidade e expressa em FTU kg-1 de matéria seca − MS. 3.5.4 Determinação da umidade O teor de umidade nas rações suplementadas com as fitases foi determinado por aquecimento em estufa, em temperatura entre 100oC e 105oC, até peso constante (Association of Official Analytical Chemistry - AOAC, 2000). 28 3.6 Análises estatísticas Todas as três etapas foram conduzidas em delineamento inteiramente casualizado (DIC). Na primeira etapa, a estatística foi aplicada de forma independente para cada enzima. Para cada fitase armazenada na forma original obteve-se seis tratamentos (0; 60; 90; 120; 150 e 180 dias de armazenamento) em quatro repetições. Já para as fitases incorporadas ao núcleo, um total de sete tratamentos (0; 30; 60; 90; 120; 150 e 180 dias de armazenamento), com quatro repetições cada. Na segunda etapa, a estatística foi utilizada de forma a analisar o efeito do pH e da temperatura de forma independente entre si e de forma independente para cada fitase. Portanto, essa parte do experimento foi realizada inicialmente com oito tratamentos e quatro repetições. Entretanto, a análise de variância dos resultados obtidos do ensaio de pH foi feita com 5 valores de pH, excluindo-se 3 em que a atividade foi zero, sem comprometimento da qualidade da pesquisa. Isso foi feito porque a inclusão desses dados gera equações de regressão de 4o ou maior grau, as quais não correspondem ao perfil geral de 3o grau (pH x atividade) observado para a maioria das enzimas. Já a análise de variância dos resultados obtidos do ensaio do efeito da temperatura foi feita com 5 diferentes temperaturas para a fitase de A. oryzae; 6 para a de A. niger e 7 para a de S. cerevisae, excluindo-se apenas valores de atividade iguais a zero, pelo mesmo motivo citado anteriormente, e também sem comprometimento da qualidade da pesquisa. Em ambas as etapas, quando a análise de variância foi significativa, se empregou modelos de regressão para as fontes de variação, a 5% de probabilidade. O experimento 1 da terceira etapa foi analisado estatisticamente em esquema fatorial 2x4, ou seja, dois tipos de ração (fase inicial e fase final) e quatro tratamentos (ração controle e submetidas a três tempos de exposição ao calor), com três repetições cada. Os dados foram submetidos à análise de 29 variância, e quando significativa, o teste de Tukey, a 5% de probabilidade, foi usado para as comparações das médias entre os tratamentos e entre os tipos de ração de forma independente para cada uma das duas fitases avaliadas (nesse momento não houve influência do tempo de armazenamento das rações, pois a determinação da atividade foi feita no mesmo dia em que as rações foram suplementadas com as enzimas). O experimento 2 desta mesma etapa, foi conduzido apenas com a ração de fase inicial em parcelas divididas no tempo, sendo a parcela constituída por 4 tratamentos (ração controle e submetidas a três tempos de exposição ao calor) e a sub-parcela por 5 tempos de armazenamento (0; 15; 30; 45 e 60 dias), com três repetições cada. Os dados foram submetidos à análise de variância e, quando significativa, o teste de Tukey foi usado para as comparações das médias entre os tratamentos, a 5% de probabilidade. A fonte de variação tempo de armazenamento foi analisada estatisticamente empregando-se modelos de regressão (Pimentel Gomes, 1990). Todas as análises estatísticas foram realizadas com o uso do software SISVAR (Sistema de Análise de Variância para Dados Balanceados) versão 5.1. 30 4 RESULTADOS E DISCUSSÃO 4.1 Primeira etapa: armazenamento A temperatura e a umidade relativa mínima e máxima do local de armazenamento foram, respectivamente, 18 ± 2°C e 26 ± 2°C; 42 ± 11% e 75 ± 8%. As determinações da atividade da fitase de S. cerevisae não apresentaram padrões de repetibilidade, ou seja, a atividade diminuiu e aumentou várias vezes durante o período de armazenamento avaliado. Portanto, essa etapa está descrita com as fitases de A. oryzae e A. niger. A análise de variância da atividade das fitases de A. oryzae e A. niger nas formas originais, em função do tempo de armazenamento, foi significativa (P<0,01) (Tabela 1A, Anexos). De um modo geral, foi observado que o aumento do tempo de armazenamento acarretou diminuição da atividade de ambas as fitases avaliadas (Figura 4), com redução máxima de até 64,8% para a fitase de A. oryzae e até 25,7% para a fitase de A. niger. Neste trabalho, a atividade da fitase de A. niger diminuiu linearmente (R2 de 0,9836) em 16,28% durante os primeiros 112 dias de armazenamento em temperatura ambiente (TA). Em pesquisa semelhante, Pizzolante et al. (2002a) relataram uma redução de 7,7% para a mesma fitase e no mesmo período de armazenamento, entretanto, essa redução foi explicada por uma equação quadrática com R2 de 0,9491. A perda linear de atividade durante o armazenamento, provavelmente, é a que melhor representa a realidade, pois indica que o efeito do tempo sobre a desnaturação enzimática é o mesmo de 1 a 112 dias de armazenamento das fitases. Adotando a perda de atividade em 20% como tolerável, as fitases de A. oryzae e A. niger podem ser armazenadas, em TA, nas formas originais por aproximadamente até 53 e 135 dias, respectivamente. 31 12.000 atividade (FTU g-¹) y = -15,959x + 10754 10.000 2 R = 0,9836 8.000 6.000 y = -14,546x + 3864,1 4.000 2 R = 0,9811 2.000 0 0 30 60 90 120 150 180 tempo de armazenamento (dias) A. oryzae Regressão A. oryzae A. niger Regressão A. niger FIGURA 4 Atividade das fitases de A. oryzae e A. niger, nas formas originais, em função do tempo de armazenamento. O armazenamento também acarretou perda de atividade nas duas fitases incorporadas ao núcleo (P<0,01) (Tabela 2A, Anexos). As curvas e equações representativas da atividade das fitases incorporadas ao núcleo, em função do tempo de armazenamento, são apresentadas na Figura 5. Observou-se que a atividade diminuiu linearmente com o decorrer do tempo de armazenamento, havendo perda de até 56,06% para a fitase de A. oryzae e de até 47,50% para a fitase de A. niger. Desde o início do período de armazenamento, a atividade determinada no núcleo foi menor do que a esperada (40.000FTU kg-1), provavelmente, devido à interferência de minerais e/ou vitaminas presentes no núcleo. O núcleo reduziu a atividade inicial em 16,66% e 17,10% para as fitases de A. oryzae e A. niger, respectivamente. Como o núcleo contém vários componentes, não é 32 atividade (FTU kg-¹) 40.000 35.000 30.000 y = -84,112x + 32206 25.000 R = 0,9819 2 20.000 15.000 10.000 y = -98,923x + 33139 5.000 R = 0,9858 2 0 0 30 60 90 120 tempo de armazenamento (dias) A. oryzae Regressão A. oryzae 150 180 A. niger Regressão A. niger FIGURA 5 Atividade das fitases de A. oryzae e A. niger, incorporadas ao núcleo, em função do tempo de armazenamento. possível indicar o(s) responsável(eis) pela diminuição da atividade e a possibilidade de que pode ter ocorrido um somatório de efeitos inibitórios acarretados por vários componentes do núcleo não pode ser descartada. Além disso, é difícil determinar se a inibição foi resultado da ligação do composto à fitase ou à formação (durante o ensaio enzimático) de complexo ácido fítico−composto indisponível para a catálise enzimática e, portanto, estudos posteriores são necessários para entender tais questões. Todavia, segundo Wyss et al. (1999), é provável que os efeitos inibitórios de minerais catiônicos ocorram, de um modo geral, devido à complexação desses com o substrato ácido fítico. De acordo com Cheryan (1980), a ordem correspondente à diminuição da estabilidade do complexo formado (ácido fítico-mineral) de alguns minerais é a seguinte: Zn2+, Cu2+, Ni2+, Co2+, Mn2+, Ca2+, Fe2+. Dentre esses sete cátions, apenas o Cu2+ não está presente no núcleo, portanto os demais podem ter 33 complexado com o ácido fítico durante o ensaio para determinação da atividade. Entretanto, é importante ressaltar que a inibição observada nesta pesquisa pode ter ocorrido devido ao fato dos componentes estarem presentes, de um modo geral, em altas concentrações e não se pode afirmar que as fitases avaliadas não dependem de cofator, pois não apresentaram nenhuma atividade catalítica quando colocadas na presença de tampão citrato 0,1mol L-1, como será discutido posteriormente na segunda etapa desta pesquisa. Pizzolante et al. (2002a) incorporaram, de forma independente, a fitase de A. niger em suplemento mineral e vitamínico, e determinaram a atividade enzimática a cada 14 dias, durante 112 dias de armazenamento em TA. Concluíram que as perdas de atividade foram de até 43,11 e 37,49% para a fitase armazenada no suplemento mineral e vitamínico, respectivamente. Entretanto, a média geral da atividade enzimática (durante 112 dias) determinada no suplemento mineral (3.954FTU g-1) foi semelhante à observada no suplemento vitamínico (3.841FTU g-1). No presente trabalho, a fitase de A. niger incorporada ao núcleo teve redução na atividade de 29,25% durante 112 dias de armazenamento em TA. Essas diferenças nas taxas de redução da atividade podem ser devido à composição do núcleo usado neste trabalho ser diferente dos suplementos utilizados por Pizzolante et al. (2002a). Adotando a perda de atividade em 20% como aceitável e baseando-se na taxa de suplementação de 40.000FTU kg-1, as fitases de A. oryzae e A. niger podem ser armazenadas, em TA, nas formas incorporadas ao núcleo por aproximadamente até 12 e 2 dias, respectivamente. No geral, a fitase de A. niger foi a enzima que teve menor perda de atividade, durante 180 dias de armazenamento, em ambas as formas avaliadas. Para as duas fitases em questão, o armazenamento em TA na forma original é o mais indicado porque acarreta menor perda de atividade enzimática já que, se as fitases são armazenadas no núcleo, há redução na atividade provocada pelo 34 tempo de armazenamento e também há perda de atividade inicial acarretada pela composição do núcleo. 4.2 Segunda etapa: pH e temperatura 4.2.1 pH Não foi detectada atividade enzimática em nenhum pH do tampão citrato 0,1mol L-1, para as três enzimas avaliadas. Provavelmente, o tampão citrato teve ação quelante sobre algum cofator. Estudos posteriores são necessários para confirmar se essas fitases exigem algum cofator e, em caso positivo, determinar qual molécula desempenha essa função. É o que demonstra o estudo realizado com a fitase de Bacillus subtilis VTT E-68013 (Kerovuo et al., 2000a), dependente de cálcio. A enzima foi completamente inativada quando colocada na presença de EDTA, entretanto, a atividade foi parcialmente restabelecida quando a enzima foi incubada com cálcio. A análise de variância da atividade das três fitases, em função do pH, foi significativa a 1% de probabilidade (Tabela 3A, Anexos). Assim, como já esperado, alterações no pH acarretaram variações na atividade enzimática. A fitase de A. oryzae teve atividade nos tampões acetato (pH 3,0; 4,0 e 5,0) e maleato (pH 6,0), enquanto que a de A. niger foi ativa nos tampões glicina (pH 3,0), acetato (pH 3,0; 4,0 e 5,0) e maleato (pH = 6,0). Já a enzima de S. cerevisae apresentou atividade enzimática nos tampões glicina (pH 2,0 e 3,0) e acetato (pH 3,0; 4,0 e 5,0). Nos casos em que foi determinada atividade enzimática em dois diferentes tampões, para um mesmo valor de pH, adotou-se a média entre os dados dos dois tampões (Figura 6). A fitase de A. oryzae teve maior atividade no pH 4,0, enquanto que as de A. niger e S. cerevisae apresentaram pH ótimo entre 4,5 e 5,0. Esses resultados estão coerentes com pesquisas nas quais há relatos de que a maioria das fitases 35 8500 y = -670,25x3 + 6791,4x2 - 20421x + 22883 atividade (FTU g-¹) 7500 R2 = 0,9887 6500 y = -501,23x3 + 4994,6x2 - 13296x + 10733 R2 = 0,9684 5500 4500 3500 2500 1500 y = 250,33x3 - 3981,7x2 + 19750x - 28982 36 R2 = 0,9855 500 -500 0 1 2 3 4 5 6 7 8 pH A. oryzae Regressão A. oryzae A. niger Regressão A. niger S. cerevisae Regressão S. cerevisae FIGURA 6 Atividade das fitases de A. oryzae, A. niger e S. cerevisae, em função do pH. conhecidas tem pH ótimo entre 4,0 e 6,0 (Lei & Porres, 2003; Vats & Banerjee, 2004). O pH ótimo determinado neste trabalho para a fitase de A. oryzae (pH 4,0) foi inferior ao valor de 5,5 descrito na literatura (Shimizu, 1993; Dvrøáková, 1998). Essa diferença provavelmente é devida a modificações genéticas (recombinação genética, mutação direcionada, entre outros) que a fitase de A. oryzae tenha sofrido recentemente, seja no microrganismo produtor em questão ou no microrganismo doador do gene alterando, consequentemente, o perfil de pH. Alguns trabalhos sobre as propriedades catalíticas da fitase de A. niger relatam dois valores de pH nos quais a enzima apresenta alta atividade: 2,5 e entre 5,0 − 5,5 sendo o segundo valor de pH o de maior atividade. Ou seja, no gráfico que representa o perfil da influência do pH, a atividade diminui após o pH 2,5 e aumenta após pH 4,0 atingindo atividade máxima entre 5,0 − 5,5. Após esse valor, a atividade reduz com o aumento do pH até perder atividade totalmente quando o pH é próximo a 7,5 (Wyss et al., 1999; Tomschy et al., 2000). Esse comportamento pode ser considerado particular, pois a maioria das enzimas apresenta perfil de pH relativamente simétrico com apenas um pH ótimo. A explicação para o relatado provavelmente está no fato de que na época dessas pesquisas, o ensaio enzimático foi feito não com apenas uma única fitase, mas sim com duas fitases distintas. Essa hipótese é sustentada pelo fato de que o microrganismo A. niger pode sintetizar duas fitases diferentes, sendo uma conhecida como phy A (pH ótimo próximo a 5,0) e a outra nomeada como phy B (pH ótimo de 2,5). Segundo Mullaney & Ullah (2003) a fitase de A. niger amplamente comercializada trata-se da fitase phy A e a fitase phy B não é comercializada. Sendo assim, o pH ótimo observado neste trabalho para a fitase de A. niger (próximo a 5,0) está de acordo com o valor de pH ótimo descrito por diversos pesquisadores (Maenz, 2001; Mullaney & Ullah, 2003). 37 O pH ótimo determinado nesta pesquisa para a fitase de S. cerevisae (próximo a 4,5) é semelhante ao pH ótimo determinado em fitase de Citrobacter braakii (pH 4,0) (Kim et al., 2003) e de E. coli (entre 4,0 e 4,5) (Wyss et al., 1999; Igbasan et al., 2000). É provável que o papo e o proventrículo sejam os principais locais de atividade da fitase (Liebert et al., 1993). O pH no papo dos frangos de corte está entre 4,0 e 5,0; enquanto que no proventrículo está em torno de 2,5 e 3,5. Além disso, em pH baixo, há a protonação dos grupos fosfato do ácido fítico facilitando a hidrólise enzimática (Maenz, 2001). As três fitases deste trabalho apresentaram pH ótimo menor que 5,0; portanto, abaixo do pH efetivo em formar complexos ácido fítico-mineral resistentes à hidrólise. Tendo em vista que os principais locais de ação da fitase são no papo e proventrículo, quanto maior a atividade enzimática em valores de pH menores que 5,0 maior será a probabilidade de a fitase exercer, in vivo, significativa ação catalítica nesses segmentos do trato gastrointestinal. Assim, a fitase de S. cerevisae foi a que apresentou maior atividade residual em baixos pH, ou seja, considerando a maior atividade determinada como 100%, a fitase de S. cerevisae apresentou 92,47; 69,79 e 53,39% da atividade máxima nos pH 4,0; 3,0 e 2,0 respectivamente, ressaltando-se que foi a única das três enzimas que apresentou atividade no pH 2,0. A fitase de A. oryzae teve 55,39 e 47,69% da atividade máxima nos pH 5,0 e 3,0; enquanto que a de A. niger atuou com 68,35 e 39,18% da atividade máxima nos pH 4,0 e 3,0. 4.2.2 Temperatura Variações na temperatura acarretaram alterações na atividade das três fitases (P<0,01) (Tabela 4A, Anexos). A fitase de A. oryzae apresentou atividade crescente até 40°C e a 50°C estava inativa (Figura 7A). Já a de A. niger teve atividade crescente até aproximadamente 45°C, estando inativa a 60°C. A fitase 38 de S. cerevisae foi a enzima mais termoresistente, pois estava ativa a 60°C, atividade (FTU g-¹) sendo sua temperatura ótima de ação observada entre 50 e 60°C (Figura 7B). 3 2 1600 y = -0,297x + 26,188x - 695,11x + 6408,5 1400 R = 0,9998 2 1200 1000 800 600 400 200 0 0 10 20 30 40 50 60 temperatura (°C) 16000 3 14000 atividade (FTU g-¹) 2 y = -0,5537x + 60,587x - 1789,9x + 18309 3 2 R = 0,9938 2 y = -1,2996x + 130,6x - 3785,2x + 37720 12000 2 R = 0,9959 10000 8000 6000 4000 2000 0 0 10 20 30 40 50 60 70 80 temperatura (°C) A. niger S. cerevisae Regressão A. niger Regressão S. cerevisae FIGURA 7 Atividade enzimática em função da temperatura. A) A. oryzae e B) A. niger e S. cerevisae. 39 Ullah et al. (2000) realizaram a caracterização bioquímica da fitase produzida por Pichia pastoris (geneticamente modificado pelo gene que codifica fitase de A. fumigatus) e usaram a fitase de A. niger como referência. Segundo os referidos pesquisadores, ambas fitases não são cataliticamente eficientes em temperaturas acima de 60°C. Investigando a influência da temperatura sobre a atividade de fitases sintetizadas por fungos do gênero Aspergillus, Wyss et al. (1998) relataram que as fitases de A. fumigatus e A. niger T213 apresentaram temperatura ótima de 50 e 55°C, respectivamente. Além disso, observaram que a partir de 65°C as duas fitases perderam totalmente a atividade catalítica. A fitase isolada de C. braakii exibiu temperatura ótima à 50°C (Kim et al., 2003), enquanto que a temperatura ótima da fitase de E. coli está entre 55 e 60°C (Greiner et al., 1993; Wyss et al., 1999; Igbasan et al., 2000). Portanto, o valor de temperatura ótima determinado para essas fitases é próximo ao exibido pela fitase de S. cerevisae neste trabalho (entre 50 e 60°C). Outro parâmetro que pode ser observado é a variação de temperatura na qual a fitase tem atividade catalítica. A fitase de S. cerevisae foi a enzima que apresentou a maior amplitude de ação catalítica em função da temperatura, estando ativa de 20°C até temperaturas que variam entre 60 e 70°C. Já a fitase de A. oryzae mostrou-se a enzima com menor amplitude de variação térmica; enquanto que a fitase de A. niger teve tolerância térmica intermediária entre as outras duas fitases avaliadas. Segundo Vats & Banerjee (2004), as fitases geralmente apresentam alta atividade em temperaturas de 50 a 70°C, embora a temperatura ótima da maioria dessas enzimas esteja entre 45−60°C. Essa temperatura ótima relativamente alta faz com que a atividade das fitases não seja máxima no trato gastrointestinal das aves e suínos (37−40°C). Normalmente, as fitases apresentam baixa atividade em temperatura ambiente porque adotam uma conformação tridimensional rígida 40 e, portanto, pouco flexível (Lei & Porres, 2003). A fitase de A. oryzae foi a que mostrou maior atividade residual a 37°C, ou seja, considerando a maior atividade determinada como 100%, apresentou 98,21% da atividade máxima em temperatura de 37°C. As fitases de A. niger e S. cerevisae apresentaram, respectivamente, 79,44 e 58,98% da atividade máxima a 37°C. 4.3 Terceira etapa: processamento térmico das rações e armazenamento Devido à falta de repetibilidade observada na primeira etapa desta pesquisa para a fitase de S. cerevisae, esta etapa foi realizada com as enzimas de A. oryzae e A. niger. Experimento 1: Fitases incorporadas as rações de frango e submetidas à processamento térmico. Não houve diferença significativa tanto para as fontes de variação tipo de ração e tratamentos, quanto para a interação entre as mesmas (P<0,05) (Tabela 5A, Anexos). Portanto, os dois tipos de rações testados e os diferentes tratamentos aplicados às rações, de forma independente para cada enzima, não influenciaram a atividade das fitases de A. oryzae e A. niger (Tabela 4). Comparando a composição das duas rações para frangos de corte (Tabela 3, subitem 3.5.1), as rações para fase final têm menor percentual de Ca, P e aminoácidos/proteínas; e maior conteúdo energético (carboidrato/lipídeo). Portanto, essa variabilidade na composição não acarretou alteração na atividade das fitases. É importante ressaltar que diferenças no percentual de fitato entre os dois tipos de rações não interferem nos resultados, pois a determinação da atividade foi feita com fitato de sódio em concentração alta o suficiente para que não faltasse substrato durante todo o tempo de incubação com a fitase. Os diferentes tempos de exposição ao calor avaliados neste experimento não acarretaram redução na atividade das fitases incorporadas às rações. Já Pizzolante et al. (2002b) avaliaram o efeito da peletização em ração para frangos 41 TABELA 4 Atividade das fitases de A. oryzae e A. niger, em FTU kg-1 MS*, incorporadas a dois tipos de rações e submetidas a quatro tratamentos. A. oryzae A. niger Controle Ração fase inicial 3.412 Ração fase final 3.446 Ração fase inicial 2.905 Ração fase final 3.016 4 minutos 3.390 3.344 2.929 3.075 8 minutos 3.499 3.294 2.961 3.131 12 minutos 3.206 3.248 3.208 3.330 Tratamentos Médias 3.355 3.069 *MS = matéria seca. de corte, suplementada com a fitase de A. niger e concluíram que a atividade reduziu em até 56,44%. Entretanto, os detalhes do processo de peletização (temperatura, tempo) não foram citados. Embora pouco pertinente, há a hipótese de que os diferentes tempos de exposição ao calor tenham acarretado desnaturação térmica branda das fitases permitindo que retornassem à sua conformação tridimensional original quando submetidas às condições do ensaio de determinação da atividade. Isso foi reportado por Wyss et al. (1998) os quais suplementaram ração comercial para frangos de cortes com fitases de A. fumigatus e de A. niger T213 e, em seguida, peletizaram as rações a 75 e 80°C. Consideraram a atividade determinada a 37°C, antes da peletização, como 100%. Observaram que a recuperação da atividade enzimática foi mais elevada para a fitase de A. fumigatus (70% na ração peletizada a 75°C e 50% na peletizada a 80°C) do que para a fitase de A. niger T213 (60% na ração peletizada a 75°C e 30 % na peletizada a 80°C). Concluíram que a maior recuperação de atividade determinada na fitase de A. fumigatus pode ser explicada pela capacidade que a enzima apresenta de retornar 42 à sua conformação tridimensional ativa após a desnaturação térmica. Além disso, tem-se que antes da exposição ao calor seco as rações foram umidificadas em 8% (p/p) na tentativa de simular o processo de peletização no qual há exposição da ração ao calor úmido. Assim, esperava-se que a umidade determinada nas rações processadas termicamente fosse resultado da umidade determinada no controle (sem adição de água) + 8 gramas. Entretanto, isso não foi observado conforme apresentado na Tabela 5. TABELA 5 Umidade*, em g 100g-1, das rações de fase inicial e final suplementadas com as fitases de A. oryzae e A. niger. Tratamentos A. oryzae A niger Controle 11,24 ± 0,79 11,92 ± 0,62 4 minutos 11,76 ± 1,16 12,40 ± 0,76 8 minutos 7,74 ± 0,29 11,63 ± 0,54 12 minutos 7,62 ± 0,34 9,50 ± 0,27 *Média de seis repetições (três referentes às rações de fase inicial e três referentes às de fase final) ± desvio padrão. Portanto, durante o processamento térmico a água adicionada e parte da água presente naturalmente nas rações foram evaporadas. Assim, as rações não foram submetidas ao calor úmido durante o tempo integral de exposição indicando que, provavelmente, as fitases avaliadas não são lábeis ao calor seco. Experimento 2: Fitases incorporadas à ração de fase inicial submetida a processamento térmico e armazenada Como o tipo de ração não influenciou a atividade das fitases de A. oryzae e A. niger, o experimento 2 foi realizado apenas com rações para frangos de corte na fase inicial. A temperatura e a umidade relativa mínima e máxima do local de 43 armazenamento foram, respectivamente, 21 ± 1°C e 27 ± 2°C; 52 ± 10% e 78 ± 6%. Não houve diferença significativa tanto para as fontes de variação tratamentos e tempo de armazenamento, quanto para a interação entre as mesmas (P<0,05) (Tabela 6A, Anexos). A atividade média determinada nas rações de fase inicial suplementadas com as fitases de A. oryzae e A. niger consta nas Tabelas 6 e 7, respectivamente. TABELA 6 Atividade da fitase de A. oryzae, em FTU kg-1 MS*, incorporada à ração para frangos de corte na fase inicial, submetida a quatro tratamentos e armazenada durante período máximo de 60 dias. Tempo de armazenamento (dias) Tratamentos 0 15 30 45 60 Médias Controle 3.412 3.080 3.007 3.046 2.995 3.108 4 minutos 3.390 2.985 3.111 3.063 3.002 3.110 8 minutos 3.499 3.260 3.097 2.997 3.216 3.214 12 minutos 3.206 3.085 3.111 3.250 3.045 3.139 Médias 3.377 3.103 3.082 3.089 3.065 *MS = matéria seca. Cada valor representa a média de três repetições. Conforme observado no experimento 1, os diferentes tempos de exposição ao calor também não acarretaram perda de atividade no experimento 2. Observou-se também que o armazenamento das fitases incorporadas à ração de frango de corte na fase inicial não acarretou redução da atividade enzimática. Verifica-se que as rações suplementadas e submetidas a três tempos de exposição, deste trabalho, mostraram comportamento semelhante as rações suplementadas e não peletizadas avaliadas por Pizzolante et al. (2002b), indicando que o processamento térmico avaliado não simulou o processo de 44 TABELA 7 Atividade da fitase de A. niger, em FTU kg-1 MS, incorporada à ração para frangos de corte na fase inicial, submetida a quatro tratamentos e armazenada durante período máximo de 60 dias. Tempo de armazenamento (dias) Tratamentos 0 15 30 45 60 Médias Controle 2.905 3.137 3.078 2.915 3.006 3.008 4 minutos 2.929 2.817 2.956 2.902 3.045 2.930 8 minutos 2.961 2.924 3.035 2.913 3.063 2.979 12 minutos 3.208 2.989 3.084 2.900 2.900 3.016 Médias 3.001 2.967 3.038 2.908 3.004 *MS = matéria seca. Cada valor representa a média de três repetições. peletização. Esses autores avaliaram, a cada 7 dias, o efeito do armazenamento (56 dias em TA) sobre a atividade de fitases incorporadas a rações peletizadas e não peletizadas. Concluíram que as perdas máximas de atividade foram de 7,38% para a ração suplementada com fitase e 18,54% para a ração suplementada com fitase e posteriormente peletizada, portanto, a redução de atividade nas rações não suplementadas foi baixa. De acordo com os resultados deste experimento, as fitases de A. oryzae e A. niger foram resistentes ao processamento térmico avaliado e o armazenamento da ração de fase inicial suplementada com as fitases, durante 60 dias em TA, não reduziu a atividade dessas enzimas. 45 5 CONCLUSÕES O armazenamento das fitases na forma incorporada ao núcleo não é recomendado. A fitase de Aspergillus niger pode ser armazenada na forma original, em temperatura ambiente (TA), por 135 dias mantendo 80% da atividade. A fitase de A. oryzae apresenta atividade ótima em pH 4,0 e a 40°C; e maior atividade residual a 37°C. A fitase de A. niger tem pH e temperatura ótima em pH próximo a 5,0 e 45oC, respectivamente. A fitase de Saccharomyces cerevisae apresenta maior atividade em pH próximo a 4,5 e em temperaturas entre 50 e 60°C; tem maior atividade residual em baixos pH e maior amplitude de ação catalítica em função da temperatura. As fitases de A. oryzae e A. niger podem ser incorporadas às rações (fase inicial e final) e ser submetidas a temperaturas de 80 a 85°C, em estufa ventilada, por até 12 minutos sem perda da atividade enzimática. A ração para frangos de corte de fase inicial suplementada com as fitases e submetida ao processamento térmico avaliado pode ser armazenada, em TA, durante 60 dias sem comprometer a atividade dessas fitases. 46 REFERÊNCIAS BIBLIOGRÁFICAS ASSOCIATION OF OFFICIAL ANALYTICAL CHEMISTRY. Official methods of analysis of the Association of the Analytical Chemistry. 17. ed. Maryland, 2000. BAKER, D. H. Bioavailability of minerals and vitamins. In: MILLER, E. R.; ULLREY, D. E.; LEWIS, A. J. Swine nutrition. Butterworth-Heinemann: Stoneham, 1991. p. 341-359. BERTECHINI, A. G. Nutrição de monogástricos. Lavras: UFLA, 2006. 301 p. CAMDEN, B. J.; MOREL, P. C. H.; THOMAS, D. V.; RAVINDRAN, V.; BEDFORD, M. R. Effectiveness of exogenous microbial phytase in improving the bioavailabilities of phosphorus and other nutrients in maize–soybean meal diets for broilers. Animal Science, Edinburgh, v. 73, p. 289-297, 2001. CHERYAN, M. Phytic acid interactions in food systems. CRC Critical Reviews in Food Science and Nutrition, Cleveland, v. 13, n. 4, p. 297-335, 1980. CHOI, Y. M.; SUH, H. J.; KIM, J. M. Purification and properties of extracellular phytase from Bacillus sp. KHU-10. Journal of Protein Chemistry, New York, v. 20, n. 4, p. 287-292, 2001. CIOFALO, V.; BARTON, N.; KRETZ, K.; BAIRD, J.; COOK, M.; SHANAHAN, D. Safety evaluation of a phytase, expressed in Schizosaccharomyces pombe, intended for use in animal feed. Regulatory Toxicology and Pharmacology, Duluth, v. 37, n. 2, p. 286-292, 2003. CROMWELL, G. I.; COFFEY, R. D.; PARKER, G. R.; MONEGUE, H. J.; RANDOLPH, J. H. Efficacy of a recombinant derived phytase in improving the bioavailability of phosphorus in corn-soybean meal diets for pigs. Journal of Animal Sciences, Champaign, v. 73, n. 7, p. 2000-2008, 1995. DVRØÁKOVÁ, J. Phytase: sources, preparation and exploitation. Folia Microbiologica, Praha, v. 43, n. 4, p. 323-338, 1998. EECKHOUT, W.; PAEPE, M. de. The quantitative effects of an industrial microbial phytase and wheat phytase on the apparent phosphorus absorbability of a mixed feed by piglets. Medical Faculty Landbouw Rijkuniversity, v. 56, p. 1643-1647, 1991. 47 EECKHOUT, W.; PAEPE, M. de. Total phosphorus, phytate-phosphorus and phytase activity in plant feedstuffs. Animal Feed Science Technology, Amsterdam, v. 47, n. 1/2, p. 19-29, 1994. ENGELEN, A. J.; HEEFT, F. C. van der; RANDSDORP, P. H. G.; SMIT, E. L. C. Simple and rapid determination of phytase activity. Journal of AOAC International, Washington, v. 77, n. 3, p. 760-764, 1994. FROLICH, W.; DRAKENBERG, T.; ASP, N. G. Enzymic degradation of phytate (myo-inositol hexaphosphate) in whole grain flour suspension and dough: a comparison between 31P NMR spectroscopy and a ferric ion method. Journal of Cereal Science, London, v. 4, p. 325-334, 1986. GARRETT, J. B.; KRETZ, K. A.; DONOGHUE, E. o’; KEROVUO, J.; KIM, W.; BARTON, N. R.; HAZLEWOOD, G. P.; SHORT, J. M.; ROBERTSON, D. E.; GRAY, K. A. Enhancing the thermal tolerance and gastric performance of a microbial phytase for use as a phosphate-mobilizing monogastric-feed supplement. Applied and Environmental Microbiology, Washington, v. 70, n. 5, p. 3041-3046, 2004. GREINER, R. Purification and characterization of three phytases from germinated lupine seeds (Lupinus albus var. Amiga). Journal of Agricultural and Food Chemistry, Easton, v. 50, n. 23, p. 6858-6864, 2002. GREINER, R.; KONIETZNY, U.; JANY, K. L. D. Purification and characterization of two phytases from Escherichia coli. Archives of Biochemistry and Biophysics, New York, v. 303, n. 1, p. 107-113, 1993. HAN, Y. M.; LEI, X. G. Role of glycosylation in the functional expression of an Aspergillus niger phytase (phyA) in Pichia pastoris. Archives of Biochemistry and Biophysics, New York, v. 364, n. 1, p. 83-90, 1999. HARTIG, T. Uber das Klebermehl. Botanische Zeitung, Zeitung, v. 13, p. 881885, 1855. HEGEMAN, C. E.; GRABAU, E. A. A novel phytase with sequence similarity to purple acid phosphatases is expressed in cotyledons of germinating soybean seedlings. Plant Physiology, Washington, v. 126, n. 4, p. 1598-1608, 2001. 48 IGBASAN, F. A.; MÄNNER, K.; MIKSCH, G.; BORRISS, R.; FAROUK, A.; SIMON, O. Comparative studies on the in vitro properties of phytases from various microbial origins. Archives of Animal Nutrition, Montreux, v. 53, n. 4, p. 353-373, 2000. JOHNSON, L. F.; TATE, M. E. Structure of ‘phytic acids’. Canadian Journal of Chemistry, Ottawa, v. 47, n. 63, p. 63-73, 1969. JONGBLOED, A. W.; KEMME, P. A. Effect of pelleting mixed feeds on phytase activity and the apparent absorbability of phosphorus and calcium in pigs. Animal Feed Science Technology, Amsterdam, v. 28, n. 3, p. 233-242, 1990. KEROVUO, J.; LAPPALAINEN, I.; REINIKAINEN, T. The metal dependence of Bacillus subtilis phytase. Biochemical and Biophysical Research Communication, Orlando, v. 268, n. 2, p. 365-369, 2000a. KEROVUO, J.; ROUVINEM, J.; HATZACK, F. Analysis of myo-inositol hexakisphosphate hydrolysis by Bacillus phytase: indication of a novel reaction mechanism. Biochemical Journal, London, v. 352, p. 623-628, 2000b. KERR, M. J.; CLASSEN, H. L.; NEWKIRK, R. W. The effects of gastrointestinal tract micro-flora and dietary phytase on inositol hexaphosphate hydrolysis in the chicken. Poultry Science, Champaign, v. 79, n. 1, 2000. Supplement. KIM, H. W.; KIM, Y. O.; LEE, J. H.; KIM, K. K.; KIM, Y. J. Isolation and characterization of a phytase with improved properties from Citrobacter braakii. Biotechnology Letters, Amsterdam, v. 25, n. 15, p. 1231-1234, 2003. KIM, Y. O.; KIM, H. K.; BAE, K. S.; YU, J. H.; OH, T. K. Purification and properties of a thermostable phytase from Bacillus sp. DS11. Enzyme and Microbial Technology, New York, v. 22, n. 1, p. 2-7, 1998. KNUCKLES, B. E.; KUZMICKY, D. D.; GUMBMANN, M. R.; BETSCHART, A. A. Effect of myo-inositol phosphate esters on in vitro and in vivo digestion of protein. Journal of Food Science, Chicago, v. 54, n. 5, p. 1348-1350, 1989. KONIETZNY, U.; GREINER, R. Molecular and catalytic properties of phytatedegrading enzymes (phytases). International Journal of Food Science and Technology, Trivandrum, v. 37, n. 7, p. 791-812, 2002. 49 KONIETZNY, U.; GREINER, R.; JANY, K. D. Purification and characterization of a phytase from spelt. Journal of Food Biochemistry, Westport, v. 18, n. 3, p. 165-183, 1995. KORNEGAY, E. T. Digestion of phosphorus and other nutrients: the role of phytases and factors influencing their activity. In: BEDFORD, M. R.; PARTRIDGE, G. G. Enzymes in farm animal nutrition. Wallingford: CABI, 2001. p. 237-271. KOSTREWA, D.; WYSS, M.; D’ARCY, A.; LOON, A. P. G. M. van. Crystal structure of Aspergillus niger pH 2,5 acid phosphatase at 2,4Ǻ resolution. Journal of Molecular Biology, London, v. 288, n. 5, p. 965-974, 1999. LASSEN, S. F.; BREINHOLT, J.; ØSTERGAARD, P. R.; BRUGGER, R.; BISCHOFF, A.; WYSS, M.; FUGLSANG, C. C. Expression, gene cloning, and characterization of five novel phytases from four basidiomycete fungi: Peniophora lycii, Agrocybe pediades, a Ceriporia sp., and Trametes pubescens. Applied and Environmental Microbiology, Washington, v. 67, n. 10, p. 47014707, 2001. LEI, X. G.; PORRES, J. M. Phytase enzymology, applications, and biotechnology. Biotechnology Letters, Amsterdam, v. 25, n. 21, p. 1787-1794, 2003. LESKE, K. L.; COON, C. N. A bioassay to determine the effect of phytase on phytate phosphorus hydrolysis and total phosphorus retention of feed ingredients as determined with broilers and laying hens. Poultry Science, Champaign, v. 78, n. 8, p. 1151-1157, 1999. LIEBERT, F.; WECKE, C.; SCHONER, F. J. Phytase activities in different gut contents of chickens as dependent on level of phosphorus and phytase supplementations. In: SYMPOSIUM KARTAUSE ITTINGEN: ENZYMES IN ANIMAL NUTRITION, 1993, Switzerland. Proceedings… Switzerland, 1993. p. 202-205. MAENZ, D. D. Enzymatic characteristics of phytases as they relate to their use in animal feeds. In: BEDFORD, M. R.; PARTRIDGE, G. G. Enzymes in farm animal nutrition. Wallingford: CABI, 2001. p. 61-84. 50 MAENZ, D. D.; ENGELE-SCHAAN, C. M.; NEWKIRK, R. W.; CLASSEN, H. L. The effect of minerals and mineral chelators on the formation of phytaseresistant and phytase susceptible forms of phytic acid in solution and in a slurry of canola meal. Animal Feed Science and Technology, Amsterdam, v. 81, n. 3/4, p. 177-192, 1999. MULLANEY, E. J.; ULLAH, A. H. J. The term phytase comprises several different classes of enzymes. Biochemical and Biophysical Research Communications, Orlando, v. 312, n. 1, p. 179-184, 2003. OBERLEAS, D.; HARLAND, B. F. Impact of phytic acid on nutrient availability. In: COELHO, M. B.; KORNEGAY, E. T. Phytase in animal nutrition and waste management. New Jersey: BASF, 1996. p. 77-84. OH, B. C.; CHANG, B. S.; PARK, K. H.; HA, N. C.; KIM, H. K.; OH, B. H.; OH, T. K. Calcium-dependent catalytic activity of a novel phytase from Bacillus amyloliquefaciens DS11. Biochemistry, New York, v. 40, p. 9669-9676, 2001. OHKAWA, T.; EBISUNO, S.; KITAGAWA, M.; MORIMOTO, S.; MIYAZAKI, Y.; YASUKAWA, S. Rice bran treatment for patients with hypercalciuric stones: experimental and clinical studies. Journal of Urology, London, v. 132, n. 6, p. 1140-1145, 1984. ONYANGO, E. M.; BEDFORD, M. R.; ADEOLA, O. Phtase activity along the digestive tract of the broiler chick: a comparative study of an Escherichia coliderived and Peniophora lycii phytase. Canadian Journal of Animal Science, Ottawa, v. 85, p. 61-68, 2005. OSTANIN, K.; ETTEN, R. L. van. Asp304 of Escherichia coli acid phosphatase is involved in leaving group protonation. Journal of Biological Chemistry, Baltimore, v. 268, n. 28, p. 20778-20784, 1993. PAIK, I. Application of phytase, microbial or plant origin, to reduce phosphorus excretion in poultry production. Journal of Animal Sciences, Champaign, v. 16, n. 1, p. 124-135, 2003. PALLAUF, J.; RIMBACH, G. Recent results on phytic acid and phytase. In: FORUM ANIMAL NUTRITION, 5., 1995, Ludwigshafen. Proceedings… Ludwigshafen: BASF, 1995. p. 43. 51 PASAMONTES, L.; HAIKER, M.; WYSS, M.; TESSIER, M.; LOON, A. P. G. M. van. Gene cloning, purification and characterization of a heat-stable phytase from fungus Aspergillus fumigatus. Applied and Environmental Microbiology, Washington, v. 63, n. 5, p. 1696-1700, 1997. PERSSON, H.; TURK, M.; NYMAN, M.; SANDBERG, A. S. Binding of Cu2+, Zn2+, and Cd2+ to inositol tri-, tetra-, penta-, and hexaphosphates. Journal of Agricultural and Food Chemistry, Easton, v. 46, n. 8, p. 3194-3200, 1998. PHILLIPPY, B. Q. Susceptibility of wheat and Aspergillus niger phytases to inactivation by gastrointestinal enzymes. Journal of Agricultural and Food Chemistry, Easton, v. 47, n. 4, p. 1385-1388, 1999. PIMENTEL GOMES, F. Curso de estatística experimental. 13. ed. São Paulo: Nobel, 1990. 467 p. PIZZOLANTE, C. C.; SANTOS, C. D. dos; TEIXEIRA, A. S.; GARCIA, E. A.; BERTECHINI, A. G.; FREITAS, R. T. F. Efeito de formas e condições de armazenamento da fitase pura, sobre a atividade da enzima. Revista de Veterinária e Zootecnia, Rio de Janeiro, v. 11, p. 69-79, 2002a. PIZZOLANTE, C. C.; SANTOS, C. D. dos; TEIXEIRA, A. S.; GARCIA, E. A.; BERTECHINI, A. G.; FREITAS, R. T. F. Estabilidade da fitase em diferentes formas de armazenamento. Revista de Veterinária e Zootecnia, Rio de Janeiro, v. 11, p. 59-68, 2002b. POINTILLART, A. Importance of phytates and cereal phytases in the feeding of pigs. In: SYMPOSIUM KARTAUSE ITTINGEN, 1., 1993, Switzerland. Proceedings… Switzerland, 1993. p. 192-199. POTTER, S. M. Overview of proposed mechanisms for the hypocholesterolemic effect of soy. Journal of Nutrition, Philadelphia, v. 125, p. 606S-611S, 1995. RAPP, C.; LANTZSCH, H. J.; DROCHNER, W. Hydrolysis of phytic acid by intrinsic plant or supplemented microbial phytase (Aspergillus niger) in the stomach and small intestine of minipigs fitted with re-entrant cannulas: 3., hydrolysis of phytic acid (IP6) and occurrence of hydrolysis products (IP5, IP4, IP3 and IP2). Journal of Animal Physiology and Animal Nutrition, Berlin, v. 85, n. 11/12, p. 420-430, 2001. 52 RAVINDRAN, V.; BRYDEN, W. L.; KORNEGAY, E. T. Phytases: occurrence, bioavailability and implications in poultry nutrition. Poultry & Avian Biology Research, v. 6, n. 2, p. 125-143, 1995. RAVINDRAN, V.; CABAHUG, S.; RAVINDRAN, G.; SELLE, P. H.; BRYDEN, W. L. Response of broiler chickens to microbial phytase supplementation as influenced by dietary phytic acid and non-phytate phosphorus levels: II., effects on apparent metabolisable energy, nutrient digestibility and nutrient retention. British Poultry Science, London, v. 41, n. 2, p. 193-200, 2000. SELLE, P. H.; CADOGAN, D. J.; BRYDEN, W. L. Effects of phytase supplementation of phosphorus-adequate, lysine-deficient, wheat-based diets on growth performance of weaner pigs. Australian Journal of Agricultural Research, Sydney, v. 54, n. 3, p. 323-330, 2003. SELLE, P. H.; RAVINDRAN, V. Microbial phytase in poultry nutrition. Animal Feed Science and Technology, Amsterdam, v. 135, n. 1/2, p. 1-41, 2007. SHAMSUDDIN, A. M.; VUCENIK, I.; COLE, K. E. IP−6: a novel anti-cancer agent. Life Sciences, Elmsford, v. 61, n. 4, p. 343-354, 1997. SHIMIZU, M. Purification and characterization of phytase and acid phosphatase produced by Aspergillus oryzae K1. Bioscience, Biotechnology, and Biochemistry, Tokyo, v. 57, n. 8, p. 1364-1365, 1993. SUZUKI, U.; YOSHIMURA, K.; TAKAISHI, M. Uber ein enzym “Phytase” das Anhydro-oxy-methylendiphosphosaure spaltet. College Agriculture Bulletin, v. 7, p. 503-505, 1907. TAMIM, N. M.; ANGEL, R.; CHRISTMAN, M. Influence of dietary calcium and phytase on phytate phosphorus hydrolysis in broiler chickens. Poultry Science, Champaign, v. 83, n. 8, p. 1358-1367, 2004. TEJEDOR, A. A.; ALBINO, L. F. T.; ROSTAGNO, H. S.; VIEITES, F. M. Efeito da adição da enzima fitase sobre o desempenho e a digestibilidade ileal de nutrientes. Revista Brasileira de Zootecnia, Viçosa, v. 30, n. 3, p. 802-808, 2001. 53 THOMPSON, L. U.; BUTTON, C. L.; JENKINS, D. J. A. Phytic acid and calcium affect the in vitro rate of navy bean starch digestion and blood glucose response in humans. The American Journal of Clinical Nutrition, New York, v. 46, n. 3, p. 467-473, 1987. TOMSCHY, A.; WYSS, M.; KOSTREWA, D.; VOGEL, K.; TESSIER, M.; HÖFER, S.; BÜRGIN, H.; KRONENBERGER, A.; RÉMY, R.; LOON, A. P. M. G. van; PASAMONTES, L. Active site residue 297 of Aspergillus niger phytase critically affects the catalytic properties. FEBS Letters, Amsterdam, v. 472, n. 2/3, p. 169-172, 2000. ULLAH, A. H. J. Production, rapid purification and catalytic characterization of extracellular phytase from Aspergillus ficuum. Preparative Biochemistry, New York, v. 18, n. 4, p. 443-458, 1988. ULLAH, A. H. J.; CUMMINS, B. J. Purification, N-terminal amino acid sequence and characterization of the pH 2,5 optimum acid phosphatase (E. C. 3.1.3.2) from Aspergillus ficuum. Preparative Biochemistry, New York, v. 17, n. 4, p. 397-422, 1987. ULLAH, A. H. J.; MULLANEY, E. J. Disulfide bonds are necessary for structure an activity in Aspergillus ficuum phytase. Biochemical and Biophysical Research Communications, Orlando, v. 227, n. 2, p. 311-317, 1996. ULLAH, A. H. J.; SETHUMADHAVAN, K. Phy A gene product of Aspergillus ficuum and Peniophora lycii produces dissimilar phytases. Biochemical and Biophysical Research Communications, Orlando, v. 303, n. 2, p. 463-468, 1996. ULLAH, A. H. J.; SETHUMADHAVAN, K.; LEI, X. G.; MULLANEY, E. J. Biochemical characterization of cloned Aspergillus fumigatus phytase (phyA). Biochemical and Biophysical Research Communications, Orlando, v. 275, n. 2, p. 279-285, 2000. VATS, P.; BANERJEE, U. C. Production studies and catalytic properties of phytases (myo-inositolhexakisphosphate phosphohydrolases): an overview. Enzyme and Microbial Technology, New York, v. 35, n. 1, p. 3-14, 2004. WODZINSKI, R. J.; ULLAH, A. H. J. Phytase. Advances in Applied Microbiology, San Diego, v. 42, n. 1, p. 263-303, 1996. 54 WYSS, M.; BRUGGER, R.; KRONENBERGER, A.; RÉMY, R.; FIMBEL, R.; OESTERHELT, G.; LEHMANN, M.; LOON, A. P. G. M. van. Biochemical characterization of fungal phytases (myo-inositol hexakisphosphate phosphohydrolases): catalytic properties. Applied and Environmental Microbiology, Washington, v. 65, n. 2, p. 367-373, 1999. WYSS, M.; PASAMONTES, L.; RÉMY, R.; KOHLER, J.; KUSZNIR, E.; GADIENT, M.; MULLER, F.; LOON, A. P. G. M. van. Comparison of the thermostability properties of three acid phosphatases from molds: Aspergillus fumigatus phytase, A. niger phytase, and A. niger pH 2,5 acid phosphatase. Applied and Environmental Microbiology, Washington, v. 64, n. 11, p. 44464451, 1998. YI, Z.; KORNEGAY, E. T.; RAVINDRAN, V.; DENBOW, D. M. Improving phytate phosphorus availability in corn and soybean meal for broilers using microbial phytase and calculation of phosphorus equivalency values for phytase. Poultry Science, Champaign, v. 75, n. 2, p. 240-249, 1996. ZHANG, M.; ZHOU, M.; ETTEN, R. L. van; STAUFFACHER, C. V. Crystal structure of bovine low molecular weight phosphotyrosyl phosphatase complexed with the transition state analog vanadate. Biochemistry, New York, v. 36, n. 1, p. 15-23, 1997. ZYLA, K.; MIKA, M.; STODOLAK, B.; WIKIERA, A.; KORELESKI, J.; ŜWIATKIEWICZ, S. Towards complete dephosphorylation and total conversion of phytates in poultry feeds. Poultry Science, Champaign, v. 83, n. 7, p. 11751186, 2004. 55 ANEXOS Página TABELA 1A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger armazenadas nas formas originais............................................................................... 57 TABELA 2A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger armazenadas nas formas incorporadas ao núcleo.............................................................................. 57 TABELA 3A Resumo da análise de variância da atividade das fitases de A. oryzae, A. niger e S. cerevisae em função do pH........... 58 TABELA 4A Resumo da análise de variância da atividade das fitases de A. oryzae, A. niger e S. cerevisae em função da temperatura......................................................................... 58 TABELA 5A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger incorporadas a dois tipos de rações submetidas a quatro tratamentos......................................... 59 TABELA 6A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger incorporadas à ração de fase inicial submetida a quatro tratamentos e armazenadas durante o período máximo de 60 dias................................................. 60 56 TABELA 1A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger armazenadas nas formas originais. Quadrado médio Fonte de variação Grau de liberdade A. oryzae A. niger Tempo de armazenamento 5 3622360,60** 4350122,54** Erro 18 55484,50 160898,57 9,78% 4,38% Coeficiente de variação **Teste de F significativo a 1% de probabilidade. 57 TABELA 2A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger armazenadas nas formas incorporadas ao núcleo. Quadrado médio Fonte de variação Grau de liberdade A. oryzae A. niger Tempo de armazenamento 6 166770585,06** 121064019,40** Erro 21 2850732,60 1775417,15 6,97% 5,41% Coeficiente de variação **Teste de F significativo a 1% de probabilidade. TABELA 3A Resumo da análise de variância da atividade das fitases de A. oryzae, A. niger e S. cerevisae em função do pH. Grau de liberdade Quadrado médio FV A. oryzae A. niger S. cerevisae A. oryzae A. niger S. cerevisae pH 4 4 4 3619968,92** 27447348,90** 31874831,81** Erro 15 19 19 2154,23 26915,13 329509,44 4,37% 5,07% 12,64% CV FV = fonte de variação; CV = coeficiente de variação. **Teste de F significativo a 1% de probabilidade. 58 TABELA 4A Resumo da análise de variância da atividade das fitases de A. oryzae, A. niger e S. cerevisae em função da temperatura. Grau de liberdade FV Quadrado médio A. oryzae A. niger S. cerevisae A. oryzae A. niger S. cerevisae Temperatura 4 5 6 1644483,05** 100775971,27** 64758522,24** Erro 15 18 21 15368,05 36176,94 65491,71 13,17% 2,49% 4,25% CV FV = fonte de variação; CV = coeficiente de variação. **Teste de F significativo a 1% de probabilidade. TABELA 5A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger incorporadas a dois tipos de rações submetidas a quatro tratamentos. Quadrado médio Fonte de variação 59 Grau de liberdade A. oryzae A. niger Tipo de ração 1 11484,38NS 113025,38NS Tratamento 3 47262,49NS 113515,93NS Tipo de ração X tratamento 3 19702,82NS 1055,15NS Erro 16 130652,54 83417,08 10,77% 9,41% Coeficiente de variação NS = não-significativo. TABELA 6A Resumo da análise de variância da atividade das fitases de A. oryzae e A. niger incorporadas à ração de fase inicial submetida a quatro tratamentos e armazenadas durante o período máximo de 60 dias. Quadrado médio Fonte de variação 60 GL A. oryzae A. niger Tratamento 3 36532,20NS 22731,79NS Erro a 8 89826,37 61387,90 Tempo de armazenamento 4 207557,63NS 29163,36NS Tratamento X tempo de armazenamento 12 31240,38NS 29088,17NS Erro b 32 81892,49 51993,25 9,54% e 9,11% 8,31% e 7,64% Coeficiente de variação GL = grau de liberdade. NS = não-significativo.
Download