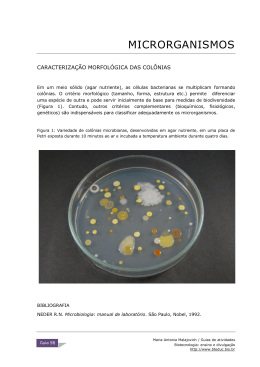
Prática 2: Cultura de Microrganismos Introdução Os microrganismos tal como outros organismos vivos necessitam de obter os nutrientes apropriados do seu meio ambiente. Assim se queremos cultivar e manter microrganismos vivos em laboratório, necessitamos de os colocar em meios de cultura, contendo os nutrientes apropriados para o seu crescimento. Para além de nutrientes é igualmente necessário que as condições de oxigénio (presença ou ausência), pH e pressão osmótica sejam adequadas ao crescimento desses microrganismos. Na preparação dos meios e na manutenção das culturas de microrganismos é importante observar as necessárias condições de assépsia, de modo a se evitarem contaminações com outros microrganismos. Os meios de cultura dividem-se primeiramente em meios sólidos, aqueles que contêm agar, e meios liquidos, sem agar. Ambos os meios são preparados com água destilada, aquecidos até que se dissolvam completamente e posteriormente esterilizados por autoclavagem a 121oC. Nos meios sólidos o crescimento pára por exaustão de nutrientes, devendo realizar-se a transferência de colónias para novo meio. No entanto estes meios permitem a individualização das colónias. Os meios liquidos permitem melhor difusão de metabólitos, mas não o isolamento de colónias. Após autoclavagem, os meios sólidos vertem-se em caixas de petri de forma a cobrir uniformemente o fundo da caixa e após solidificação guardam-se por 24h na estufa a 37oC para testar a sua esterilidade e em seguida no frigorifico até à altura das sementeiras. Os meios sólidos podem também ser vertidos em tubos de ensaio de vidro. Os meios liquidos são mantidos em tubos de ensaio de vidro (os meios ditos sólidos estão liquidos quando saiem do autoclave e solidificam após o arrefecimento). Quanto ao grau nutritivo dos meios de cultura consideram-se: meios nutritivos gerais: contendo elementos minerais e metabólitos orgânicos. Ex. Agar Nutriente, Caldo Nutriente meios enriquecidos: contendo produtos biológicos (sangue, soro), vitaminas. Ex: Agar Sangue, meio geral não selectivo. meios complexos: contêm todos os ingredientes necessários para o crescimento de um determinado microrganismo, mas não se conhecem as quantidades exactas de todos os componentes. meios definidos: aqueles em que se sabe a concentração exacta dos seus componentes. A composição destes meios varia consoante os requisitos dos organismos a cultivar. Classificam-se ainda os meios em: Selectivos, meios para selecção de determinados grupos de bactérias, os quais contêm substâncias que inibem o crescimento de outras bactérias distintas daquelas que nos interessam (meios sólidos). Ex: Agar Pseudomonas, Tiossulfato-citrato-bilis-sacarose (TCBS) para Vibrio, Agar MacConkey para coliformes. Diferenciais, para identificação de microrganismos, meios sólidos com a composição quimica adequada para evidenciar uma caracteristica bioquimica (meios sólidos). Ex: MacConkey Agar pª isolamento de coliformes, patogénios intestinais na água produtos derivados do leite, e espécimens biológicos. Neste agar após 24h a 35oC as colónias de Escherichia coli são vermelhas e mucóides, enquanto que as colónias de Salmonella e Shigella são brancas. Indicadores, meios liquidos, com a mesma função dos diferenciais, servem para evidenciar uma caracteristica bioquímica, mas não para separar as colónias positivas e as negativas. O pH do meio é ajustado antes de autoclavar. A cultura de báctérias é iniciada num meio estéril por transferência de inoculo para o meio estéril através de uma ansa. Essa ansa é esterilizada à chama antes e depois desta operação. Após a inoculação de um meio com bactérias, é necessário incubar o meio num ambiente adequado aos requisitos de crescimento dos microrganismos. O crescimento de bactérias num meio liquido identifica-se por turvação do meio, formação de uma pelicula na sua superficie, ou aparecimento de sedimento, enquanto que num meio sólido por aparecimento de colónias. Os meios liquidos são designados de caldos (broth). Os meios sólidos podem ainda ser vertidos em tubos de ensaio de vidro, os quais são inclinados, de modo a que, durante a solidificação do meio, se forme um slope ou slant (Fig.1). Este slant oferece uma superficie adequada ao cultivo de microrganismos aeróbios e anaeróbios facultativos. Para inoculação de microrganismos nestes slants, utiliza-se uma ansa recta e o tipo de sementeira chama-se por picada (agar stab) (Fig.1). A sementeira por picada faz-se também em meios sólidos mantidos em tubos de vidro sem slant. Este tipo de cultura utiliza-se para a manutenção de cultura stocks, em meios designados de conservação (3g de Tryptose Soy Broth, TSB; 3g de BactoAgar em 100 ml de água destilada, acrescentar 1.5g de NaCl para Vibrio). Estas culturas stock são mantidas em laboratório, podendo ser utilizadas para experiências. As culturas em meio sólido são convenientes para isolamento de colónias de bactérias. As colónias de diferentes espécies de bactérias diferem no tamanho, forma, textura e cor. A cultura de bactérias em meio sólido faz-se por sementeira por "streak" (esgotamento) ou por "pour plate" (incorporação). No tipo de cultura por streak, utilizam-se placas de petri com meio sólido e faz-se a sementeira com uma ansa esterilizada arrastando a ansa levemente sobre o meio (Fig. 2). O objectivo é a obtenção de cólonias isoladas para se poderem posteriormente identificar. Após a incubação e havendo crescimento devemos observar a forma da colónia, os seus bordos, a cor, se houve hémolise (caso de cultura em meios com sangue). Na técnica de pour plate, a inoculação do agar é feita antes da sua solidificação (no entanto após retirada do meio do autoclave é necessário deixá-lo arrefecer até 45oC). Nesta técnica o meio de cultura arrefecido mas ainda liquido é misturado com inóculo de bactérias, posteriormente vertido em caixas de petri e incubado. Assim as colónias podem desenvolver-se por todo o meio (Fig. 3) Material e Métodos -Balões de fundo chato e pescoço curto -Tubos de ensaio de vidro -Algodão cardado, gaze, papel de embrulho e fio -Caixas petri esterilizadas -Balança -Placa de aquecimento -Goblets e provetas -Agar nutriente e caldo nutriente desidratados -Água destilada. Para a preparação dos meios Agar e Caldo Nutriente proceder do seguinte modo: 1- Pesar as quantidades dos meios desidratados de acordo com as instruções do seu orientador. Diluir o meio desidratado em água destilada, mexer bem até dissolver todo o pó. 2- Cozinhar os meios tendo o cuidado de agitar os balões de quando em quando, de modo a que permanecem com aspecto homogéneo e não se formem grânulos. 3- Após o cozimento rolhar os balões de Agar Nutriente com rolha confeccionada com algodão cardado e gaze. Envolver a rolha após colocada com papel de embrulho e amarrar bem com o fio de embrulho. 4- Dispender o Caldo Nutriente por tubos de ensaio até metade do tubo e igualmente rolhar os tubos com algodão cardado. 5- Leve os balões de Agar Nutriente e os tubos do Caldo Nutriente a autoclavar por 15 minutos à temperatura de 1210C. 6- Após a esterilização retire os meios da autoclave. Deixe arrefecer o Agar Nutriente até cerca de 450C. Em seguida dispense o meio em caixas de petri esterilizadas, cerca de 20ml em cada uma delas. O procedimento será o seguinte: abra a tampa ligeiramente, verta a quantidade necessária de meio, feche a tampa e movimente a caixa de modo a espalhar o meio homogéneamente por todo o seu fundo. Deixe o meio solidificar . 7- Inverta as caixas, identifique-as com data e tipo de meio e incube por 48h a 370C para a prova de esterilidade. Incube também os tubos de Caldo Nutriente. 8- Guarde todos os meios após a prova de esterilidade no frigorífico, até a próxima aula prática. 9- Trabalhe sempre junto da chama da lamparina ou Bunsen Na aula seguinte poderá analisar os meios e verificar se efectivamente estão estéreis. Será então possivel elaborar o seu relatório sobre preparação de meios de cultura e esterilização. Bibliografia de apoio: Seeley, H.W. Jr., VanDemark, P.J., Lee, J.J. (1991). Microbes in action. W.H. Freeman & Company, New York: chapter 8 & 9. DIFCO Manual: pp. 4-16 Anexos: Figura 1 & 2: (1) “Slope” ou “Slant de Agar”; (2) Sementeira por esgotamento (Streak Plate) (a). Retirado de Black, 2002. Figura 3: Sementeira por incorporação (Pour-Plate) e por espalhamento (Spread-Plate). Retirado de Black, 2002.
Baixar