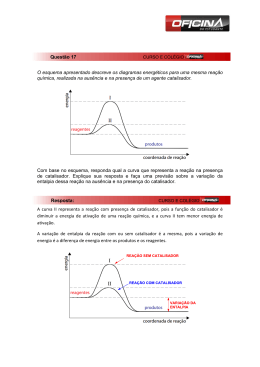
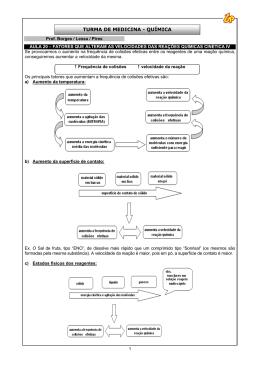
Aulas de química por Carlos Disciplina: Físico-química Assunto: Cinética química Página : CINÉTICA QUÍMICA 1 1.3 - Ocorrências Cinética = movimento próprio. Estático = parado Estuda a velocidade das reações e os fatores que as influenciam. Símbolos:concentraçõe: [x ], C, m; ↑aumenta, ↓ diminui Unidades: M, mol/L Formulário: n1 = m / MM Ex. ferrugem(Copel); dinamite, alimentos(geladeira). 8M 6M 4M 2M NH3 Tempo(h) Volume(L) 0 1 2 3 1 1 1 1 Formação e consumo pela tabela 2NH3 01 - Velocidade de reação + 3H2 →N2 [ ] gastou [ ] gastou [ ] gastou t=0 8 2 0 1 0 3 T=1 6 2 1 1 3 3 T=2 4 2 2 1 6 3 ∆q = quantidade reagido (q1-q0) T=3 2 ∆t = quantidade reagido (t1-t0) No gráfico será: 10 aA + bB → cC + dD 1.1 velocidade média: vm = Δq/∆t sendo q = quantidade e t = tempo Sinais : negativo = reagentes, positivo = produtos Ex: Ex: ocorrência 2NH3 reagentes [ ]↓ → 1.2 velocidade média da reação: vmr = vmédia A/a + vmédia B/b + ... 1N2 + 3H2 produtos [ ]↑ 3 9 8 6 4 2 0 0 1 2 3 4 Aulas de química por Carlos Disciplina: Físico-química Assunto: Cinética química Página : 02 - Energia de ativação 2.1 - Complexo ativado “Ca” Estrutura intermediária entre os reagentes e os produtos. Possui ligações intermediárias entre as dos reagentes e as dos produtos. 2.2 - Energia de ativação “Ea” As Colisões ocorrem entre os átomos dos reagentes, resultando a quebra de algumas ligações para formar o produto. No momento do choque, forma-se uma estrutura intermediária entre reagentes e produtos denominada complexo ativado ( estado de transição entre reagentes e produtos, com reações enfraquecidas dos reagentes e novas ligações dos produtos) H-H Energia mínima necessária para a formação do complexo ativado. Ex. Atrito do fósforo, faísca do isqueiro, faísca dos “airbag” 2.3 - Gráficos 2 03 - Teoria da colisão → Cl-Cl H ....... H | | Cl ........ Cl → H | Cl + H | Cl Para haver reação é necessário que: • Os reagentes colidam entre si; • a colisão ocorra com geometria favorável à formação do complexo ativado; • a energia das moléculas que colidem entre si seja igual ou superior à Ea. 3.1 - Tipos de colisões: 6 Colisões elementares 5 4 Ocorrem numa única etapa. Ex: 2NO + H2 → N2O + H2O 3 Colisões não elementares: 2 1 Ocorrem em várias etapas. (2 ou mais) Os cálculos são feitos pela etapa lenta. 0 Ex. 0 6 NO + NO → N2O2 (etapa lenta) N2O2 + O2 → 2NO2 (etapa rápida) 2NO + O2 → 2NO2 (reação global) 5 Mecanismo de reação 4 é o conjunto das etapas em que ocorre a reação. 3 A etapa lenta é a que determina a velocidade da reação. O mecanismo de uma reação é proposto com base no estudo de sua velocidade. 2 1 0 0 Aulas de química por Carlos Disciplina: Físico-química Assunto: Cinética química Página : ↑ concentração dos reagentes = ↑ número de colisões entre as moléculas. 04 - Lei da velocidade de reação Reação global: 3 Isso faz com que a probabilidade de colisões efetivas acontecerem para a formação do complexo ativado seja maior. Logo, quanto maior a concentração dos reagentes, maior será a velocidade da reação. aA + bB + ... → produtos v = k [A]p [B]q p e q são experimentalmente determinados k = constante de velocidade de reação; aumenta com a temperatura p = ordem da reação em relação a A q = ordem da reação em relação a B p + q + ... = ordem da reação → ← 20min 8 min ↓[HCl]+Fe ↑[HCl]+Fe 5.2 - Efeito da superfície de contato Ex: [A] = 2M, [B]= 3M; K = 0,5 Reação : 3A + 2B → 2C + 4D v = k [A]3 [B]2 → V = 0,5x23 x 32 → 36M ↑ superfície de contato entre os reagentes =↑ velocidade da R. [A] [B] V(m) ordem 2M 3M 0,5 4x=2 → A = 2 4 3 2 4 6 2 2 V = K x [a] x [B] 2 Uma substância sólida, quanto mais reduzida a pó estiver a substância sólida, maior é a superfície de contacto entre as partículas de ambas as substâncias e portanto, maior é a possibilidade de essas partículas colidirem umas com as outras. CaCO3 + 2 HCl → CaCl2 + H2O + CO2↑ 0 1x=2 → B = 0 0 Barra pó 5.3 - Efeito da temperatura. 05- Fatores que influenciam na velocidade das reações: 5.1- Efeito da concentração Grau de agitação das partículas que aumenta a probabilidade de colisões. Aulas de química por Carlos Disciplina: Físico-química Assunto: Cinética química Página : Alimentos na geladeira demoram muito mais para estragar do que no ambiente. Isso porque as reações químicas feitas pelos microorganismos decompositores são retardadas pela temperatura baixa. Regra de Van't Hoff. Há uma regra que foi formulada no século XIX pelo holandês Jacobus Henricus van't Hoff que diz que um aumento de 10 graus Celsius na temperatura do sistema que irá reagir duplica a velocidade da reação. Hoje sabe-se que essa regra apresenta várias exceções, mas ela é muitas vezes útil para se fazerem previsões aproximadas do comportamento da velocidade de certas reações. 5.4 – Efeito da Pressão ↑ pressão = ↑ colisões efetivas. = ↑velocidade da reação. A pressão só influencia quando tiver pelo menos uma substância gasosa como reagente. um aumento de pressão num sistema em reação implica um contato maior entre os reagente, pois o volume do sistemaa diminui. desse modo, haverá um numero maior de particulas reagentes por unidade de volume ( a concentração aumenta), o que possibilita um maior número de colisões entre as particulas. Consequentemente a velocidade da reação se torna maior. O efeito da pressão é consideravel apenas quando substâncias na fase de agregação gasosa partcipam da reação. 5.5 - Catálise e catalisador Catálise é uma reação na qual toma parte um catalisador. Catalisador É uma substância que aumenta a velocidade de uma reação, permanecendo inalterado qualitativa e quantitativamente no final da reação. A ação do catalisador é abaixar a 4 energia de ativação, possibilitando um novo caminho para a reação. O abaixamento da energia de ativação é que determina o aumento da velocidade da reação. Catálise homogênea Catalisador e reagentes constituem uma só fase. Catálise heterogênea Catalisador e reagentes constituem mistura heterogênea). duas ou mais fases (sistema polifásico ou 5.6 - Enzima Enzima é uma proteína que atua como catalisador em reações biológicas. Caracteriza-se pela sua ação específica e pela sua grande atividade catalítica. Apresenta uma temperatura ótima, geralmente ao redor de 37°C, na qual tem o máximo de atividade catalítica. Promotor de reação ou ativador de catalisador é uma substância catalítica na reação. que ativa o catalisador, mais isoladamente não tem ação Veneno de catalisador ou inibidor é uma substância que diminui e até destrói a ação do catalisador, sem tomar parte na reação. 5.5 - Autocatálise Quando um dos produtos da reação atua como catalisador. No início, a reação é lenta e, à medida que o catalisador (produto) vai se formando, sua velocidade vai aumentando. Aulas de química por Carlos Disciplina: Físico-química Assunto: Cinética química Página : 1 – dado a reação de combustão do metano: Tempo/min CH4+ 2O2→ CO2+ 2H2O 0 40mol 90 0 0 70 10 20 10 30 60 15 30 20 25 40 25 50 30 15 26 32 64 40 8 Nos instantes de 20 e 40min., calcule: a) Vm do CO2 Vm20 = 15/20 = 0,75M/min. Vm40 = 32/40 = 0,8M/min. b) Vm do O2 Vm20 = 30/20 = 1,5M/min. Vm40 = 64/40 = 1,6M/min. c) construa o gráfico N2 + 3 H2 1 0,3 2NH3 → 2 X=0,6 Exercícios b) decompõe / hora 60 min ------------y mol 1 min--------------0,6 Y = 36 mol/h 3 – A Vm de H2O2 em I, II e II será? 0,9 0,8 I 0,7 0,6 0,5 II 0,4 III 0,3 0,2 c 0,1 100 80 60 40 20 0 0 0,8 I= II III 0,5 0,3 0,2 vm= 0,3/10 = 0,03M/min Vm = 0,2/10 = 0,02M/min. Vm = 0,1/10 = 0,01M/Min. 4 – Se Vm (NH3) = 4 M/h na reação : N2 + 3H2 → 2NH3. 0 10 20 30 40 50 A Vm H2 = ? 6M/h 5 – Vm(N2) = 0,05M/min. Qual a massa de CO2 em 60 min? 2 – A decomposição do amoníaco produz 8,4g/min de N2. A velocidade dessa reação em mols de NH3 por hora será? Dado ( N = 14; H = 1) n=m/MM → n = 8,4/28 = 0,3mol/min a) decompõe / min. 2NO2 + 4CO → N2 + 4CO2 a) 5 Aulas de química por Carlos Disciplina: Físico-química Assunto: Cinética química Página : 6
Baixar