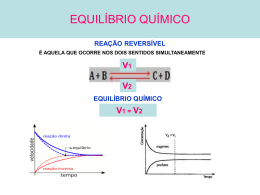
Deslocamento de Equilíbrio Químico Um sistema em equilíbrio responde a qualquer perturbação com uma alteração que tende a contrariar a perturbação a que foi sujeito. Ao estudar o andamento das reações, Le Chatelier percebeu que era possível prever o sentido do deslocamento dos equilíbrios químicos, criando a afirmativa que hoje é conhecida como “Princípio de Le Chatelier”: Deslocamento de Equilíbrio Químico “Quando um fator externo (concentração, temperatura ou pressão) age sobre um sistema em equilíbrio, ele se desloca, com o objetivo de anular a ação desse fator, procurando atingir um novo estado de equilíbrio.” Deslocamento de Equilíbrio Químico Fator Concentração: Um aumento da concentração de um participante desloca o equilíbrio no sentido da reação em que este participante é consumido. Uma diminuição da concentração de um participante desloca o equilíbrio no sentido da reação em que este participante é formado . Deslocamento de Equilíbrio Químico Exemplo: N2(g) + 3 H2(g) 2 NH3(g) Situação: aumento da concentração de nitrogênio. O equilíbrio será deslocado no sentido de formação de produto (reação direta): Deslocamento de Equilíbrio Químico Deslocamento de Equilíbrio Químico Fator Pressão: Um aumento da pressão desloca o equilíbrio para a reação que ocorre com contração de volume. Uma diminuição da pressão desloca o equilíbrio para a reação que ocorre com expansão de volume. Deslocamento de Equilíbrio Químico Considerando a síntese da amônia: N2(g) + 3 H2(g) 2 NH3(g) • aumento da pressão do sistema: desloca o equilíbrio para a direita. •diminuição da pressão do sistema: desloca o equilíbrio para a esquerda. Deslocamento de Equilíbrio Químico Logo: aumento de pressão provoca contração de volume o equilíbrio se desloca para o lado de menor volume (menor nºde mol) diminuição de pressão provoca expansão de volume o equilíbrio se desloca para o lado de maior volume (maior nºde mol) Deslocamento de Equilíbrio Químico Fator Temperatura: Um aumento da temperatura desloca o equilíbrio para a reação endotérmica. Uma diminuição da temperatura desloca o equilíbrio para a reação exotérmica. Deslocamento de Equilíbrio Químico Considerando a síntese da amônia: N2(g) + 3 H2(g) 2 NH3(g) H < 0 reação direta é exotérmica • aumento da temperatura do sistema: desloca o equilíbrio no sentido da reação endotérmica (para a esquerda). •diminuição da temperatura do sistema: desloca o equilíbrio no sentido da reação exotérmica (para a direita). Deslocamento de Equilíbrio Químico De maneira geral temos: A2(g) + 3B2(g) reação direta 2 AB3(g) H<0 reação inversa O equilíbrio será deslocado no sentido da reação direta, se houver: • aumento da concentração dos reagentes; • redução da concentração do produto. • aumento da pressão do sistema; • redução da temperatura do sistema. Deslocamento de Equilíbrio Químico De maneira geral temos: A2(g) + 3B2(g) reação direta 2 AB3(g) H<0 reação inversa O equilíbrio será deslocado no sentido da reação inversa, se houver: • redução da concentração dos reagentes; • aumento da concentração do produto; • redução da pressão do sistema; • aumento da temperatura do sistema. Deslocamento de Equilíbrio Químico Efeito dos catalisadores sobre o equilíbrio: Os catalisadores não deslocam equilíbrio, apenas provoca uma diminuição do tempo necessário para que esse equilíbrio seja atingido.
Baixar