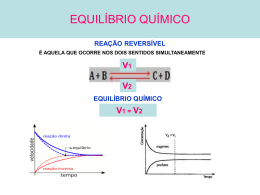
O que você deve saber sobre EQUILÍBRIO QUÍMICO O equilíbrio químico estuda as reações reversíveis. Nelas, formam-se produtos que reagem entre si originando reagentes de partida. Como elas não acabam e, no equilíbrio, a velocidade das reações direta e inversa é igual, a concentração de todas as substâncias presentes no estado de equilíbrio permanece constante. I. Constante de equilíbrio EQUILÍBRIO QUÍMICO I. Constante de equilíbrio EQUILÍBRIO QUÍMICO I. Constante de equilíbrio v1 = K1 [CO2] [H2] v2 = K2 [CO] [H2O] No equilíbrio, v1 = v2; portanto, K1 [CO2] [H2] = K2 [CO] [H2O] K1 = [CO] [H2O] K2 K1 e K2 = constantes de velocidade EQUILÍBRIO QUÍMICO [CO2] [H2] = Ke Ke = constante de equilíbrio [] = concentração molar – mol/L I. Constante de equilíbrio Para uma reação do tipo: aA + bB cC + dD, a expressão da constante de equilíbrio é dada por: EQUILÍBRIO QUÍMICO II. Relação entre Kc e Kp Kp = Kc · (R · T)∆n, em que R é a constante universal dos gases, T é a temperatura em Kelvin (oC + 273) e n é a variação do número de mols entre produtos e reagentes (c + d) – (a + b). n só inclui substâncias no estado gasoso. EQUILÍBRIO QUÍMICO III. Tipos de equilíbrio químico Sistemas homogêneos Sistemas heterogêneos EQUILÍBRIO QUÍMICO IV. Grau de equilíbrio (α) EQUILÍBRIO QUÍMICO IV. Grau de equilíbrio (α) Aqueceram-se 2 mols de PCl5 em um recipiente fechado com capacidade de 2 litros. Atingindo o equilíbrio, o PCl5 se encontrava 40% dissociado em PCl3 e Cl2. Qual a constante de equilíbrio? EQUILÍBRIO QUÍMICO V. Alteração do estado de equilíbrio Princípio de Le Chatelier: “Quando um fator externo age sobre um sistema em equilíbrio, este se desloca, procurando reduzir a ação do fator aplicado”. Influência das concentrações dos participantes do equilíbrio Aumentando a concentração de uma substância participante, o equilíbrio se desloca no sentido do seu consumo. Diminuindo a concentração de uma substância participante, o equilíbrio se desloca no sentido da sua formação. EQUILÍBRIO QUÍMICO V. Alteração do estado de equilíbrio Influência da pressão total sobre o sistema em equilíbrio O aumento da pressão total desloca o equilíbrio no sentido de formar o menor volume de moléculas gasosas (menor número de mols). A diminuição da pressão total desloca o equilíbrio no sentido de formar o maior volume de moléculas gasosas (maior número de mols). Caso o ∆n seja igual a zero, variações de pressão não afetam o equilíbrio. Influência da temperatura O aumento da temperatura desloca o equilíbrio no sentido da reação endotérmica (absorção de energia). A diminuição da temperatura desloca o equilíbrio no sentido da reação exotérmica (liberação de energia). EQUILÍBRIO QUÍMICO V. Alteração do estado de equilíbrio Influência do catalisador Um catalisador diminui o tempo necessário para o sistema atingir o equilíbrio, mas não altera o rendimento obtido. EQUILÍBRIO QUÍMICO Conceito de equilíbrio químico Clique na imagem abaixo para ver a animação. EQUILÍBRIO QUÍMICO
Baixar