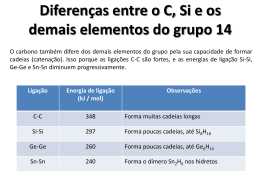
Centro Universitário Anchieta Química Inorgânica II - Prof. Vanderlei I. Paula Lista de Exercícios 2 – turma 2014 Grupo 14/IV-A GABARITO 1) Quais são as duas principais formas alotrópicas do carbono e quais são suas principais diferenças? Resposta: As duas principais formas alotrópicas do carbono são o grafite e o diamante. Ambos compostos são constituídos por carbono e diferem entre si pelo arranjo geométrico devido a diferente constituição das ligações químicas. No grafite o tipo de ligação que prevalece é sp2, assim há um orbital p livre. A geometria predominante no grafite é lamelar, formada por anéis de seis carbonos e os orbitais p livres possibilitam a transmissão da corrente elétrica. As propriedades físicas típicas são condutividade elétrica e características de lubrificantes (deslizamento entre as laminas). No diamante a ligação é do tipo sp3 assim só há ligações simples, o que prevalece a estrutura tetraédrica. A ligação sp3 é bem rígida e permite pequena mobilidade entre os átomos o que faz a estrutura ser bem dura. A alta dureza pode ser utilizada como abrasivos para peças e as ligações simples não são condutoras de energia elétrica. 2) Explique por que a grafite pode conduzir corrente elétrica, mas o diamante não. pg. 657 Atkins. Resposta: O grafite conduz corrente elétrica devido a suas ligações serem do tipo sp2 e possuírem um orbital p livre com um elétron. A estrutura formada é lamelar o que permite a condução dos elétrons via os orbitais p conforme mostrado na figura ao lado. O diamante possui ligação sp3, ou seja, somente ligações simples, assim não há orbitais e nem elétrons livres para condução eletrônica. A estrutura formada é rígida como mostrada na figura ao lado. 3) Explique por que o SiH4 (silano) reage com água (que possui íon hidroxila, OH-) e o CH4 (metano) não reage. pg. 658 Atkins, pg. 306 Shriver. Resposta: O silano é reativo na presença de água, ou seja, sofre hidrólise (quebra pela água), isso se deve a energia de ligação de Si-H ser menor (326 kJ/mol) em relação ao gás metano que (416k/mol), desse modo, as ligações do silano são menos estáveis e consequentemente mais reativas. 4) Complete as reações: a) C(s) + 2 Cl2(g) CCl4 b) C(s) + O2(g) CO2 [email protected] // www.aquitemquimica.com.br Centro Universitário Anchieta Química Inorgânica II - Prof. Vanderlei I. Paula Lista de Exercícios 2 – turma 2014 c) C(s) + Si(s) SiC d) 2 PbS(s) + 3 O2(g) 2 PbO + 2 SO2 e) SnO2 (s) + C(s) Sn + CO2 f) SiO2(s) + C(s) Si + CO2 5) Como se obtêm silício e germânio de alto grau de pureza, necessários na indústria de semicondutores? Resposta: O silício ou germânio são obtidos com alto grau de pureza através do processo de refino por zona, que consiste em aquecer um sistema (tubo) que possui um gás inerte (silício reage com oxigênio: Si +O2 SiO2) até a fusão do silício. O sistema de aquecimento é deslocado constantemente ao logo do tubo em uma única direção. Pelo fato das impurezas apresentarem tendência de permanecer no estado líquido, a medida que o tubo se resfria o material vai sendo purificado. 6) Que tipos de carbetos existem? Dê exemplos. Resposta: Os carbetos são compostos binários entre C e metais, metalóides e determinados não-metais. (C4-; C22-; C34-). Há três tipos de carbetos a seguir. - Salino, iônicos: formado por metais ativos, por exemplo, CaC2 - Intersticial : formado por metais de transição, p.ex., carbeto de tungstênio, WC. - Covalente : formado por B e Si, por exemplo, SiC. ) (KJ.mol-1 de ligação Energia 7) Por que o silício forma polímeros oxigenados (chamados silicones) bastante estáveis? Resposta: O gráfico a baixo deixa claro que as energias de ligações, no caso do Si + O a ligação sigma é a mais estável e a ligação pi é menos favorecida. C=O 700 Si=O 600 500 400 300 200 100 0 Energia total Sigma Pi 3º 2º Pe r ío Pe río do do 8) Qual a composição principal do vidro comum? (para quem se interessar, há nas pg. 674 e 675 um pouco sobre a formação do vidro) Resposta: O vidro comum se obtém por fusão em torno de 1.250 ºC de dióxido de silício, (SiO2), carbonato de sódio (Na2CO3) e carbonato de cálcio (CaCO3). [email protected] // www.aquitemquimica.com.br
Baixar