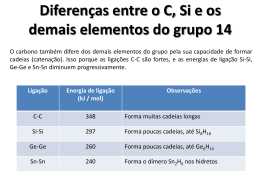
O GRUPO DO CARBONO (14 OU IVA) O carbono elementar (C) é encontrado em mina como grafite e diamante. O silício elementar (Si) é recuperado partir da sílica (SiO2) pela redução com carbono em forno de arco elétrico. O germânio (Ge), muito menos abundante, é encontrado em minérios de zinco. O carbono (do latim carbo, carvão) é um elemento químico, símbolo C de número atômico 6 (6 prótons e 6 elétrons) com massa atômica 12 u. Há 15 isótopos do carbono, sendo apenas 2 estáveis: C – 12 (98,89%) C – 13 (1,11%) C – 14 radioativo com tempo de meia-vida de 5730 anos. Datação de fósseis É sólido a temperatura ambiente. Dependendo das condições de formação pode ser encontrado na natureza em 4 formas alotrópicas: 1. Grafite 2. Diamante 3. Fulerenos 4. Nanotubos HIBRIDIZAÇÃO DO CARBONO HIBRIDAÇÃO DE ORBITAIS: É UM NOVO REARRANJO PROVENIENTE DA UNIÃO DE VÁRIOS ORBITAIS COM NOVA ORIENTAÇÃO, FORMATO E ENERGIA. JUSTIFICA A VALÊNCIA DE ALGUNS ELEMENTOS QUÍMICOS. CARBONO COM 4 SIMPLES LIGAÇÕES – HIBRIDIZAÇÃO sp3 – MOLÉCULA TETRAÉDRICA – ÂNGULO ENTRE AS LIGAÇÕES:: 109 LIGAÇÕES 109° °28 28’’. ESTADO NORMAL ESTADO ATIVADO ESTADO HÍBRIDO sp3 2p3 2p2 2s2 1s2 2s1 1s2 1s2 ORBITAL sp3 109° 109 °28’ H METANO: CH4 4 LIGAÇÕES SIGMA sp3- s C H H H CARBONO COM 1 DUPLA LIGAÇÃO – HIBRIDIZAÇÃO sp2 – MOLÉCULA TRIGONAL PLANA – ÂNGULO ENTRE AS LIGAÇÕES::120° LIGAÇÕES 120°. (O ORBIPAL p DA LIGAÇÃO PI NÃO SOFRE HIBRIDAÇÃO) HIBRIDAÇÃO).. ESTADO NORMAL ESTADO ATIVADO ESTADO HÍBRIDO sp2 2p3 2p2 2s2 2s1 PI 1s2 1s2 1s2 ETENO – H2C=CH2 – HIBRIDIZAÇÃO sp2 LIGAÇÃO PI H H C H δ sp2 - sp2 C H CARBONO COM 2 DUPLAS OU UMA TRIPLA LIGAÇÂO – HIBRIDIZAÇÃO sp – MOLÉCULA LINEAR – ÂNGULO ENTRE AS LIGAÇÕES: LIGAÇÕES:180 180° °. (DUAS LIGAÇÕES PI) ESTADO NORMAL ESTADO ATIVADO ESTADO HÍBRIDO sp 2p3 2p2 2s2 1s2 2s1 1s2 PI 1s2 PI ETINO : H LIGAÇÃO PI H -C C -H δ sp-s C δ sp-sp C δ sp-s H LIGAÇÃO PI DIAMANTE X GRAFITE São duas formas do carbono elementar e são notavelmente diferentes: 1. 2. 3. O diamante é um isolante elétrico; o grafite é um bom condutor. O diamante é a substância mais dura conhecida; o grafite é mole. Por causa da durabilidade e da transparência o diamante é uma das pedras mais preciosas mais valiosas As propriedades físicas amplamente diferentes pode ser relacionada com as estruturas e as ligações muito diferentes nesses dois compostos. Estrutura do diamante Estrutura do grafite Cada átomo de C forma ligação simples de comprimento 1,54 Å com 4 átomos de C adjacentes nos vértices de um tetraédro regular (Hibridização sp3) . O resultado é uma estrutura rígida, covalente e tridimensional. tridimensional. Consiste no empilhamento de camadas planares dentro da qual cada átomo de C tem três vizinhos mais próximos a 1,42 Å (Hibridização sp2) – 3 ligações simples e 1 dupla.. dupla Os planos estão amplamente separados um dos outros (3,35 Å), o que indica que há forças mais fracas entre eles (DISPERSÃO DE LONDON), LONDON) podendo ser quebrado facilmente. CONDUTIVIDADE ELÉTRICA DO GRAFITE Sua condutividade perpendicular aos planos é baixa e aumenta com a temperatura Isso significa que o grafite é um semicondutor nessa direção A condutividade é muito maior paralela aos planos, mas decresce à medida que a temperatura é aumentada Esse comportamento indica condução metálica nessa direção COMPOSTOS DE INTERCALAÇÃO Agentes oxidantes ou redutores podem ser intercalados entre as lâminas do grafite para aumentar a condutividade elétrica. CONVERSÃO A conversão de diamante em grafite à temperatura e pressão ambiente é espontânea, mas não ocorre a uma velocidade observável. O diamante é a fase mais densa; assim, ele é favorecido por pressões elevadas. Grandes quantidades de diamante abrasivo são fabricadas industrialmente por um processo a pressão e temperatura elevadas na presença de catalisadores. O catalisador (Ni) dissolve o grafite a 1800 °C e 70 kbar e a fase diamante menos solúvel cristaliza a partir desta. Conclusão: A síntese de diamantes com qualidade de pedra preciosa é possível, mas ainda não é econômica. DIAGRAMA DE FASES DO CARBONO SÍNTESE DO DIAMANTE A ALTA PRESSÃO E ALTA TEMPERATURA (HPHT) BROCA ODONTOLÓGICA FULERENOS Moléculas estáveis constituídas exclusivamente por carbono sp2, na forma de hexágonos. C60 é o fulereno mais comum, conhecido por buckminsterfullerene. C60 tem a forma esférica, com diâmetro de cerca de 1 nm, que lembra a de uma bola de futebol. Descoberta dos fulerenos levou à concessão do prêmio Nobel de química de 1996 a seus descobridores, R. Smalley, H. Kroto e R. Curl. C60 C70 APLICAÇÕES DO FULERENO PAINÉIS SOLARES DADA A SUA GRANDE FACILIDADE EM CAPTURAR ELÉTRONS (SUPERCONDUTOR) USOS BIOMÉDICOS EM QUE FÁRMACOS ATIVOS PODEM SER LIGADOS À MOLÉCULA DE C60 PARA, APÓS INTRODUZIDOS NO CORPO HUMANO, SEREM LENTAMENTE LIBERTADOS. PROPRIEDADES LUBRIFICANTES EM LÍQUIDOS REVESTIMENTO DE BOLAS DE BOLICHE EM QUE A POUCA COMPRESSIBILIDADE DO C60 AS TORNA MAIS RESISTENTES ( JÁ COMERCIALIZADAS NO JAPÃO) TACOS DE GOLFE TITÂNIO-C60 REAÇÕES COM FULERENOS NANOTUBOS(NTC) 1991 - Sumio Ijima • ESTRUTURA BÁSICA FORMADA POR UMA OU MÚLTIPLAS FOLHAS DE GRAFITE(GRAFENO) ENROLADAS DE FORMA CONCÊNTRICA E CILÍNDRICA • COMPRIMENTO: ORDEM DE MICRÔMETROS • DIÂMETRO: ORDEM DE NANÔMETROS • PROPRIEDADES MECÂNICAS: ALTA RESISTÊNCIA MECÂNICA COM ALTA FLEXIBILIDADE (OU SEJA, NÃO QUEBRAM QUANDO DOBRADOS OU SUBMETIDOS A ALTAS PRESSÕES) • PROPRIEDADES ELÉTRICA: TRANSPORTAM A CORRENTE ELÉTRICA E PODEM APRESENTAR CONDUTIVIDADE METÁLICA,SEMICONDUTORA OU ATÉ SUPERCONDUTORA(A BAIXAS TEMPERATURAS E DE ACORDO COM SUA ESTRUTURA) PROPRIEDADES TÉRMICAS: ALTÍSSIMA CONDUTIVIDADE TÉRMICA,SENDO CONDIDERADA UMA DAS MAIORES, NA DIREÇÃO DO EIXO DO TUBO. APLICAÇÕES DOS NANOTUBOS PONTAS DE PROVA EM MICROSCÓPIOS DE FORÇA ATÔMICA OBTENDO IMAGENS DE SISTEMAS BIOLÓGICOS COM ALTA RESOLUÇÃO CONDUTORES EM MICROCIRCUITOS FIBRAS PARA USOS DIVERSOS – ELES TEM UMA ESTRUTURA MAIS LEVE E MAIS RESISTENTE DO QUE AS FIBRAS DE CARBONO TRADICIONAIS FABRICAÇÃO DE MATERIAIS PARA ABSORÇÃO DE GASES ( ELES CONSEGUEM ABSORVER UMA GRANDE QUANTIDADE DE HIDROGÊNIO). O CARBONO E A NANOTECNOLOGIA O silício (latim: silex, pedra dura, inglês: silicon) é um elemento químico de símbolo Si de número atômico 14 (14 prótons e 14 elétrons) com massa atômica igual a 28 u. À temperatura ambiente, encontra-se no estado sólido. o silício Há 21 isótopos de silício: Si – 28 (92,23%) Si – 29 (4,683%) Si – 30 (3,087%) O silício é o segundo elemento mais abundante da crosta terrestre, perfazendo 25,7% do seu peso, superado apenas pelo oxigênio (47%). PROPRIEDADES Não ocorre livre na natureza. Aparece, normalmente na forma de dióxido de silício (SiO2) também conhecido como sílica e silicatos (compostos contendo silício, oxigênio e metais. É bastante eletropositivo APLICAÇÕES É um dos elementos mais úteis. Compostos como areia e argila são amplamente usados na construção civil. Usado em refratários para altas temperaturas. Silicatos são empregados na fabricação de esmaltes. Sílica é a principal substância do vidro. Por ser um material semicondutor muito abundante, tem um interesse muito especial na indústria eletrônica e microeletrônica, como material básico para a produção de transistores para chips, células solares e em diversas variedades de circuitos eletrônicos.
Baixar