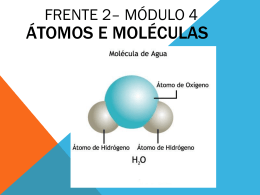
Disciplina: Química Série: 1ª A/B Atividade: PROGRAMA DE RECUPERAÇÃO E EXERCÍCIOS Aluno(a): 3ª etapa 2013 Prof.: Marco Antônio I - PERIODICIDADE QUÍMICA (TABELA PERIÓDICA) 1. Grupos(colunas ou famílias) e períodos. Elétrons de valência e localização dos elementos. 2. Configurações eletrônicas por níveis e elétrons de valência. 3. Periodicidade das propriedades atômicas: raio atômico, energia de ionização e eletronegatividade. Obs: Quanto a este item, espera-se que o aluno saiba: Identificar número atômico, grupos e período na tabela periódica moderna; Fazer configuração dos elementos utilizando as informações da tabela periódica; Interpretar tabelas e gráficos de energia de ionização; Fazer a relação entre energia de ionização e raio atômico quanto ao efeito da carga nuclear e da distância média entre elétrons de valência e núcleo. II - LIGAÇÕES QUÍMICAS E INTERAÇÕES INTERMOLECULARES 1. Modelos de ligações químicas (IÔNICA, COVALENTE E METÁLICA) - Representação de fórmulas estruturais e eletrônicas(Lewis); 2. Regra do octeto: utilização na formulação de compostos com dois elementos químicos; 3. Representação de fórmula de compostos iônico(equilíbrio de cargas elétricas); 4. Modelo de interações intermoleculares(LIGAÇÃO DE HIDROGÊNIO, DIPOLO-PERMANENTE E DIPOLO INDUZIDO); 5. Geometria e polaridade; 6. Substâncias iônicas, moleculares, covalentes e metálicas. 7. Propriedades macroscópicas de substâncias sólidas, líquidas e gasosas e de soluções: correlação com os modelos de ligações químicas e de interações intermoleculares. Orientação para estudo: O conteúdo da recuperação encontra-se em todo volume 1 e o volume 2(1º capítulo) da coleção Pitágoras da 1ª série do ensino médio e, nas anotações feitas em sala, Revise os exercícios e as provas feitas e as atividades práticas, realizadas em sala. Bons Estudos Marco Antônio EXERCÍCIOS DE RECUPERAÇÃO – QUÍMICA-1º ANO/EM 01)Considere as seguintes informações sobre os elementos químicos X, Y e Z: Elemento Família ou grupo Período X Calcogênios 3 Y 14 2 Z Metal Alcalinos 4 a) RESPONDA: Quais são os elementos X, Y e Z? b) Escreva a fórmula do composto formado entre X e Z. Explique por que a ligação entre estes dois elementos é classificada como iônica? c) INDIQUE a ordem crescente da energia de ionização desses elementos. 02) A tabela abaixo representa alguns Elemento Sódio Potássio Bário Ferro Ferro cátions e ânions Cátion Elemento Na+ Cloro + K Fluor Ba2+ Oxigênio Fe2+ Enxofre Fe3+ Nitrogênio Utilizando a tabela construa a fórmula dos seguintes compostos: a) fluoreto de sódio b) cloreto de bário c) sulfeto de sódio e) óxido de ferro II f) óxido de potássio Ânion Cl– F– O2– S2– N3– d) óxido de ferro III 03) Na chamada experiência de Rutherford, uma lâmina fina de ouro foi bombardeada com um feixe de partículas alfa (He2+). Esperava-se que todas as partículas atravessassem a lâmina, sofrendo, no máximo, pequenos desvios em sua trajetória. Surpreendentemente, porém, foi observado que uma pequena fração das partículas alfa sofria grandes desvios em relação às suas trajetórias originais. Para explicar esse resultado, Rutherford propôs a existência do núcleo atômico. A) JUSTIFIQUE por que a introdução do conceito do núcleo atômico permite explicar os grandes desvios nas trajetórias das partículas alfa. B) Suponha que, em vez de uma lâmina de ouro, se usasse uma lâmina de alumínio. Nesse caso, a fração de partículas alfa que sofreria grandes desvios seria menor, igual ou maior do que na experiência com a lâmina de ouro? JUSTIFIQUE sua resposta. 04) Considere os átomos indicados no quadro seguinte: NUMERO DE ÁTOMO I II III IV V PROTÓNS NÊUTRONS 19 22 18 19 35 20 25 22 21 45 ELÉTRONS 18 20 18 19 36 Responda: a) Quais são isótopos? Justifique sua escolha. b) Quais são cátions? Justifique sua escolha. c) Determine o número de massa dos átomos II e V. d) Relacione o tamanho (raio atômico) dos átomos I e IV. 05) O quadro abaixo estão representadas as 6 energias de ionização(kca/mol) para a retirada dos 6 elétrons de um determinado elemento químico: E1 E2 E3 E4 E5 E6 259,6 562,2 1104 1487 9034 11300 Tendo como base esse quadro, responda: a) Qual o número de níveis de energia possui esse elemento? Justifique. b) Qual o número de elétrons de valência possui esse elemento químico? Justifique. c) Localize esse elemento na tabela periódica 06) Escreva a fórmula de Lewis e a fórmula estrutural das moléculas que constituem os compostos abaixo Sulfeto de hidrogênio - H2S Formol - COH2 Iodo-I2 Fosfina – PH3 Tetracloreto de carbono -CCℓ4 07) Considere a configuração eletrônica dos seguintes átomos neutros: Cálcio(Ca) : 2 8 8 2 Sódio(Na) : 2 8 1 Enxofre(S): 2 8 6 Cloro(Cl) : 2 8 7 A) Faça a distribuição eletrônica do íon mais provável de um átomo de cálcio. B) Qual(is) desses elementos possuem uma maior tendência a formar ânions numa ligação iônica? C) Qual o nome da ligação que ocorre entre átomos de sódio e enxofre? Qual a formula do composto? D) Coloque esses elementos em ordem crescente de eletronegatividade 08) Localize o Potássio(K) e o enxofre(S) na tabela periódica A) ESCREVA a configuração eletrônica de átomos neutros desses elementos B) ESCREVA a configuração eletrônica dos íons mais prováveis, formados a partir desses átomos C) REPRESENTE a fórmula mais provável do composto iônico formado entre esses dois átomos 09) O Carbono tem uma química muito mais extensa que a dos demais elementos da tabela periódica, exceto o hidrogênio. a) Comparado aos outros elementos do segundo período da tabela periódica, o carbono é aquele cujos átomos tem a capacidade de fazer uma maior quantidade de ligações covalentes simples. INDIQUE quantas ligações covalentes simples com átomos de hidrogênio podem ser formadas, em moléculas neutras, por um átomo de cada um destes quatro elementos: Carbono, Nitrogênio, Oxigênio e Flúor. Átomos C N O F Número de ligações b) JUSTIFIQUE a sua resposta ao item a desta questão, no caso dos átomos de carbono e nitrogênio, em termos de configuração eletrônica de valência desses átomos. 10)Considere os átomos indicados no quadro seguinte: NUMERO DE ÁTOMO PROTÓNS NÊUTRONS Potássio Titânio Enxofre Potássio Bromo 19 22 16 19 35 20 25 17 21 45 ELÉTRONS 18 20 18 19 36 Tendo como base as informações desse quadro e seus conhecimentos sobre a estrutura atômica, A) RESPONDA: Qual desses átomos representam o mesmo elemento químico? JUSTIFIQUE. B) DETERMINE o número de massa dos isótopos. C ) RESPONDA Quais são ânions? JUSTIFIQUE sua escolha. D) RESPONDA Quais desses átomos são bons condutores de eletricidade no estado sólido devido a existência de “elétrons livres”. JUSTIFIQUE sua escolha. 11)Com base nos modelos de ligação química apropriada a cada caso, EXPLIQUE as causas A) da condutividade elétrica do bronze, uma liga de cobre(Cu) e estanho(Sn) no estado sólido B) da condutividade elétrica do hidróxido de sódio, soda cáustica (NaOH) dissolvido em água 12) Com base nos modelos de ligação química apropriada a cada caso, explique as causas A) da condutividade elétrica do iodeto de potássio(KI) dissolvido em água B) da condutividade elétrica do cobre(Cu) no estado sólido 13) Com base nos modelos de ligação química apropriados a cada caso, EXPLIQUE as causas a) da alta condutividade elétrica do cobre e de outros metais b) da solubilidade do etanol(C2H5OH) em água e da pouca solubilidade do tetracloreto de carbono(CCl 4) nesse mesmo solvente c) do alto ponto de fusão da grafita d) da condutividade elétrica do cloreto de sódio(NaCl) dissolvido em água 14) O desenho abaixo representa o modelo do NaCl, no estado sólido, com os íons afastados da posição real, para que se possa "enxergar" melhor a disposição dos íons Tendo como base o modelo de ligação iônica EXPLIQUE o fato do cloreto de sódio(NaCl) não conduzir eletricidade no estado sólido, uma vez que ele é formado por partículas(íons) com cargas positivas e negativas. 15) Utilize as informações da tabela para responder os itens abaixo: Substância Temperatura de fusão/ºC Temperatura de ebulição/C Hélio -He -269,5 -268,8 Cloreto de sódio - NaCl 801 1413 Tetracloreto de carbono – CCl4 -23 76,8 Dióxido de carbono – CO2 ------Sublima a -78,5 Diamante Acima de 3500 Acima de 4200 Metano – CH4 -184 -162 Água – H2O 0 100 a) Em quais das substâncias da tabela as forças de atração intermoleculares são devidas , principalmente, às forças de Van der Waals(dipolo induzido)? b) Qual(is) da(s) substância(s) forma(m) um sólido molecular constituído de moléculas polares? c) Em que substância ocorre a força de interação mais fraca? d) Em qual(is) substância(s) ocorre(m) ligações predominantemente iônicas? 16) Na tabela abaixo, estão relacionadas as propriedades de algumas substâncias sólidas, bem como os resultados de testes simples a que foram submetidas. As substâncias estão designadas arbitrariamente pelas primeiras letras do alfabeto. Substância Temperatura Densidade Solubilidade Condutividade elétrica a 25ºC de fusão/ºC (g/mL) em água a Dissolvido No estado 25ºC em água sólido A 1083 8,92 insolúvel Conduz B 185 1,58 solúvel Não conduz Não conduz C 3550 3,51 insolúvel Não conduz D 1535 7,86 insolúvel Conduz E 620 3,39 solúvel conduz Não conduz F 80 1,02 solúvel Não conduz Não conduz Com base na tabela, complete o quadro: a) indicando as substâncias moleculares, covalentes, iônicas e metálicas; b) citando, pelo menos dois critérios utilizados para a classificação; c) indicando o tipo de ligação ou interação intermolecular quebrada no processo de fusão dessas substâncias. Use as informações do quadro abaixo e seus conhecimentos sobre ligações químicas para resolver as questões 17, 18 e 19 sólido Comporta mento Solubilidade Sob aquecimento Em água Funde-se a 1083 ºC Cloreto de Funde-se a Sódio 801 ºC sacarose Funde-se a 185/186ºC Insolúvel Bom condutor Condutividade Elétrica em Solução aquosa ----------- Solúvel Mau condutor Bom condutor Solúvel Mau condutor Mau condutor Naftalina Insolúvel Mau condutor --------------- Cobre Funde-se a 80ºC Condutividade Elétrica no Estado sólido 17) EXPLIQUE o fato do cloreto de sódio, em solução aquosa conduzir corrente elétrica e de que o açúcar nas mesmas condições, não conduz? 18) EXPLIQUE o fato do cloreto de sódio não conduzir eletricidade no estado sólido, uma vez que ele é formado por partículas(íons) com cargas positivas e negativas? 19 ) Durante a fusão de um sólido ligações químicas são rompidas. Essas ligações podem ser ligações entre átomos(iônica, covalente, metálica) ou ligações entre moléculas(ligação de hidrogênio, dipolo permanente, dipolo induzido). Quais sólidos do quadro que durante a fusão são rompidas ligações entre moléculas? JUSTIFIQUE. 20) O Quadro abaixo mostra a configuração eletrônica para átomos neutros de alguns elementos químicos: K L M N O Cálcio(Ca) 2 8 8 2 Bromo(Br) 2 8 18 7 Ferro(Fe) 2 8 14 2 Rubídio(Rb) 2 8 18 8 1 Iodo(I) 2 8 18 18 7 A) REPRESENTE o íon mais provável formado pelos átomos de cálcio e ESCREVA sua configuração eletrônica B) REPRESENTE o íon mais provável formado pelos átomos de iodo e ESCREVA sua configuração eletrônica C) INDIQUE a ligação que ocorre entre os átomos de cálcio e iodo e ESCREVA a fórmula do composto formado entre esses dois átomos D) EXPLIQUE a condutividade elétrica do composto do item A 21) A água é, sem dúvida, o mais comum e mais importante de todos os compostos. Graças às propriedades da água, a vida foi capaz de surgir e se desenvolver em nosso planeta. A figura abaixo representa a nível macroscópico o arranjo cristalino do gelo:Esse arranjo é bastante ‘aberto’, pois as moléculas acomodam-se em desenhos hexagonais, restando grandes espaços “ vazios” no interior desses hexágonos. Considerando-se o arranjo cristalino do gelo e seus conhecimentos sobre ligações químicas resolva os itens abaixo, A) INDIQUE o tipo de ligação que unem os átomos de hidrogênio e oxigênio em cada molécula de água B) INDIQUE o tipo de ligação que unem as moléculas de água no cristal de gelo C) INDIQUE a ligação que é rompida durante a fusão do gelo. JUSTIFIQUE sua resposta. D) EXPLIQUE o fato do gelo ser menos denso que a água na fase líquida. 22)Observe, na tabela a seguir, alguns minerais e suas fórmulas químicas. Esses minerais foram separados em dois grupos: grupo X - minerais cuja fórmula química contém um elemento do quarto período da tabela periódica; grupo Y - minerais que não apresentam essa característica. Indique os minerais de cada grupo. Grupo X: _______________________________________________________________________ Grupo Y : _______________________________________________________________________ 23) Nas figuras I e II, estão representados dois sólidos cristalinos, sem defeitos, que exibem dois tipos diferentes de ligação química: Figura I Considerando-se essas informações, resolva os itens: Figura II a) Indique a figura que representa o sólido condutor de eletricidade. Justifique sua escolha. b) Indique a figura que representa um sólido que torna bom condutor de corrente elétrica ao ser dissolvido em água. Justifique sua escolha. 24) A geometria de uma molécula indica a disposição dos átomos em relação aos outros numa imagem que pode ser plana ou tridimensional. Simplificadamente, a geometria das moléculas são classificadas em linear, angular, trigonal plana, piramidal e tetraédrica, conforme disposição espacial dos átomos nas figuras abaixo: A polaridade de uma molécula depende da diferença de eletronegatividade entre seu átomos e da sua geometria molecular. Considerando as informações dadas e seus conhecimentos sobre geometria e polaridade das moléculas, INDIQUE a geometria e a polaridade das moléculas que constituem os compostos abaixo: Compostos Tetracloreto de carbono – CCl4 Geometria Polaridade Nitrogênio molecular – N2 Sulfeto de hidrogênio – H2S Tricloreto de Boro – BCl3 Aldeido fórmico – COH2 Arsenieto de hidrogênio – AsH3 25)Considere os seguintes compostos, todos contendo cloro: Cloreto de bário - BaCl2; Cloreto de metila - CH3Cl; Tetracloreto de carbono - CCl4; Cloreto de sódio- NaCl; Cloreto de hidrogênio- HCl; Gás cloro - Cl2. a) Indique os compostos que resultam da atração entre cátions e ânions e represente sua fórmula eletrônica(Lewis). b) Indique os compostos que são formados por moléculas e represente a fórmula de Lewis(eletrônica) e estrutural de cada molécula. 26)As equações representam transformações que ocorrem com algumas substâncias: I) Sublimação do iodo(I2) : I2(g) → I2(s) II) Vaporização da água: H2O(l) → H2O(v) III) Produção de gelo seco : CO2(g) → CO2(s) + IV) Fusão da soda cáustica: NaOH(s) → Na (l) + OH (l) V) Atomização do sulfeto de hidrogênio: H2S(g) → 2 H(g) + S(g) a) Indique as transformações que ocorrem com Rompimento de ligação: _________________________ Formação de ligação: ___________________________ b) Indique o nome da ligação formada/rompida em cada caso: I: _______________________ IV: ___________________________ II: ______________________ III: _______________________ V: ___________________________ 27) Considere cada uma das seguintes substâncias, todas no estado sólido: Cloreto de sódio, grafite e alumínio. A) CITE o sólido que não conduz corrente elétrica, se torna bom condutor quando fundido. JUSTIFIQUE o fato da substancia ser condutora no estado líquido. B) CITE o sólido cujo cristal é mantido coeso principalmente por ligação metálica e EXPLIQUE sua condutividade elétrica no estado sólido. 28) Uma estrutura de Lewis é constituída pelo símbolo de um elemento rodeado por um ponto que representa cada elétron de valência dos átomos desse elemento. Estruturas de Lewis de alguns elementos: Considerando as estruturas de Lewis dos átomos acima resolva os itens abaixo: a) Escreva a fórmula eletrônica e mínima de três compostos iônicos formados por eles b) Escreva a fórmula eletrônica, estrutural e molecular de três compostos cujos átomos estão unidos por ligação covalente. 29) Durante um experimento, seu professor de química pediu que você identificasse as soluções aquosas presentes em cada um dos béqueres (A, B) apresentados a seguir: Obsv.: a luz acende no béquer A e mantém apagada no béquer B a) Um dos béqueres contém uma solução aquosa de sacarose(açúcar) cuja fórmula molecular é C12H22O11. Identifique o béquer que contém a solução de sacarose. Justifique sua resposta. b) Um dos béqueres do experimento contém uma solução aquosa salina. Sabe-se que o sal dessa solução é um nitrato, ou seja possui o ânion nitrato(NO3-) ligado a um cátion. Sabendo que esse cátion pertence ao 3º período da família dos metais alcalinos terrosos(coluna 2A), identifique o béquer contém a solução salina e escreva a fórmula química do sal que compõe essa solução. Justifique a indicação do béquer. Disciplina: Química Série: 1ª A/B Atividade: PROGRAMA DE RECUPERAÇÃO E EXERCÍCIOS Aluno(a): 3ª etapa 2013 Prof.: Marco Antônio I - PERIODICIDADE QUÍMICA (TABELA PERIÓDICA) 4. Grupos(colunas ou famílias) e períodos. Elétrons de valência e localização dos elementos. 5. Configurações eletrônicas por níveis e elétrons de valência. 6. Periodicidade das propriedades atômicas: raio atômico, energia de ionização e eletronegatividade. Obs: Quanto a este item, espera-se que o aluno saiba: Identificar número atômico, grupos e período na tabela periódica moderna; Fazer configuração dos elementos utilizando as informações da tabela periódica; Interpretar tabelas e gráficos de energia de ionização; Fazer a relação entre energia de ionização e raio atômico quanto ao efeito da carga nuclear e da distância média entre elétrons de valência e núcleo. II - LIGAÇÕES QUÍMICAS E INTERAÇÕES INTERMOLECULARES 8. Modelos de ligações químicas (IÔNICA, COVALENTE E METÁLICA) - Representação de fórmulas estruturais e eletrônicas(Lewis); 9. Regra do octeto: utilização na formulação de compostos com dois elementos químicos; 10. Representação de fórmula de compostos iônico(equilíbrio de cargas elétricas); 11. Modelo de interações intermoleculares(LIGAÇÃO DE HIDROGÊNIO, DIPOLO-PERMANENTE E DIPOLO INDUZIDO); 12. Geometria e polaridade; 13. Substâncias iônicas, moleculares, covalentes e metálicas. 14. Propriedades macroscópicas de substâncias sólidas, líquidas e gasosas e de soluções: correlação com os modelos de ligações químicas e de interações intermoleculares. Orientação para estudo: O conteúdo da recuperação encontra-se em todo volume 1 e o volume 2(1º capítulo) da coleção Pitágoras da 1ª série do ensino médio e, nas anotações feitas em sala, Revise os exercícios e as provas feitas e as atividades práticas, realizadas em sala. Bons Estudos Marco Antônio EXERCÍCIOS DE RECUPERAÇÃO – QUÍMICA-1º ANO/EM 01)Considere as seguintes informações sobre os elementos químicos X, Y e Z: Elemento Família ou grupo Período X Calcogênios 3 Y 14 2 Z Metal Alcalinos 4 a) RESPONDA: Quais são os elementos X, Y e Z? b) Escreva a fórmula do composto formado entre X e Z. Explique por que a ligação entre estes dois elementos é classificada como iônica? c) INDIQUE a ordem crescente da energia de ionização desses elementos. 02) A tabela abaixo representa alguns Elemento Sódio Potássio Bário Ferro Ferro cátions e ânions Cátion Elemento Na+ Cloro + K Fluor Ba2+ Oxigênio Fe2+ Enxofre Fe3+ Nitrogênio Utilizando a tabela construa a fórmula dos seguintes compostos: a) fluoreto de sódio b) cloreto de bário c) sulfeto de sódio e) óxido de ferro II f) óxido de potássio Ânion Cl– F– O2– S2– N3– d) óxido de ferro III 03) Na chamada experiência de Rutherford, uma lâmina fina de ouro foi bombardeada com um feixe de partículas alfa (He2+). Esperava-se que todas as partículas atravessassem a lâmina, sofrendo, no máximo, pequenos desvios em sua trajetória. Surpreendentemente, porém, foi observado que uma pequena fração das partículas alfa sofria grandes desvios em relação às suas trajetórias originais. Para explicar esse resultado, Rutherford propôs a existência do núcleo atômico. A) JUSTIFIQUE por que a introdução do conceito do núcleo atômico permite explicar os grandes desvios nas trajetórias das partículas alfa. B) Suponha que, em vez de uma lâmina de ouro, se usasse uma lâmina de alumínio. Nesse caso, a fração de partículas alfa que sofreria grandes desvios seria menor, igual ou maior do que na experiência com a lâmina de ouro? JUSTIFIQUE sua resposta. 04) Considere os átomos indicados no quadro seguinte: NUMERO DE ÁTOMO I II III IV V PROTÓNS NÊUTRONS 19 22 18 19 35 20 25 22 21 45 ELÉTRONS 18 20 18 19 36 Responda: e) Quais são isótopos? Justifique sua escolha. f) Quais são cátions? Justifique sua escolha. g) Determine o número de massa dos átomos II e V. h) Relacione o tamanho (raio atômico) dos átomos I e IV. 05) O quadro abaixo estão representadas as 6 energias de ionização(kca/mol) para a retirada dos 6 elétrons de um determinado elemento químico: E1 E2 E3 E4 E5 E6 259,6 562,2 1104 1487 9034 11300 Tendo como base esse quadro, responda: d) Qual o número de níveis de energia possui esse elemento? Justifique. e) Qual o número de elétrons de valência possui esse elemento químico? Justifique. f) Localize esse elemento na tabela periódica 06) Escreva a fórmula de Lewis e a fórmula estrutural das moléculas que constituem os compostos abaixo Sulfeto de hidrogênio - H2S Formol - COH2 Iodo-I2 Fosfina – PH3 Tetracloreto de carbono -CCℓ4 07) Considere a configuração eletrônica dos seguintes átomos neutros: Cálcio(Ca) : 2 8 8 2 Sódio(Na) : 2 8 1 Enxofre(S): 2 8 6 Cloro(Cl) : 2 8 7 A) Faça a distribuição eletrônica do íon mais provável de um átomo de cálcio. B) Qual(is) desses elementos possuem uma maior tendência a formar ânions numa ligação iônica? C) Qual o nome da ligação que ocorre entre átomos de sódio e enxofre? Qual a formula do composto? D) Coloque esses elementos em ordem crescente de eletronegatividade 08) Localize o Potássio(K) e o enxofre(S) na tabela periódica A) ESCREVA a configuração eletrônica de átomos neutros desses elementos B) ESCREVA a configuração eletrônica dos íons mais prováveis, formados a partir desses átomos C) REPRESENTE a fórmula mais provável do composto iônico formado entre esses dois átomos 09) O Carbono tem uma química muito mais extensa que a dos demais elementos da tabela periódica, exceto o hidrogênio. a) Comparado aos outros elementos do segundo período da tabela periódica, o carbono é aquele cujos átomos tem a capacidade de fazer uma maior quantidade de ligações covalentes simples. INDIQUE quantas ligações covalentes simples com átomos de hidrogênio podem ser formadas, em moléculas neutras, por um átomo de cada um destes quatro elementos: Carbono, Nitrogênio, Oxigênio e Flúor. Átomos C N O F Número de ligações b) JUSTIFIQUE a sua resposta ao item a desta questão, no caso dos átomos de carbono e nitrogênio, em termos de configuração eletrônica de valência desses átomos. 10)Considere os átomos indicados no quadro seguinte: NUMERO DE ÁTOMO PROTÓNS NÊUTRONS Potássio Titânio Enxofre Potássio Bromo 19 22 16 19 35 20 25 17 21 45 ELÉTRONS 18 20 18 19 36 Tendo como base as informações desse quadro e seus conhecimentos sobre a estrutura atômica, A) RESPONDA: Qual desses átomos representam o mesmo elemento químico? JUSTIFIQUE. B) DETERMINE o número de massa dos isótopos. C ) RESPONDA Quais são ânions? JUSTIFIQUE sua escolha. D) RESPONDA Quais desses átomos são bons condutores de eletricidade no estado sólido devido a existência de “elétrons livres”. JUSTIFIQUE sua escolha. 11)Com base nos modelos de ligação química apropriada a cada caso, EXPLIQUE as causas A) da condutividade elétrica do bronze, uma liga de cobre(Cu) e estanho(Sn) no estado sólido B) da condutividade elétrica do hidróxido de sódio, soda cáustica (NaOH) dissolvido em água 12) Com base nos modelos de ligação química apropriada a cada caso, explique as causas A) da condutividade elétrica do iodeto de potássio(KI) dissolvido em água B) da condutividade elétrica do cobre(Cu) no estado sólido 13) Com base nos modelos de ligação química apropriados a cada caso, EXPLIQUE as causas a) da alta condutividade elétrica do cobre e de outros metais b) da solubilidade do etanol(C2H5OH) em água e da pouca solubilidade do tetracloreto de carbono(CCl 4) nesse mesmo solvente c) do alto ponto de fusão da grafita d) da condutividade elétrica do cloreto de sódio(NaCl) dissolvido em água 14) O desenho abaixo representa o modelo do NaCl, no estado sólido, com os íons afastados da posição real, para que se possa "enxergar" melhor a disposição dos íons Tendo como base o modelo de ligação iônica EXPLIQUE o fato do cloreto de sódio(NaCl) não conduzir eletricidade no estado sólido, uma vez que ele é formado por partículas(íons) com cargas positivas e negativas. 15) Utilize as informações da tabela para responder os itens abaixo: Substância Temperatura de fusão/ºC Temperatura de ebulição/C Hélio -He -269,5 -268,8 Cloreto de sódio - NaCl 801 1413 Tetracloreto de carbono – CCl4 -23 76,8 Dióxido de carbono – CO2 ------Sublima a -78,5 Diamante Acima de 3500 Acima de 4200 Metano – CH4 -184 -162 Água – H2O 0 100 a) Em quais das substâncias da tabela as forças de atração intermoleculares são devidas , principalmente, às forças de Van der Waals(dipolo induzido)? b) Qual(is) da(s) substância(s) forma(m) um sólido molecular constituído de moléculas polares? c) Em que substância ocorre a força de interação mais fraca? d) Em qual(is) substância(s) ocorre(m) ligações predominantemente iônicas? 16) Na tabela abaixo, estão relacionadas as propriedades de algumas substâncias sólidas, bem como os resultados de testes simples a que foram submetidas. As substâncias estão designadas arbitrariamente pelas primeiras letras do alfabeto. Substância Temperatura Densidade Solubilidade Condutividade elétrica a 25ºC de fusão/ºC (g/mL) em água a Dissolvido No estado 25ºC em água sólido A 1083 8,92 insolúvel Conduz B 185 1,58 solúvel Não conduz Não conduz C 3550 3,51 insolúvel Não conduz D 1535 7,86 insolúvel Conduz E 620 3,39 solúvel conduz Não conduz F 80 1,02 solúvel Não conduz Não conduz Com base na tabela, complete o quadro: a) indicando as substâncias moleculares, covalentes, iônicas e metálicas; b) citando, pelo menos dois critérios utilizados para a classificação; c) indicando o tipo de ligação ou interação intermolecular quebrada no processo de fusão dessas substâncias. Use as informações do quadro abaixo e seus conhecimentos sobre ligações químicas para resolver as questões 17, 18 e 19 sólido Comporta mento Solubilidade Sob aquecimento Em água Funde-se a 1083 ºC Cloreto de Funde-se a Sódio 801 ºC sacarose Funde-se a 185/186ºC Insolúvel Bom condutor Condutividade Elétrica em Solução aquosa ----------- Solúvel Mau condutor Bom condutor Solúvel Mau condutor Mau condutor Naftalina Insolúvel Mau condutor --------------- Cobre Funde-se a 80ºC Condutividade Elétrica no Estado sólido 17) EXPLIQUE o fato do cloreto de sódio, em solução aquosa conduzir corrente elétrica e de que o açúcar nas mesmas condições, não conduz? 18) EXPLIQUE o fato do cloreto de sódio não conduzir eletricidade no estado sólido, uma vez que ele é formado por partículas(íons) com cargas positivas e negativas? 19 ) Durante a fusão de um sólido ligações químicas são rompidas. Essas ligações podem ser ligações entre átomos(iônica, covalente, metálica) ou ligações entre moléculas(ligação de hidrogênio, dipolo permanente, dipolo induzido). Quais sólidos do quadro que durante a fusão são rompidas ligações entre moléculas? JUSTIFIQUE. 20) O Quadro abaixo mostra a configuração eletrônica para átomos neutros de alguns elementos químicos: K L M N O Cálcio(Ca) 2 8 8 2 Bromo(Br) 2 8 18 7 Ferro(Fe) 2 8 14 2 Rubídio(Rb) 2 8 18 8 1 Iodo(I) 2 8 18 18 7 A) REPRESENTE o íon mais provável formado pelos átomos de cálcio e ESCREVA sua configuração eletrônica B) REPRESENTE o íon mais provável formado pelos átomos de iodo e ESCREVA sua configuração eletrônica C) INDIQUE a ligação que ocorre entre os átomos de cálcio e iodo e ESCREVA a fórmula do composto formado entre esses dois átomos D) EXPLIQUE a condutividade elétrica do composto do item A 21) A água é, sem dúvida, o mais comum e mais importante de todos os compostos. Graças às propriedades da água, a vida foi capaz de surgir e se desenvolver em nosso planeta. A figura abaixo representa a nível macroscópico o arranjo cristalino do gelo:Esse arranjo é bastante ‘aberto’, pois as moléculas acomodam-se em desenhos hexagonais, restando grandes espaços “ vazios” no interior desses hexágonos. Considerando-se o arranjo cristalino do gelo e seus conhecimentos sobre ligações químicas resolva os itens abaixo, A) INDIQUE o tipo de ligação que unem os átomos de hidrogênio e oxigênio em cada molécula de água B) INDIQUE o tipo de ligação que unem as moléculas de água no cristal de gelo C) INDIQUE a ligação que é rompida durante a fusão do gelo. JUSTIFIQUE sua resposta. D) EXPLIQUE o fato do gelo ser menos denso que a água na fase líquida. 22)Observe, na tabela a seguir, alguns minerais e suas fórmulas químicas. Esses minerais foram separados em dois grupos: grupo X - minerais cuja fórmula química contém um elemento do quarto período da tabela periódica; grupo Y - minerais que não apresentam essa característica. Indique os minerais de cada grupo. Grupo X: _______________________________________________________________________ Grupo Y : _______________________________________________________________________ 23) Nas figuras I e II, estão representados dois sólidos cristalinos, sem defeitos, que exibem dois tipos diferentes de ligação química: Figura I Considerando-se essas informações, resolva os itens: Figura II c) Indique a figura que representa o sólido condutor de eletricidade. Justifique sua escolha. d) Indique a figura que representa um sólido que torna bom condutor de corrente elétrica ao ser dissolvido em água. Justifique sua escolha. 24) A geometria de uma molécula indica a disposição dos átomos em relação aos outros numa imagem que pode ser plana ou tridimensional. Simplificadamente, a geometria das moléculas são classificadas em linear, angular, trigonal plana, piramidal e tetraédrica, conforme disposição espacial dos átomos nas figuras abaixo: A polaridade de uma molécula depende da diferença de eletronegatividade entre seu átomos e da sua geometria molecular. Considerando as informações dadas e seus conhecimentos sobre geometria e polaridade das moléculas, INDIQUE a geometria e a polaridade das moléculas que constituem os compostos abaixo: Compostos Tetracloreto de carbono – CCl4 Geometria Polaridade Nitrogênio molecular – N2 Sulfeto de hidrogênio – H2S Tricloreto de Boro – BCl3 Aldeido fórmico – COH2 Arsenieto de hidrogênio – AsH3 25)Considere os seguintes compostos, todos contendo cloro: Cloreto de bário - BaCl2; Cloreto de metila - CH3Cl; Tetracloreto de carbono - CCl4; Cloreto de sódio- NaCl; Cloreto de hidrogênio- HCl; Gás cloro - Cl2. a) Indique os compostos que resultam da atração entre cátions e ânions e represente sua fórmula eletrônica(Lewis). b) Indique os compostos que são formados por moléculas e represente a fórmula de Lewis(eletrônica) e estrutural de cada molécula. 26)As equações representam transformações que ocorrem com algumas substâncias: VI) Sublimação do iodo(I2) : I2(g) → I2(s) VII) Vaporização da água: H2O(l) → H2O(v) VIII) Produção de gelo seco : CO2(g) → CO2(s) + IX) Fusão da soda cáustica: NaOH(s) → Na (l) + OH (l) X) Atomização do sulfeto de hidrogênio: H2S(g) → 2 H(g) + S(g) c) Indique as transformações que ocorrem com Rompimento de ligação: _________________________ Formação de ligação: ___________________________ d) Indique o nome da ligação formada/rompida em cada caso: I: _______________________ IV: ___________________________ II: ______________________ III: _______________________ V: ___________________________ 27) Considere cada uma das seguintes substâncias, todas no estado sólido: Cloreto de sódio, grafite e alumínio. A) CITE o sólido que não conduz corrente elétrica, se torna bom condutor quando fundido. JUSTIFIQUE o fato da substancia ser condutora no estado líquido. B) CITE o sólido cujo cristal é mantido coeso principalmente por ligação metálica e EXPLIQUE sua condutividade elétrica no estado sólido. 28) Uma estrutura de Lewis é constituída pelo símbolo de um elemento rodeado por um ponto que representa cada elétron de valência dos átomos desse elemento. Estruturas de Lewis de alguns elementos: Considerando as estruturas de Lewis dos átomos acima resolva os itens abaixo: a) Escreva a fórmula eletrônica e mínima de três compostos iônicos formados por eles b) Escreva a fórmula eletrônica, estrutural e molecular de três compostos cujos átomos estão unidos por ligação covalente. 29) Durante um experimento, seu professor de química pediu que você identificasse as soluções aquosas presentes em cada um dos béqueres (A, B) apresentados a seguir: Obsv.: a luz acende no béquer A e mantém apagada no béquer B c) Um dos béqueres contém uma solução aquosa de sacarose(açúcar) cuja fórmula molecular é C12H22O11. Identifique o béquer que contém a solução de sacarose. Justifique sua resposta. d) Um dos béqueres do experimento contém uma solução aquosa salina. Sabe-se que o sal dessa solução é um nitrato, ou seja possui o ânion nitrato(NO3-) ligado a um cátion. Sabendo que esse cátion pertence ao 3º período da família dos metais alcalinos terrosos(coluna 2A), identifique o béquer contém a solução salina e escreva a fórmula química do sal que compõe essa solução. Justifique a indicação do béquer. Disciplina: Química Série: 1ª A/B Atividade: PROGRAMA DE RECUPERAÇÃO E EXERCÍCIOS Aluno(a): 3ª etapa 2013 Prof.: Marco Antônio I - PERIODICIDADE QUÍMICA (TABELA PERIÓDICA) 7. Grupos(colunas ou famílias) e períodos. Elétrons de valência e localização dos elementos. 8. Configurações eletrônicas por níveis e elétrons de valência. 9. Periodicidade das propriedades atômicas: raio atômico, energia de ionização e eletronegatividade. Obs: Quanto a este item, espera-se que o aluno saiba: Identificar número atômico, grupos e período na tabela periódica moderna; Fazer configuração dos elementos utilizando as informações da tabela periódica; Interpretar tabelas e gráficos de energia de ionização; Fazer a relação entre energia de ionização e raio atômico quanto ao efeito da carga nuclear e da distância média entre elétrons de valência e núcleo. II - LIGAÇÕES QUÍMICAS E INTERAÇÕES INTERMOLECULARES 15. Modelos de ligações químicas (IÔNICA, COVALENTE E METÁLICA) - Representação de fórmulas estruturais e eletrônicas(Lewis); 16. Regra do octeto: utilização na formulação de compostos com dois elementos químicos; 17. Representação de fórmula de compostos iônico(equilíbrio de cargas elétricas); 18. Modelo de interações intermoleculares(LIGAÇÃO DE HIDROGÊNIO, DIPOLO-PERMANENTE E DIPOLO INDUZIDO); 19. Geometria e polaridade; 20. Substâncias iônicas, moleculares, covalentes e metálicas. 21. Propriedades macroscópicas de substâncias sólidas, líquidas e gasosas e de soluções: correlação com os modelos de ligações químicas e de interações intermoleculares. Orientação para estudo: O conteúdo da recuperação encontra-se em todo volume 1 e o volume 2(1º capítulo) da coleção Pitágoras da 1ª série do ensino médio e, nas anotações feitas em sala, Revise os exercícios e as provas feitas e as atividades práticas, realizadas em sala. Bons Estudos Marco Antônio EXERCÍCIOS DE RECUPERAÇÃO – QUÍMICA-1º ANO/EM 01)Considere as seguintes informações sobre os elementos químicos X, Y e Z: Elemento Família ou grupo Período X Calcogênios 3 Y 14 2 Z Metal Alcalinos 4 a) RESPONDA: Quais são os elementos X, Y e Z? b) Escreva a fórmula do composto formado entre X e Z. Explique por que a ligação entre estes dois elementos é classificada como iônica? c) INDIQUE a ordem crescente da energia de ionização desses elementos. 02) A tabela abaixo representa alguns cátions e ânions Elemento Cátion Elemento + Sódio Na Cloro Ânion Cl– Potássio Bário Ferro Ferro K+ Ba2+ Fe2+ Fe3+ Fluor Oxigênio Enxofre Nitrogênio Utilizando a tabela construa a fórmula dos seguintes compostos: a) fluoreto de sódio b) cloreto de bário c) sulfeto de sódio e) óxido de ferro II f) óxido de potássio F– O2– S2– N3– d) óxido de ferro III 03) Na chamada experiência de Rutherford, uma lâmina fina de ouro foi bombardeada com um feixe de partículas alfa (He2+). Esperava-se que todas as partículas atravessassem a lâmina, sofrendo, no máximo, pequenos desvios em sua trajetória. Surpreendentemente, porém, foi observado que uma pequena fração das partículas alfa sofria grandes desvios em relação às suas trajetórias originais. Para explicar esse resultado, Rutherford propôs a existência do núcleo atômico. A) JUSTIFIQUE por que a introdução do conceito do núcleo atômico permite explicar os grandes desvios nas trajetórias das partículas alfa. B) Suponha que, em vez de uma lâmina de ouro, se usasse uma lâmina de alumínio. Nesse caso, a fração de partículas alfa que sofreria grandes desvios seria menor, igual ou maior do que na experiência com a lâmina de ouro? JUSTIFIQUE sua resposta. 04) Considere os átomos indicados no quadro seguinte: NUMERO DE ÁTOMO I II III IV V PROTÓNS NÊUTRONS 19 22 18 19 35 20 25 22 21 45 ELÉTRONS 18 20 18 19 36 Responda: i) Quais são isótopos? Justifique sua escolha. j) Quais são cátions? Justifique sua escolha. k) Determine o número de massa dos átomos II e V. l) Relacione o tamanho (raio atômico) dos átomos I e IV. 05) O quadro abaixo estão representadas as 6 energias de ionização(kca/mol) para a retirada dos 6 elétrons de um determinado elemento químico: E1 E2 E3 E4 E5 E6 259,6 562,2 1104 1487 9034 11300 Tendo como base esse quadro, responda: g) Qual o número de níveis de energia possui esse elemento? Justifique. h) Qual o número de elétrons de valência possui esse elemento químico? Justifique. i) Localize esse elemento na tabela periódica 06) Escreva a fórmula de Lewis e a fórmula estrutural das moléculas que constituem os compostos abaixo Sulfeto de hidrogênio - H2S Formol - COH2 Iodo-I2 Fosfina – PH3 Tetracloreto de carbono -CCℓ4 07) Considere a configuração eletrônica dos seguintes átomos neutros: Cálcio(Ca) : 2 8 8 2 Sódio(Na) : 2 8 1 Enxofre(S): 2 8 6 Cloro(Cl) : 2 8 7 A) Faça a distribuição eletrônica do íon mais provável de um átomo de cálcio. B) Qual(is) desses elementos possuem uma maior tendência a formar ânions numa ligação iônica? C) Qual o nome da ligação que ocorre entre átomos de sódio e enxofre? Qual a formula do composto? D) Coloque esses elementos em ordem crescente de eletronegatividade 08) Localize o Potássio(K) e o enxofre(S) na tabela periódica A) ESCREVA a configuração eletrônica de átomos neutros desses elementos B) ESCREVA a configuração eletrônica dos íons mais prováveis, formados a partir desses átomos C) REPRESENTE a fórmula mais provável do composto iônico formado entre esses dois átomos 09) O Carbono tem uma química muito mais extensa que a dos demais elementos da tabela periódica, exceto o hidrogênio. a) Comparado aos outros elementos do segundo período da tabela periódica, o carbono é aquele cujos átomos tem a capacidade de fazer uma maior quantidade de ligações covalentes simples. INDIQUE quantas ligações covalentes simples com átomos de hidrogênio podem ser formadas, em moléculas neutras, por um átomo de cada um destes quatro elementos: Carbono, Nitrogênio, Oxigênio e Flúor. Átomos C N O F Número de ligações b) JUSTIFIQUE a sua resposta ao item a desta questão, no caso dos átomos de carbono e nitrogênio, em termos de configuração eletrônica de valência desses átomos. 10)Considere os átomos indicados no quadro seguinte: NUMERO DE ÁTOMO PROTÓNS NÊUTRONS Potássio Titânio Enxofre Potássio Bromo 19 22 16 19 35 20 25 17 21 45 ELÉTRONS 18 20 18 19 36 Tendo como base as informações desse quadro e seus conhecimentos sobre a estrutura atômica, A) RESPONDA: Qual desses átomos representam o mesmo elemento químico? JUSTIFIQUE. B) DETERMINE o número de massa dos isótopos. C ) RESPONDA Quais são ânions? JUSTIFIQUE sua escolha. D) RESPONDA Quais desses átomos são bons condutores de eletricidade no estado sólido devido a existência de “elétrons livres”. JUSTIFIQUE sua escolha. 11)Com base nos modelos de ligação química apropriada a cada caso, EXPLIQUE as causas A) da condutividade elétrica do bronze, uma liga de cobre(Cu) e estanho(Sn) no estado sólido B) da condutividade elétrica do hidróxido de sódio, soda cáustica (NaOH) dissolvido em água 12) Com base nos modelos de ligação química apropriada a cada caso, explique as causas A) da condutividade elétrica do iodeto de potássio(KI) dissolvido em água B) da condutividade elétrica do cobre(Cu) no estado sólido 13) Com base nos modelos de ligação química apropriados a cada caso, EXPLIQUE as causas a) da alta condutividade elétrica do cobre e de outros metais b) da solubilidade do etanol(C2H5OH) em água e da pouca solubilidade do tetracloreto de carbono(CCl 4) nesse mesmo solvente c) do alto ponto de fusão da grafita d) da condutividade elétrica do cloreto de sódio(NaCl) dissolvido em água 14) O desenho abaixo representa o modelo do NaCl, no estado sólido, com os íons afastados da posição real, para que se possa "enxergar" melhor a disposição dos íons Tendo como base o modelo de ligação iônica EXPLIQUE o fato do cloreto de sódio(NaCl) não conduzir eletricidade no estado sólido, uma vez que ele é formado por partículas(íons) com cargas positivas e negativas. 15) Utilize as informações da tabela para responder os itens abaixo: Substância Temperatura de fusão/ºC Temperatura de ebulição/C Hélio -He -269,5 -268,8 Cloreto de sódio - NaCl 801 1413 Tetracloreto de carbono – CCl4 -23 76,8 Dióxido de carbono – CO2 ------Sublima a -78,5 Diamante Acima de 3500 Acima de 4200 Metano – CH4 -184 -162 Água – H2O 0 100 a) Em quais das substâncias da tabela as forças de atração intermoleculares são devidas , principalmente, às forças de Van der Waals(dipolo induzido)? b) Qual(is) da(s) substância(s) forma(m) um sólido molecular constituído de moléculas polares? c) Em que substância ocorre a força de interação mais fraca? d) Em qual(is) substância(s) ocorre(m) ligações predominantemente iônicas? 16) Na tabela abaixo, estão relacionadas as propriedades de algumas substâncias sólidas, bem como os resultados de testes simples a que foram submetidas. As substâncias estão designadas arbitrariamente pelas primeiras letras do alfabeto. Substância Temperatura Densidade Solubilidade Condutividade elétrica a 25ºC de fusão/ºC (g/mL) em água a Dissolvido No estado 25ºC em água sólido A 1083 8,92 insolúvel Conduz B 185 1,58 solúvel Não conduz Não conduz C 3550 3,51 insolúvel Não conduz D 1535 7,86 insolúvel Conduz E 620 3,39 solúvel conduz Não conduz F 80 1,02 solúvel Não conduz Não conduz Com base na tabela, complete o quadro: a) indicando as substâncias moleculares, covalentes, iônicas e metálicas; b) citando, pelo menos dois critérios utilizados para a classificação; c) indicando o tipo de ligação ou interação intermolecular quebrada no processo de fusão dessas substâncias. Use as informações do quadro abaixo e seus conhecimentos sobre ligações químicas para resolver as questões 17, 18 e 19 sólido Comporta mento Solubilidade Sob aquecimento Em água Funde-se a 1083 ºC Cloreto de Funde-se a Sódio 801 ºC sacarose Funde-se a 185/186ºC Insolúvel Bom condutor Condutividade Elétrica em Solução aquosa ----------- Solúvel Mau condutor Bom condutor Solúvel Mau condutor Mau condutor Naftalina Insolúvel Mau condutor --------------- Cobre Funde-se a 80ºC Condutividade Elétrica no Estado sólido 17) EXPLIQUE o fato do cloreto de sódio, em solução aquosa conduzir corrente elétrica e de que o açúcar nas mesmas condições, não conduz? 18) EXPLIQUE o fato do cloreto de sódio não conduzir eletricidade no estado sólido, uma vez que ele é formado por partículas(íons) com cargas positivas e negativas? 19 ) Durante a fusão de um sólido ligações químicas são rompidas. Essas ligações podem ser ligações entre átomos(iônica, covalente, metálica) ou ligações entre moléculas(ligação de hidrogênio, dipolo permanente, dipolo induzido). Quais sólidos do quadro que durante a fusão são rompidas ligações entre moléculas? JUSTIFIQUE. 20) O Quadro abaixo mostra a configuração eletrônica para átomos neutros de alguns elementos químicos: K L M N O Cálcio(Ca) 2 8 8 2 Bromo(Br) 2 8 18 7 Ferro(Fe) 2 8 14 2 Rubídio(Rb) 2 8 18 8 1 Iodo(I) 2 8 18 18 7 A) REPRESENTE o íon mais provável formado pelos átomos de cálcio e ESCREVA sua configuração eletrônica B) REPRESENTE o íon mais provável formado pelos átomos de iodo e ESCREVA sua configuração eletrônica C) INDIQUE a ligação que ocorre entre os átomos de cálcio e iodo e ESCREVA a fórmula do composto formado entre esses dois átomos D) EXPLIQUE a condutividade elétrica do composto do item A 21) A água é, sem dúvida, o mais comum e mais importante de todos os compostos. Graças às propriedades da água, a vida foi capaz de surgir e se desenvolver em nosso planeta. A figura abaixo representa a nível macroscópico o arranjo cristalino do gelo:Esse arranjo é bastante ‘aberto’, pois as moléculas acomodam-se em desenhos hexagonais, restando grandes espaços “ vazios” no interior desses hexágonos. Considerando-se o arranjo cristalino do gelo e seus conhecimentos sobre ligações químicas resolva os itens abaixo, A) INDIQUE o tipo de ligação que unem os átomos de hidrogênio e oxigênio em cada molécula de água B) INDIQUE o tipo de ligação que unem as moléculas de água no cristal de gelo C) INDIQUE a ligação que é rompida durante a fusão do gelo. JUSTIFIQUE sua resposta. D) EXPLIQUE o fato do gelo ser menos denso que a água na fase líquida. 22)Observe, na tabela a seguir, alguns minerais e suas fórmulas químicas. Esses minerais foram separados em dois grupos: grupo X - minerais cuja fórmula química contém um elemento do quarto período da tabela periódica; grupo Y - minerais que não apresentam essa característica. Indique os minerais de cada grupo. Grupo X: _______________________________________________________________________ Grupo Y : _______________________________________________________________________ 23) Nas figuras I e II, estão representados dois sólidos cristalinos, sem defeitos, que exibem dois tipos diferentes de ligação química: Figura I Considerando-se essas informações, resolva os itens: Figura II e) Indique a figura que representa o sólido condutor de eletricidade. Justifique sua escolha. f) Indique a figura que representa um sólido que torna bom condutor de corrente elétrica ao ser dissolvido em água. Justifique sua escolha. 24) A geometria de uma molécula indica a disposição dos átomos em relação aos outros numa imagem que pode ser plana ou tridimensional. Simplificadamente, a geometria das moléculas são classificadas em linear, angular, trigonal plana, piramidal e tetraédrica, conforme disposição espacial dos átomos nas figuras abaixo: A polaridade de uma molécula depende da diferença de eletronegatividade entre seu átomos e da sua geometria molecular. Considerando as informações dadas e seus conhecimentos sobre geometria e polaridade das moléculas, INDIQUE a geometria e a polaridade das moléculas que constituem os compostos abaixo: Compostos Tetracloreto de carbono – CCl4 Geometria Polaridade Nitrogênio molecular – N2 Sulfeto de hidrogênio – H2S Tricloreto de Boro – BCl3 Aldeido fórmico – COH2 Arsenieto de hidrogênio – AsH3 25)Considere os seguintes compostos, todos contendo cloro: Cloreto de bário - BaCl2; Cloreto de metila - CH3Cl; Tetracloreto de carbono - CCl4; Cloreto de sódio- NaCl; Cloreto de hidrogênio- HCl; Gás cloro - Cl2. a) Indique os compostos que resultam da atração entre cátions e ânions e represente sua fórmula eletrônica(Lewis). b) Indique os compostos que são formados por moléculas e represente a fórmula de Lewis(eletrônica) e estrutural de cada molécula. 26)As equações representam transformações que ocorrem com algumas substâncias: XI) Sublimação do iodo(I2) : I2(g) → I2(s) XII) Vaporização da água: H2O(l) → H2O(v) XIII) Produção de gelo seco : CO2(g) → CO2(s) + XIV) Fusão da soda cáustica: NaOH(s) → Na (l) + OH (l) XV) Atomização do sulfeto de hidrogênio: H2S(g) → 2 H(g) + S(g) e) Indique as transformações que ocorrem com Rompimento de ligação: _________________________ Formação de ligação: ___________________________ f) Indique o nome da ligação formada/rompida em cada caso: I: _______________________ IV: ___________________________ II: ______________________ III: _______________________ V: ___________________________ 27) Considere cada uma das seguintes substâncias, todas no estado sólido: Cloreto de sódio, grafite e alumínio. A) CITE o sólido que não conduz corrente elétrica, se torna bom condutor quando fundido. JUSTIFIQUE o fato da substancia ser condutora no estado líquido. B) CITE o sólido cujo cristal é mantido coeso principalmente por ligação metálica e EXPLIQUE sua condutividade elétrica no estado sólido. 28) Uma estrutura de Lewis é constituída pelo símbolo de um elemento rodeado por um ponto que representa cada elétron de valência dos átomos desse elemento. Estruturas de Lewis de alguns elementos: Considerando as estruturas de Lewis dos átomos acima resolva os itens abaixo: a) Escreva a fórmula eletrônica e mínima de três compostos iônicos formados por eles b) Escreva a fórmula eletrônica, estrutural e molecular de três compostos cujos átomos estão unidos por ligação covalente. 29) Durante um experimento, seu professor de química pediu que você identificasse as soluções aquosas presentes em cada um dos béqueres (A, B) apresentados a seguir: Obsv.: a luz acende no béquer A e mantém apagada no béquer B e) Um dos béqueres contém uma solução aquosa de sacarose(açúcar) cuja fórmula molecular é C12H22O11. Identifique o béquer que contém a solução de sacarose. Justifique sua resposta. b) Um dos béqueres do experimento contém uma solução aquosa salina. Sabe-se que o sal dessa solução é um nitrato, ou seja possui o ânion nitrato(NO3-) ligado a um cátion. Sabendo que esse cátion pertence ao 3º período da família dos metais alcalinos terrosos(coluna 2A), identifique o béquer contém a solução salina e escreva a fórmula química do sal que compõe essa solução. Justifique a indicação do béquer.
Download